福建省晋江市五校2023-2024学年高一上学期期中联考化学试题
试卷更新日期:2024-01-17 类型:期中考试
一、选择题(每题只有一个选项符合题意,1-12每小题2分,13-18每小题3分,共42分)
-
1. 下列化学用语表示正确的是( )A、硫酸铁的化学式:FeSO4 B、硫原子的结构示意图:
 C、质量数为37的氯原子:
D、Cu(NO3)2的电离方程式:Cu(NO3)2=Cu2++(NO3)2-
2. 下列物质属于电解质的是( )A、二氧化硫 B、铜 C、硫酸钡 D、酒精3. 下列有关胶体性质和应用描述错误的是( )A、胶体区别于其他分散系的本质特征是分散质粒子的直径在1 nm~100 nm之间 B、“钴酞菁”的分子(直径为1.3×10-9 m)在水中形成的分散系既能透过滤纸,也能透过半透膜 C、光束通过大雾时会产生一条光亮的通路,是胶体的丁达尔效应 D、黄河入海口沙洲的形成与用卤水点豆腐,都体现了胶体聚沉的性质4. 下表中关于物质的分类正确的是( )
C、质量数为37的氯原子:
D、Cu(NO3)2的电离方程式:Cu(NO3)2=Cu2++(NO3)2-
2. 下列物质属于电解质的是( )A、二氧化硫 B、铜 C、硫酸钡 D、酒精3. 下列有关胶体性质和应用描述错误的是( )A、胶体区别于其他分散系的本质特征是分散质粒子的直径在1 nm~100 nm之间 B、“钴酞菁”的分子(直径为1.3×10-9 m)在水中形成的分散系既能透过滤纸,也能透过半透膜 C、光束通过大雾时会产生一条光亮的通路,是胶体的丁达尔效应 D、黄河入海口沙洲的形成与用卤水点豆腐,都体现了胶体聚沉的性质4. 下表中关于物质的分类正确的是( )酸
碱
盐
碱性氧化物
酸性氧化物
A
H2SO4
NaOH
BaCO3
CO
CO2
B
HNO3
KOH
NaHCO3
CaO
SO2
C
CH3COOH
Cu2(OH)2CO3
CaCl2
Na2O
SO3
D
NaHSO4
NH3
NaCl
CuO
NO2
A、A B、B C、C D、D5. 下列不属于氧化还原反应的是( )A、S + O 2 SO 2 B、3NO2+ H2O= 2HNO3+NO C、2Mg + CO22MgO + C D、Fe(OH)3 + 3HCl = FeCl3 + 3H2O6. 下列物质的转化,不能一步实现的是( )A、Fe2O3Fe(OH)3 B、K2SO4KOH C、ZnZnCl2 D、MgCl2Mg(OH)27. 一定条件下,碳酸钙可以发生一系列转化(如图所示),下列每步转化反应与选项中的反应类型匹配的是( ) A、分解反应、化合反应、复分解反应、复分解反应 B、分解反应、复分解反应、化合反应、复分解反应 C、分解反应、化合反应、复分解反应、置换反应 D、复分解反应、化合反应、复分解反应、分解反应8. 下列关于常见离子的检验方法和结论,其中正确的是( )A、用铂丝蘸取待测液在无色的火焰上灼烧,若有黄色火焰产生,证明原溶液一定有钠元素,没有钾元素 B、取待测液加入浓NaOH溶液,加热,用湿润的红色石蕊试纸放在试管口,试纸变蓝,证明原溶液一定有 C、取待测液加盐酸酸化的BaCl2溶液,产生白色沉淀,证明原溶液一定有SO42- D、取待测液加入溶液,有白色沉淀生成,证明原溶液一定有9. 下列实验中,所选装置不合理的是( )
A、分解反应、化合反应、复分解反应、复分解反应 B、分解反应、复分解反应、化合反应、复分解反应 C、分解反应、化合反应、复分解反应、置换反应 D、复分解反应、化合反应、复分解反应、分解反应8. 下列关于常见离子的检验方法和结论,其中正确的是( )A、用铂丝蘸取待测液在无色的火焰上灼烧,若有黄色火焰产生,证明原溶液一定有钠元素,没有钾元素 B、取待测液加入浓NaOH溶液,加热,用湿润的红色石蕊试纸放在试管口,试纸变蓝,证明原溶液一定有 C、取待测液加盐酸酸化的BaCl2溶液,产生白色沉淀,证明原溶液一定有SO42- D、取待测液加入溶液,有白色沉淀生成,证明原溶液一定有9. 下列实验中,所选装置不合理的是( )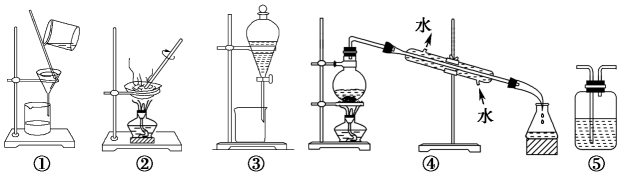 A、粗盐提纯,选①和② B、用CCl4萃取碘水中的碘,选③ C、分离植物油和水,选④ D、用澄清石灰水溶液检验CO2 , 选⑤10. 某化学兴趣小组在实验室中进行化学实验,按如图甲连接好线路发现灯泡不亮,按图乙连接好线路发现灯泡亮,由此得出的结论正确的是( )
A、粗盐提纯,选①和② B、用CCl4萃取碘水中的碘,选③ C、分离植物油和水,选④ D、用澄清石灰水溶液检验CO2 , 选⑤10. 某化学兴趣小组在实验室中进行化学实验,按如图甲连接好线路发现灯泡不亮,按图乙连接好线路发现灯泡亮,由此得出的结论正确的是( ) A、图甲连接好线路发现灯泡不亮,证明NaCl固体是非电解质 B、NaCl溶于水,在通电的条件下才能电离出自由移动的离子 C、甲的NaCl固体中无自由移动的阴阳离子,因此不能导电 D、图乙连接好线路灯泡亮,证明NaCl溶液是电解质11. 设NA表示阿伏加德罗常数的值,下列说法正确的是( )A、常温常压下,32g氧气含有的电子数目为16NA B、标准状况下,22.4LH2O所含的分子数目为NA C、0.1mol Mg变为Mg2+时,得到的电子数目为0.2NA D、0.5mol·L﹣1的AlCl3溶液中含有的Cl-的数目为1.5 NA12. 某元素R的阳离子Rn+ , 其核外共有X个电子,该元素的原子的质量数为A,则该元素的核内中子数为( )A、A-X-n B、A+X-n C、A+X+n D、A-X+n13. 某溶液由个数之比为1∶2∶3∶1的、、、M组成,则离子M可能是( )A、Ca2+ B、 C、 D、14. 下列溶液中Cl-的浓度与25mL 0.15 mol/L MgCl2溶液相同的是( )A、10 mL 0.05 mol/LAlCl3溶液 B、150 mL0.1 mol/LNH4Cl溶液 C、含Ba2+浓度为0.3 mol/L 的BaCl2溶液 D、100 mL0.4 mol/L HCl溶液与100 mL0.2mol/L NaCl溶液的混合溶液(溶液混合时体积变化忽略不计)15. 同温同压下,在体积相同的两个密闭容器中分别充满CH4、CO2气体,下列说法不正确的是 ( )A、两种气体的分子数目相等 B、两种气体的质量不相等 C、两种气体的碳原子数目相等 D、两种气体的密度相等16. 设NA为阿伏加德罗常数的值,如果a g某气态双原子分子的分子数为p,则b g该气体在标准状况下的体积V(L)是( )A、 B、 C、 D、17. 某无色透明溶液中可能含有下列离子中的一种或几种:Na+、Mg2+、Cu2+、OH-、Cl-、
A、图甲连接好线路发现灯泡不亮,证明NaCl固体是非电解质 B、NaCl溶于水,在通电的条件下才能电离出自由移动的离子 C、甲的NaCl固体中无自由移动的阴阳离子,因此不能导电 D、图乙连接好线路灯泡亮,证明NaCl溶液是电解质11. 设NA表示阿伏加德罗常数的值,下列说法正确的是( )A、常温常压下,32g氧气含有的电子数目为16NA B、标准状况下,22.4LH2O所含的分子数目为NA C、0.1mol Mg变为Mg2+时,得到的电子数目为0.2NA D、0.5mol·L﹣1的AlCl3溶液中含有的Cl-的数目为1.5 NA12. 某元素R的阳离子Rn+ , 其核外共有X个电子,该元素的原子的质量数为A,则该元素的核内中子数为( )A、A-X-n B、A+X-n C、A+X+n D、A-X+n13. 某溶液由个数之比为1∶2∶3∶1的、、、M组成,则离子M可能是( )A、Ca2+ B、 C、 D、14. 下列溶液中Cl-的浓度与25mL 0.15 mol/L MgCl2溶液相同的是( )A、10 mL 0.05 mol/LAlCl3溶液 B、150 mL0.1 mol/LNH4Cl溶液 C、含Ba2+浓度为0.3 mol/L 的BaCl2溶液 D、100 mL0.4 mol/L HCl溶液与100 mL0.2mol/L NaCl溶液的混合溶液(溶液混合时体积变化忽略不计)15. 同温同压下,在体积相同的两个密闭容器中分别充满CH4、CO2气体,下列说法不正确的是 ( )A、两种气体的分子数目相等 B、两种气体的质量不相等 C、两种气体的碳原子数目相等 D、两种气体的密度相等16. 设NA为阿伏加德罗常数的值,如果a g某气态双原子分子的分子数为p,则b g该气体在标准状况下的体积V(L)是( )A、 B、 C、 D、17. 某无色透明溶液中可能含有下列离子中的一种或几种:Na+、Mg2+、Cu2+、OH-、Cl-、CO、SO、NO。现进行如下实验:
①用红色石蕊试纸检验,试纸变蓝色。
②另取少量溶液逐滴滴加盐酸至过量,有气体放出,再加入BaCl2溶液后,没有沉淀生成。
③另取少量溶液用足量硝酸酸化后,加入AgNO3溶液有白色沉淀生成。
根据上述实验推断:原溶液中肯定含有的离子是( )
A、Cu2+ 、OH-、Cl-、CO B、Na+、Mg2+、Cl-、SO C、OH-、Cl-、CO、NO D、Na+、OH-、Cl-、CO18. 高纯碳酸钙广泛应用于精密电子陶瓷、医药等生产。如图为模拟制备高纯碳酸钙的主要流程,已知该大理石中杂质是二氧化硅和氧化铁。下列有关说法错误的是( )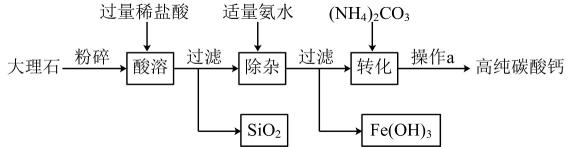 A、由“酸溶”可知,二氧化硅不溶于水和稀盐酸 B、“除杂”中,氨水只与溶液中的氯化铁反应 C、“转化”发生的主要反应是(NH4)2CO3+CaCl2=CaCO3↓+2NH4Cl D、操作a为组合操作,包含过滤、洗涤、干燥
A、由“酸溶”可知,二氧化硅不溶于水和稀盐酸 B、“除杂”中,氨水只与溶液中的氯化铁反应 C、“转化”发生的主要反应是(NH4)2CO3+CaCl2=CaCO3↓+2NH4Cl D、操作a为组合操作,包含过滤、洗涤、干燥二、填空题(本题有5小题,共58分)
-
19. 已知几种元素的性质或原子结构的相关叙述如表所示,回答下列问题。
元素编号
元素性质或原子结构的相关叙述
T
失去一个电子后形成与Ne相同的核外电子排布
X
最外层电子数是次外层电子数的2倍
Y
其某种单质是空气的主要成分,也是最常见的助燃剂
Z
原子核外有3个电子层,最外层比次外层少1个电子
(1)、元素X的一种同位素用作相对原子质量的标准,这种同位素的原子符号是。X的另一种同位素可用来测定文物所属年代,这种同位素的原子符号是。(2)、Y形成的另一种单质,主要存在于地球的平流层中,被称作地球生物的保护伞,该单质的化学式是。(3)、元素Z在海水中含量非常高,海水中含Z元素的化合物主要是(填化学式),电离方程式为。(4)、画出T的原子结构示意图:。(5)、由X元素组成的单质在Y元素组成的常见单质中完全燃烧,生成的产物用足量的氢氧化钠溶液吸收,反应的化学方程式为。20. 利用太阳能光解水,制备的H2用于还原CO2合成有机物甲醇(CH3OH),可实现资源的再利用。回答下列问题:(1)、CH3OH的摩尔质量是g∙mol-1。(2)、2mol CO2中所含原子的物质的量为 mol。(3)、 g的氢气中所含H原子的数目与1mol CH3OH相同。(4)、含0.1NA个O的CO2中有个电子,标准状况下该CO2的体积为L。(5)、在标准状况下,H2和CO2的混合气体共11.2 L,质量为13.6 g,其中H2为 mol21. 葡萄糖氧化反应(C6H12O6+6O26CO2+6H2O)放出的热量是人体生命活动所需能量的重要来源。医学上葡萄糖溶液可作为药物的溶媒,同时能给病人补充体液和能量。(1)、葡萄糖是(填“电解质”或“非电解质”)。(2)、一袋500mL规格的医用葡萄糖注射液含葡萄糖50g,在实验室准确配制一份这样的葡萄糖溶液,需用到的玻璃仪器有:烧杯、玻璃棒、、。(3)、90g葡萄糖在人体内完全氧化供能,理论上需要消耗标准状况下的O2L。(4)、人体血糖(血液中的葡萄糖)正常值为3.9~6.1mmol/L。某人体检报告血糖值为0.92g/L的血糖(填“偏高”“正常”或“偏低”)。(5)、生化法处理污水需添加葡萄糖为微生物提供能量,污水中葡萄糖浓度达到0.04mol/L时处理效果较好。处理一份300mL的污水样本需要添加0.54mol/L葡萄糖溶液mL(忽略溶液混合时体积的变化)。22. 现有NaCl、Na2SO4和NaNO3的混合物,选择适当的试剂除去杂质,从而得到纯净的NaNO3晶体,相应的实验流程如图所示。已知NaNO3的溶解度受温度的影响较大。
请回答下列问题:
(1)、写出实验流程中下列物质的化学式:沉淀A , 试剂X。(2)、上述实验流程中①②③步均要进行的实验操作是(填操作名称)。(3)、上述实验流程中加入过量Na2CO3溶液的目的是。(4)、按此实验方案得到的溶液3中肯定含有(填化学式)杂质。为了解决这个问题,可以向溶液3中加入适量的(填化学式),之后通过蒸发浓缩,(填操作名称),过滤,洗涤、低温烘干可获得NaNO3晶体。23. 物质的量浓度是一种常用的溶液浓度表示方法,利用其进行定量分析计算比较方便。(1)、I.实验需要溶液475mL和硫酸溶液250mL。根据这两种溶液的配制情况回答下列问题:
下列操作中,能用容量瓶实现的有____(填序号)。A、配制一定体积准确浓度的标准溶液 B、测量容量瓶规格以下的任意体积的液体 C、准确稀释某一浓度的溶液 D、贮存溶液 E、用来加热溶解固体溶质(2)、根据计算用托盘天平称取所需的NaOH的质量为g。在实验中其他操作均正确,若定容时仰视刻度线,则所得溶液浓度(填“大于”“等于”或“小于”,下同)。若定容时,有少许蒸馏水洒落在容量瓶外,则所得溶液浓度。(3)、若用质量分数为98%、密度为的浓硫酸来配制,在下列配制过程示意图中,错误的是(填选项字母). (4)、II.在0.2L由NaCl、、CaCl2组成的混合液中,部分离子浓度大小如图所示。请回答下列问题:
(4)、II.在0.2L由NaCl、、CaCl2组成的混合液中,部分离子浓度大小如图所示。请回答下列问题:该混合液中的物质的量为mol,将该混合液加水稀释至体积为1L,稀释后溶液中的物质的量浓度为。
