福建泉州市四校2023-2024学年高一上学期期中联考化学试题
试卷更新日期:2024-01-17 类型:期中考试
一、单选题(共16题,每小题3分,共48分。每小题只有一个选项符合题意)
-
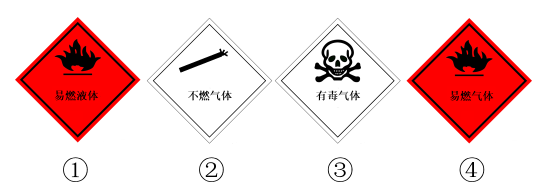
1. 下列是我国“国家最高科学技术奖”的几位获得者及其部分研究领域,其中研究领域与中药有效成分的分离提纯有关的是( )A、闵恩泽:石油化工催化剂 B、徐光宪:稀土金属化学 C、屠呦呦:青蒿素的发现与提取 D、王泽山:火炸药研究2. 古诗词是我国传统文化的瑰宝。下列关于诗词的解读错误的是( )A、“熬胆矾铁釜,久之亦化为铜”,该过程发生了置换反应 B、“风干日曝咸味加,始灌潮波增成卤”,海水晒盐涉及蒸发结晶的操作 C、“煤饼烧蛎房(贝壳)成灰”,该过程中包含分解反应和复分解反应 D、“雾失楼台,月迷津渡”,雾属于胶体,能产生丁达尔效应3. 2019年山东某公司发生了硫化氢中毒事故。硫化氢是无色、有刺激性恶臭、有毒、易燃的气体。储运硫化氢的储运瓶上应贴有的标签是( )
 A、①② B、①③ C、②③ D、③④4. 下列化学用语表示不正确的是 ( )A、氯离子的结构示意图:
A、①② B、①③ C、②③ D、③④4. 下列化学用语表示不正确的是 ( )A、氯离子的结构示意图: B、阿伏加德罗常数约为6.02×1023mol-1
C、Na+的摩尔质量是23g
D、NaHSO4在水中的电离方程式:NaHSO4=Na++ H++SO
5. 分类是科学研究的重要方法,下列物质分类正确的是( )A、淀粉溶液和烟都是胶体 B、固体NaCl、熔融HCl都能导电 C、硫酸、纯碱、食盐是按酸、碱、盐排列的 D、碱石灰、冰水混合物都是混合物6. 胶体与人类生活有密切的关系,下列现象不能用胶体知识解答的是( )
B、阿伏加德罗常数约为6.02×1023mol-1
C、Na+的摩尔质量是23g
D、NaHSO4在水中的电离方程式:NaHSO4=Na++ H++SO
5. 分类是科学研究的重要方法,下列物质分类正确的是( )A、淀粉溶液和烟都是胶体 B、固体NaCl、熔融HCl都能导电 C、硫酸、纯碱、食盐是按酸、碱、盐排列的 D、碱石灰、冰水混合物都是混合物6. 胶体与人类生活有密切的关系,下列现象不能用胶体知识解答的是( ) A、重金属中毒,可喝豆浆缓解 B、树林中出现的晨曦(如图) C、将稀硫酸逐滴加入Fe(OH)3胶体中,开始产生红褐色沉淀,继续滴加沉淀溶解 D、针对严重肾病患者的血液透析治疗7. 实验是研究物质组成、结构和性质的重要方法。下列实验操作,正确的是( )A、蒸馏过程中若发现忘加沸石,应立即补加 B、加入硝酸酸化的硝酸银溶液,有白色沉淀产生,一定有Cl- C、用洁净铂丝蘸取溶液进行焰色反应,火焰呈黄色,则原溶液中有Na+ , 无K+ D、用苯萃取碘水中
A、重金属中毒,可喝豆浆缓解 B、树林中出现的晨曦(如图) C、将稀硫酸逐滴加入Fe(OH)3胶体中,开始产生红褐色沉淀,继续滴加沉淀溶解 D、针对严重肾病患者的血液透析治疗7. 实验是研究物质组成、结构和性质的重要方法。下列实验操作,正确的是( )A、蒸馏过程中若发现忘加沸石,应立即补加 B、加入硝酸酸化的硝酸银溶液,有白色沉淀产生,一定有Cl- C、用洁净铂丝蘸取溶液进行焰色反应,火焰呈黄色,则原溶液中有Na+ , 无K+ D、用苯萃取碘水中 碘,有机层从分液漏斗的下口放出,颜色为紫红色
8. 下列实验装置及操作都正确的是( )
碘,有机层从分液漏斗的下口放出,颜色为紫红色
8. 下列实验装置及操作都正确的是( ) A、图甲:萃取中的分液过程 B、图乙:蒸干溶液制碳酸氢氨固体 C、图丙:过滤Ca(OH)2悬浊液 D、图丁:蒸馏自来水获取蒸馏水9. 张青莲是我国著名的化学家,1991年他准确测得In的相对原子质量为114.818,被国际相对原子质量委员会采用为新的标准值。这是相对原子质量表中首次采用我国测定的相对原子质量值。则下列关于In的说法中,错误的是( )A、In原子核外有49个电子 B、In原子核内有49个中子 C、In原子的质量数为115 D、In是In元素的一种核素10. 用NA表示阿伏加德罗常数的值,下列说法中不正确的是 ( )A、含有 NA个氦原子的氦气在标准状况下的体积约为22.4L B、25℃,1.01×105Pa,64g SO2中含有的原子数为3NA C、0.1mol O3分子中所含的电子数为2.4NA D、在标准状况下,11.2L H2O含有的分子数为0.5NA11. 下列体系中氯离子浓度最大的是( )A、标准状况下22.4L 氯气 B、2mL 0.3mo/L HCl溶液 C、10mL 0.2mol/LCaCl2溶液 D、1mL 0.5mol/L KClO3溶液12. 化学实验中若使某步中的有害产物作为另一步的反应物,形成一个循环,则可不再向环境排放该种有害物质。在如图所示有编号的反应中,属于氧化还原反应的有( )
A、图甲:萃取中的分液过程 B、图乙:蒸干溶液制碳酸氢氨固体 C、图丙:过滤Ca(OH)2悬浊液 D、图丁:蒸馏自来水获取蒸馏水9. 张青莲是我国著名的化学家,1991年他准确测得In的相对原子质量为114.818,被国际相对原子质量委员会采用为新的标准值。这是相对原子质量表中首次采用我国测定的相对原子质量值。则下列关于In的说法中,错误的是( )A、In原子核外有49个电子 B、In原子核内有49个中子 C、In原子的质量数为115 D、In是In元素的一种核素10. 用NA表示阿伏加德罗常数的值,下列说法中不正确的是 ( )A、含有 NA个氦原子的氦气在标准状况下的体积约为22.4L B、25℃,1.01×105Pa,64g SO2中含有的原子数为3NA C、0.1mol O3分子中所含的电子数为2.4NA D、在标准状况下,11.2L H2O含有的分子数为0.5NA11. 下列体系中氯离子浓度最大的是( )A、标准状况下22.4L 氯气 B、2mL 0.3mo/L HCl溶液 C、10mL 0.2mol/LCaCl2溶液 D、1mL 0.5mol/L KClO3溶液12. 化学实验中若使某步中的有害产物作为另一步的反应物,形成一个循环,则可不再向环境排放该种有害物质。在如图所示有编号的反应中,属于氧化还原反应的有( ) A、3个 B、4个 C、5个 D、6个13. 下列各物质含少量杂质,除去这些杂质应选用的试剂或操作方法正确的是( )
A、3个 B、4个 C、5个 D、6个13. 下列各物质含少量杂质,除去这些杂质应选用的试剂或操作方法正确的是( )序号
物质
杂质
除杂应选用的试剂或操作方法
①
KNO3溶液
KOH
加入FeCl3溶液,并过滤
②
FeSO4溶液
CuSO4
加入过量铁粉,并过滤
③
O2
H2
通过灼热的氧化铜
④
NaCl固体
CaCO3
溶解,过滤、蒸发
A、②④ B、①②③ C、②③④ D、①②③④14. 纳米级Fe3O4可用于太阳能分解水制H2 , 过程如下图所示,下列说法中不正确的是( )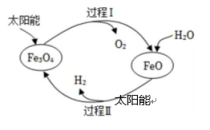 A、过程Ⅰ的反应:2Fe3O4=6FeO + O2↑ B、过程Ⅱ的反应:2H2O=2H2↑+ O2↑ C、两个转化过程都发生了氧化还原反应 D、整个过程实现了太阳能向化学能的转化15. 有A、B、C、D四种元素,质子数均小于18。A元素原子的最外层电子数是其电子层数的3倍;B元素的原子失去1个电子,所得到的微粒具有与氖原子相同的电子层结构;C元素是地壳中含量最多的金属元素;D元素的原子M层电子数是K层的3倍,下列说法不正确的是( )A、A元素可以形成多种同素异形体 B、C的氧化物能与盐酸反应生成盐和水,所以C的氧化物为碱性氧化物 C、可以通过焰色反应检验B元素 D、A和D两种元素形成的化合物能与NaOH溶液反应16. 在相同容积的密闭容器中,1g O2与1gX气体的压强(p)与温度(T)的关系如图所示,则X气体可能是( )
A、过程Ⅰ的反应:2Fe3O4=6FeO + O2↑ B、过程Ⅱ的反应:2H2O=2H2↑+ O2↑ C、两个转化过程都发生了氧化还原反应 D、整个过程实现了太阳能向化学能的转化15. 有A、B、C、D四种元素,质子数均小于18。A元素原子的最外层电子数是其电子层数的3倍;B元素的原子失去1个电子,所得到的微粒具有与氖原子相同的电子层结构;C元素是地壳中含量最多的金属元素;D元素的原子M层电子数是K层的3倍,下列说法不正确的是( )A、A元素可以形成多种同素异形体 B、C的氧化物能与盐酸反应生成盐和水,所以C的氧化物为碱性氧化物 C、可以通过焰色反应检验B元素 D、A和D两种元素形成的化合物能与NaOH溶液反应16. 在相同容积的密闭容器中,1g O2与1gX气体的压强(p)与温度(T)的关系如图所示,则X气体可能是( ) A、CO B、NO C、CH4 D、CO2
A、CO B、NO C、CH4 D、CO2二、非选择题(共4大题,共52分)
-
17. 现代化学在材料、资源、能源、环境、医药、信息技术等领域均有重大应用。(1)、I 新疆也要建造磁悬浮列车了。在磁悬浮列车制造过程中将使用大量含钇(Y)元素的超导材料。钇(Y)元素在元素周期表中的信息如图所示:
钇原子核内有个质子,左图中89.91表示的是; (2)、钇元素形成氧化物的化学式是。(3)、II电解质是维持人体生理活动的基础之一。请回答下列问题:
(2)、钇元素形成氧化物的化学式是。(3)、II电解质是维持人体生理活动的基础之一。请回答下列问题:①CO2 ②Al ③乙醇 ④Fe(OH)3胶体 ⑤熔融BaSO4 ⑥KOH溶液 ⑦固态
上述物质中属于电解质的是。(填序号)
(4)、属于非电解质的是。(填序号)(5)、能导电的纯净物是。(填序号)(6)、写出⑦在水中的电离方程式。(7)、写出①和⑥的反应方程式。(8)、请写出实验室中制备Fe(OH)3胶体的化学反应方程式。18. “84消毒液”能有效杀灭甲型H1N1病毒,某同学购买了一瓶“84消毒液”,该消毒液通常稀释100倍(体积比)使用。查阅相关资料和消毒液包装说明得到如下信息:84消毒液
有效成分NaClO
规格1000mL
质量分数 14.9%
密度1.19g/cm3
(1)、该“84消毒液”的物质的量浓度约为。(2)、取100 mL该“84消毒液”,稀释后的溶液中c(Na+)=mol/L(3)、“84消毒液”与稀硫酸混合使用可增强消毒能力,某消毒人员用18 mol/L的浓硫酸配制100 mL物质的量浓度为0.9 mol/L的稀硫酸用于增强其的消毒能力。①需要用量筒量取mL上述浓硫酸进行配制。
②配制上述稀硫酸,除量筒、胶头滴管、烧杯、玻璃棒外,还缺少的玻璃仪器是。
③在配制过程中,下列实验操作可能导致配制的硫酸溶液浓度偏高的是(填序号)。
a.定容时俯视观察
b.定容后经振荡、摇匀、静置后,发现液面下降,再加适量的蒸馏水
c.浓硫酸在烧杯中加水稀释后,未冷却就向容量瓶中转移
d.往容量瓶转移时,有少液体溅出
e.未洗涤稀释浓硫酸的烧杯
19. 孔雀石主要含Cu2(OH)2CO3 , 还含少量Fe、SiO2。实验室以孔雀石为原料制备CuSO4•5H2O及CaCO3的步骤如图: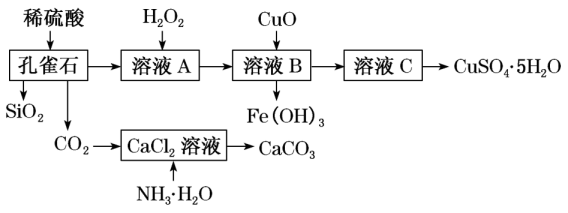 (1)、H2O2中氧元素的化合价为 , 因此H2O2具有强氧化性。(2)、Cu2(OH)2CO3属于(填“酸”“碱”或“盐”)。(3)、制备CaCO3时,发生的反应的化学方程式为。(4)、在一定条件下发生氧化还原反应的是。(填序号)
(1)、H2O2中氧元素的化合价为 , 因此H2O2具有强氧化性。(2)、Cu2(OH)2CO3属于(填“酸”“碱”或“盐”)。(3)、制备CaCO3时,发生的反应的化学方程式为。(4)、在一定条件下发生氧化还原反应的是。(填序号)①孔雀石与稀盐酸
②溶液A与H2O2
③溶液B与CuO
④CO2与NH3•H2O、CaCl2溶液
(5)、C2O3能与水反应生成乙二酸(H2C2O4 , 一种二元酸),则C2O3是氧化物,(填“酸性”、“碱性”或“两性”)C2O3与足量NaOH溶液反应的化学方程式为。20. 物质的量是联系宏观和微观的桥梁,根据物质的量等相关物理量回答下列问题:(1)、0.5molCH4在标准状况下的体积为。(2)、3.1gNa2X含有Na+0.1mol,则X的相对原子质量为。(3)、36gCO与CO2的混合气体与足量O2充分反应后,将所得气体通入过量的澄清石灰水中,生成白色沉淀的质量为100g,则36g CO与CO2的混合气体的总物质的量为 mol。(4)、在0.2L由NaCl、 MgCl2、 CaCl2组成的混合液中,部分离子浓度大小如下图所示。①该混合液中的物质的量为mol。
②将该混合液加水稀释至体积为1L,稀释后溶液中的物质的量浓度为。
③向该稀释后的溶液中加入足量硝酸酸化的硝酸银溶液,可得到沉淀mol。