福建省莆田市五校联盟2023-2024学年高二上学期期中考试化学试题
试卷更新日期:2024-01-17 类型:期中考试
一、单选题(每题3分,共45分)
-
1. 下列反应属于氧化还原反应,且是放热反应是( )A、稀醋酸与烧碱溶液反应 B、灼热的炭与的反应 C、铁片与稀盐酸的反应 D、与的反应2. 下列设备工作时,将化学能转化为电能的是( )
A
B
C
D




煤气灶
铅蓄电池
太阳能热水器
风力发电
A、A B、B C、C D、D3. 中国是稀土大国,铈(Ce)是地壳中含量最高的稀土元素,主要存在与独居石中。金属铈在空气中易被氧化变暗,能与水反应,常见的化合价为+3和+4,氧化性:。下列说法正确的是( )A、、、互为同位素 B、可通过电解溶液制得金属铈 C、铈能从硫酸铜溶液中置换出铜: D、溶于氢碘酸的化学方程式可表示为4. 实验室用石墨电极电解含有酚酞的饱和NaCl溶液,装置如下图所示,下列说法不正确的是( )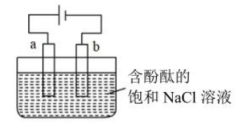 A、a极为电解池的阳极 B、a极发生的电极反应为: C、在电场作用下、向阴极移动 D、b极酚酞变红的原因是:放电,导致正向移动,5. 一种用于驱动潜艇的液氨—液氧燃料电池原理示意如图,下列有关该电池说法正确的是( )
A、a极为电解池的阳极 B、a极发生的电极反应为: C、在电场作用下、向阴极移动 D、b极酚酞变红的原因是:放电,导致正向移动,5. 一种用于驱动潜艇的液氨—液氧燃料电池原理示意如图,下列有关该电池说法正确的是( )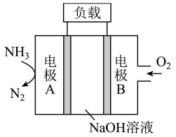 A、电极A为电池的正极 B、电池工作时,向电极B移动 C、电极A上发生的电极反应为: D、该电池工作时,每消耗转移4mol电子6. 设为阿伏加德罗常数的值,下列说法正确的是( )A、100g质量分数为46%的乙醇水溶液中含有氧原子数为 B、若将1mol氯化铁完全转化为氢氧化铁胶体,则分散系中胶体微粒数为 C、向大量水中通入1mol氯气,反应中转移的电子数为 D、电解精炼铜,当电路中通过的电子数目为时,阳极质量减少6.4g7. 已知:的能量变化如图所示,有关叙述正确的是( )
A、电极A为电池的正极 B、电池工作时,向电极B移动 C、电极A上发生的电极反应为: D、该电池工作时,每消耗转移4mol电子6. 设为阿伏加德罗常数的值,下列说法正确的是( )A、100g质量分数为46%的乙醇水溶液中含有氧原子数为 B、若将1mol氯化铁完全转化为氢氧化铁胶体,则分散系中胶体微粒数为 C、向大量水中通入1mol氯气,反应中转移的电子数为 D、电解精炼铜,当电路中通过的电子数目为时,阳极质量减少6.4g7. 已知:的能量变化如图所示,有关叙述正确的是( )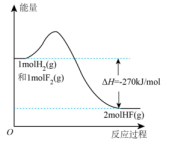 A、1mol HF(g)分解生成和需要吸收270kJ的热量 B、断裂1mol H—H键和1mol F—F键吸收的能量大于形成2mol H—F键放出的能量 C、在相同条件下,与的能量总和小于2mol HF(g)的能量 D、与反应生成2mol HF(l)放出的热量大于270kJ8. 下列关于物质应用的说法错误的是( )A、在医疗上,可用作钡餐 B、食用纯碱可用作食品添加剂 C、可用于制作抗胃酸药品“胃舒平” D、将铁粉、食盐和活性炭等混合可用于制作一次性保暖贴9. 一种可充电锌—空气电池放电时的工作原理如下图所示。已知:Ⅰ室溶液中,锌主要以的形式存在,并存在。下列说法正确的是( )
A、1mol HF(g)分解生成和需要吸收270kJ的热量 B、断裂1mol H—H键和1mol F—F键吸收的能量大于形成2mol H—F键放出的能量 C、在相同条件下,与的能量总和小于2mol HF(g)的能量 D、与反应生成2mol HF(l)放出的热量大于270kJ8. 下列关于物质应用的说法错误的是( )A、在医疗上,可用作钡餐 B、食用纯碱可用作食品添加剂 C、可用于制作抗胃酸药品“胃舒平” D、将铁粉、食盐和活性炭等混合可用于制作一次性保暖贴9. 一种可充电锌—空气电池放电时的工作原理如下图所示。已知:Ⅰ室溶液中,锌主要以的形式存在,并存在。下列说法正确的是( )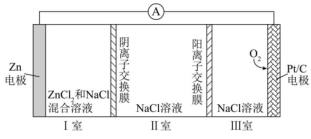 A、放电时,Ⅰ室溶液pH增大 B、放电时,该装置Ⅱ室可实现海水淡化 C、充电时,Zn电极反应为 D、充电时,每生成 , Ⅲ室溶液质量理论上减少32g10. “国之重器”之一——曾侯乙编钟,是战国早期的青铜编钟,主要由铜锡合金冶炼铸造而成,至今保存完好。下列说法不正确的是( )A、铜比锡青铜更易腐蚀 B、在自然环境中,锡青铜中的铜可对锡起保护作用 C、青铜文物在潮湿环境中的腐蚀比在干燥环境中快 D、锡青铜表面生成覆盖物的过程属于电化学腐蚀11. 如图是甲烷燃料电池的工作原理模拟示意图,下列说法不正确的是( )
A、放电时,Ⅰ室溶液pH增大 B、放电时,该装置Ⅱ室可实现海水淡化 C、充电时,Zn电极反应为 D、充电时,每生成 , Ⅲ室溶液质量理论上减少32g10. “国之重器”之一——曾侯乙编钟,是战国早期的青铜编钟,主要由铜锡合金冶炼铸造而成,至今保存完好。下列说法不正确的是( )A、铜比锡青铜更易腐蚀 B、在自然环境中,锡青铜中的铜可对锡起保护作用 C、青铜文物在潮湿环境中的腐蚀比在干燥环境中快 D、锡青铜表面生成覆盖物的过程属于电化学腐蚀11. 如图是甲烷燃料电池的工作原理模拟示意图,下列说法不正确的是( )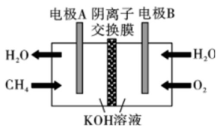 A、电极B为正极 B、在电极A上发生氧化反应 C、电极A区发生反应: D、当有通过外电路时,有通过阴离子交换膜12. 下列说法正确的是( )A、1mol物质完全燃烧生成指定产物时放出的热量,叫该物质的燃烧热 B、酸和碱发生中和反应生成1mol水时的反应热叫中和热 C、反应热就是焓变 D、简易量热计由内筒,外壳,隔热层,杯盖,温度计,玻璃搅拌器构成13. 下列物质应用和对应性质匹配的是( )
A、电极B为正极 B、在电极A上发生氧化反应 C、电极A区发生反应: D、当有通过外电路时,有通过阴离子交换膜12. 下列说法正确的是( )A、1mol物质完全燃烧生成指定产物时放出的热量,叫该物质的燃烧热 B、酸和碱发生中和反应生成1mol水时的反应热叫中和热 C、反应热就是焓变 D、简易量热计由内筒,外壳,隔热层,杯盖,温度计,玻璃搅拌器构成13. 下列物质应用和对应性质匹配的是( )选项
应用
性质
A
大型舰船的底部常镶嵌锌块,防止船底腐蚀
锌比铁活泼性强
B
用焦炭和二氧化硅在电炉中制备粗硅
非金属性:C>Si
C
可用于漂白织物等
具有氧化性
D
聚合硫酸铁用作净水剂
聚合硫酸铁易溶于水
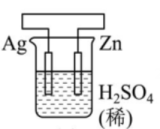
A、A B、B C、C D、D14. 有关甲、乙、丙、丁四个图示的叙述正确的是( )甲
 乙
乙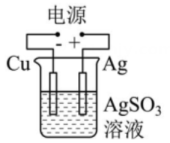 丙
丙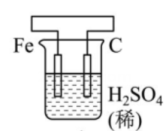 丁
丁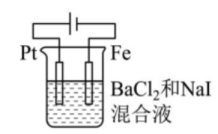 A、甲中Zn电极失去电子发生氧化反应,电子经过溶液后,流向Ag电极 B、乙中阴极反应式为 C、丙中向Fe电极方向移动 D、丁中电解开始时阳极产生黄绿色气体15. 支撑海港码头基础的钢管桩,常用电化学原理进行防腐,工作原理如图所示,其中高硅铸铁为惰性辅助阳极。下列有关表述不正确的是( )
A、甲中Zn电极失去电子发生氧化反应,电子经过溶液后,流向Ag电极 B、乙中阴极反应式为 C、丙中向Fe电极方向移动 D、丁中电解开始时阳极产生黄绿色气体15. 支撑海港码头基础的钢管桩,常用电化学原理进行防腐,工作原理如图所示,其中高硅铸铁为惰性辅助阳极。下列有关表述不正确的是( )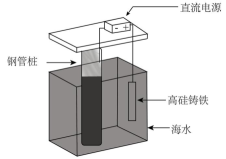 A、通入保护电流使钢管桩表面腐蚀电流接近于零 B、通电后外电路电子被强制从高硅铸铁流向钢管桩 C、此方法在化学上称之为牺牲阳极法 D、通入的保护电流应该根据环境条件变化进行调整
A、通入保护电流使钢管桩表面腐蚀电流接近于零 B、通电后外电路电子被强制从高硅铸铁流向钢管桩 C、此方法在化学上称之为牺牲阳极法 D、通入的保护电流应该根据环境条件变化进行调整二、填空题
-
16. 化学物质在汽车的动力、安全等方面有着极为重要的作用。(1)、汽油是以为主要成分的混合烃类。燃烧的化学方程式是。(2)、汽车尾气中含有NO,CO等污染物。其中NO生成过程的能量变化示意图如图。由该图形数据计算可得,该反应为(填“吸热”或“放热”)反应。

和反应生成NO(g)过程中的能量变化
(3)、通过NO传感器可监测汽车尾气中NO的含量,其工作原理如图所示:
①NiO电极上发生的是反应(填“氧化”或“还原”)
②外电路中,电子流动方向是从电极流向电极(填“NiO”或“Pt”)。
③Pt电极上的电极反应式为。
(4)、电动汽车普遍使用锂离子电池。某锂离子电池反应:。①放电时,Li做电池的极。
②Na也可以做电池的电极,但Li做电极更有优势。试解释原因。
(5)、安全性是汽车发展需要解决的重要问题.汽车受到强烈撞击时,预置在安全气囊内的化学药剂发生反应产生大量气体,气囊迅速弹出。某种产气药剂主要含有、、、 , 已知在猛烈撞击时分解产生两种单质,并放出大量的热。①推测的作用是。
②结合化学方程式解释的作用。
③结合上述例子,在设计气囊中所运用的化学反应时,需要考虑的角度有(填代号,可多选)。
a.反应速率 b.反应的能量变化 c.气体的量 d.气体毒性
17.(1)、Ⅰ.如图为相互串联的甲、乙两个电解池。
甲池若为用电解原理精炼铜的装置,B极材料是电极反应式为。电解一段时间后,电解质溶液的浓度。(填“增大”、“减小”或“不变”)。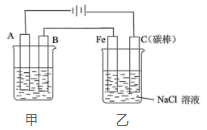 (2)、甲池若为铁制品上镀银的装置,A极材料是。(3)、乙池中发生反应的方程式为。(4)、Ⅱ.某些化学键的键能如表所示:
(2)、甲池若为铁制品上镀银的装置,A极材料是。(3)、乙池中发生反应的方程式为。(4)、Ⅱ.某些化学键的键能如表所示:化学键
H-H
N≡N
键能/(kJ/mol)
a
b
试回答下列问题:已知 ,
则N-H键的键能是kJ/mol(用含有a、b、c的式子表示)。
(5)、Ⅲ.如下图所示装置中都盛有0.1mol/L的NaCl溶液,放置一定时间后,装置中的五块相同锌片,腐蚀速率由快到慢的正确顺序是。
 18. 中和热的测定是高中重要的定量实验。取0.55mol/L的NaOH溶液50mL与0.25mol/L的硫酸50mL置于图所示的装置中进行中和热的测定实验,回答下列问题:
18. 中和热的测定是高中重要的定量实验。取0.55mol/L的NaOH溶液50mL与0.25mol/L的硫酸50mL置于图所示的装置中进行中和热的测定实验,回答下列问题: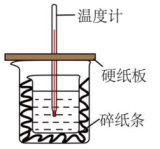 (1)、从如图实验装置看,其中尚缺少的一种玻璃用品是。(2)、烧杯间填满碎纸条的作用是:。(3)、若改用和溶液进行反应与上述实验相比,所放出的热量(填“相等”“不相等”),若实验操作均正确,则所求中和热(填“相等”“不相等”),用相同浓度和体积的氨水()代替NaOH溶液进行上述实验,测得的中和热的数值会(填“偏大”、“偏小”、“无影响”)(4)、写出稀盐酸和稀氢氧化钠溶液反应表示中和热的热化学方程式(中和热数值为57.3kJ/mol):。(5)、-51.8kJ/mol某学生实验记录数据如下:
(1)、从如图实验装置看,其中尚缺少的一种玻璃用品是。(2)、烧杯间填满碎纸条的作用是:。(3)、若改用和溶液进行反应与上述实验相比,所放出的热量(填“相等”“不相等”),若实验操作均正确,则所求中和热(填“相等”“不相等”),用相同浓度和体积的氨水()代替NaOH溶液进行上述实验,测得的中和热的数值会(填“偏大”、“偏小”、“无影响”)(4)、写出稀盐酸和稀氢氧化钠溶液反应表示中和热的热化学方程式(中和热数值为57.3kJ/mol):。(5)、-51.8kJ/mol某学生实验记录数据如下:实验
起始温度
终止温度
序号
硫酸
氢氧化钠溶液
混合溶液
1
20.0
20.1
23.2
2
20.2
20.4
23.4
3
20.5
20.6
23.6
依据该学生的实验数据计算,该实验测得的中和热(结果保留一位小数)。
(6)、上述实验数值结果与57.3kJ/mol有偏差,产生偏差的原因可能是。a.用温度计测定NaOH溶液起始温度后直接测定硫酸的温度
b.量取硫酸的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.实验装置保温、隔热效果差
19.(1)、Ⅰ下图是铜锌原电池装置。其电池的总反应是:。
请回答以下问题:
R的名称是 , R中的阳离子移向(填A或B)中的溶液。 (2)、电极Y的材料是 , B中的电解质溶液是。(3)、X为原电池的极,其电极反应式是。(4)、Ⅱ.已知:
(2)、电极Y的材料是 , B中的电解质溶液是。(3)、X为原电池的极,其电极反应式是。(4)、Ⅱ.已知:物质
C(石墨)
标准燃烧焓