福建省厦门市湖滨名校2023-2024学年高三上学期期中考试化学试卷
试卷更新日期:2024-01-17 类型:期中考试
一、选择题:(本题共15小题,每小题3分,共45分,每小题只有一项符合题目要求)
-
1. “蓝天、碧水、净土”三大环保保卫战正加快生态环境治理和现代化建设。下列说法错误的是( )A、废旧电池必须回收处理,可以防止重金属污染 B、尽量少用或不用含磷洗涤剂,以防止水体富营养化 C、农田使用铵态氮肥要深施覆土,以防止氮肥被氧化 D、在燃油车上安装三元催化转化器,以降低污染气体的排放2. 五育并举,劳动先行。下列生活应用或生产活动,没有运用相应化学知识的是( )
选项
生活应用或生产活动
化学知识
A
用SO2漂白纸张
SO2具有氧化性
B
用铝槽车运输浓硝酸
Al在冷的浓硝酸中发生钝化
C
用铁盐净水
Fe3+水解得到Fe(OH)3胶体
D
用热的纯碱溶液清洗铁屑油污
油脂在碱性条件下可水解
A、A B、B C、C D、D3. 某公司研发出一种比锂电池成本更低、寿命更长、充电速度更快的钠离子电池,该电池的负极材料为(制备原料为、和),电解液为的碳酸丙烯酯溶液。下列化学用语正确的是( )A、的电子排布式为: B、基态碳原子的价层电子轨道表示式为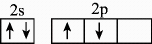 C、中子数为20的氯原子:
D、与同主族,基态原子的简化电子排布式为:
4. 科学家研究出了一种如下图的 “纳米药物分子运输车”,它可装载药物直达病灶,大大提高了肿瘤的治疗效果。下列有关说法错误的是( )
C、中子数为20的氯原子:
D、与同主族,基态原子的简化电子排布式为:
4. 科学家研究出了一种如下图的 “纳米药物分子运输车”,它可装载药物直达病灶,大大提高了肿瘤的治疗效果。下列有关说法错误的是( )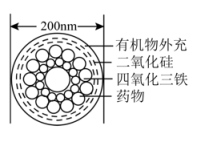 A、四氧化三铁属于无机物 B、二氧化硅属于酸性氧化物 C、该“纳米药物分子车”属于混合物 D、该“纳米药物分子车”分散于水中能形成胶体5. 常温下,在指定溶液中下列各组离子可能大量共存的是( )A、滴加KSCN显红色的溶液: 、Cl-、K+、 B、K2S溶液中: 、K+、Cl-、Cu2+ C、由水电离出的c(OH-)=10-12 mol/L的溶液:Al3+、H+、Cl-、Na+ D、强酸性溶液中: Cl-、Na+、、6. 下列反应的离子方程式正确的是( )A、向硝酸银溶液中加入足量铜:Cu+Ag+=Ag+Cu2+ B、用H2O2从酸化的海带灰浸出液中提取碘:2I-+H2O2+2H+=I2+2H2O C、等体积、等物质的量浓度的NaHCO3溶液与Ba(OH)2溶液混合:2HCO+Ba2++2OH-=BaCO3↓+2H2O+CO D、向硫酸铜溶液中加入过量氨水:Cu2++2NH3·H2O =Cu(OH)2↓+2NH7. 下列说法正确的是( )A、标准状况下,22.4 L Br2所含溴原子的数目为2 NA B、等质量的NO2和N2O4所含原子总数不同 C、136 g熔融的KHSO4中含有2 NA个阳离子 D、标准状况下,22.4 L CO2与足量Na2O2反应转移的电子数为NA8. 下列说法正确的是( )A、将足量NH3、CO2依次通入饱和食盐水中,无白色沉淀生成 B、将KSCN溶液滴入盐酸和Fe(NO3)2的混合溶液中,溶液显红色 C、将饱和FeCl3溶液滴入NaOH溶液中,可制得Fe(OH)3胶体 D、将盐酸酸化
A、四氧化三铁属于无机物 B、二氧化硅属于酸性氧化物 C、该“纳米药物分子车”属于混合物 D、该“纳米药物分子车”分散于水中能形成胶体5. 常温下,在指定溶液中下列各组离子可能大量共存的是( )A、滴加KSCN显红色的溶液: 、Cl-、K+、 B、K2S溶液中: 、K+、Cl-、Cu2+ C、由水电离出的c(OH-)=10-12 mol/L的溶液:Al3+、H+、Cl-、Na+ D、强酸性溶液中: Cl-、Na+、、6. 下列反应的离子方程式正确的是( )A、向硝酸银溶液中加入足量铜:Cu+Ag+=Ag+Cu2+ B、用H2O2从酸化的海带灰浸出液中提取碘:2I-+H2O2+2H+=I2+2H2O C、等体积、等物质的量浓度的NaHCO3溶液与Ba(OH)2溶液混合:2HCO+Ba2++2OH-=BaCO3↓+2H2O+CO D、向硫酸铜溶液中加入过量氨水:Cu2++2NH3·H2O =Cu(OH)2↓+2NH7. 下列说法正确的是( )A、标准状况下,22.4 L Br2所含溴原子的数目为2 NA B、等质量的NO2和N2O4所含原子总数不同 C、136 g熔融的KHSO4中含有2 NA个阳离子 D、标准状况下,22.4 L CO2与足量Na2O2反应转移的电子数为NA8. 下列说法正确的是( )A、将足量NH3、CO2依次通入饱和食盐水中,无白色沉淀生成 B、将KSCN溶液滴入盐酸和Fe(NO3)2的混合溶液中,溶液显红色 C、将饱和FeCl3溶液滴入NaOH溶液中,可制得Fe(OH)3胶体 D、将盐酸酸化 BaCl2溶液滴入某溶液中产生白色沉淀,证明该溶液中一定含有SO
9. 下列物质的应用中,与氧化还原反应无关的是( )A、用含Fe2O3的铁矿石冶炼Fe B、用Na2O2作潜水艇的供氧剂 C、用NaOH作沉淀剂去除粗盐水中的Mg2+ D、以NH3为原料制备HNO310. 部分含氮、硫元素的化合物的“价—类”二维图如图所示。下列关于各物质的说法错误的是( )
BaCl2溶液滴入某溶液中产生白色沉淀,证明该溶液中一定含有SO
9. 下列物质的应用中,与氧化还原反应无关的是( )A、用含Fe2O3的铁矿石冶炼Fe B、用Na2O2作潜水艇的供氧剂 C、用NaOH作沉淀剂去除粗盐水中的Mg2+ D、以NH3为原料制备HNO310. 部分含氮、硫元素的化合物的“价—类”二维图如图所示。下列关于各物质的说法错误的是( ) A、i在一定条件下均可以与a、b、c发生反应 B、e的浓溶液可用于干燥c、f、g C、g与在汽车催化转化器中会转化成两种无毒气体 D、h排放到空气中可形成酸雨11. 某种锂盐的结构如图所示,其阴离子由W、X、Y、Z四种同周期主族元素构成,X原子的最外层电子数是W原子的次外层电子数的3倍,化合物中除Li+外其它原子均满足8电子稳定结构。下列说法正确的是( )
A、i在一定条件下均可以与a、b、c发生反应 B、e的浓溶液可用于干燥c、f、g C、g与在汽车催化转化器中会转化成两种无毒气体 D、h排放到空气中可形成酸雨11. 某种锂盐的结构如图所示,其阴离子由W、X、Y、Z四种同周期主族元素构成,X原子的最外层电子数是W原子的次外层电子数的3倍,化合物中除Li+外其它原子均满足8电子稳定结构。下列说法正确的是( )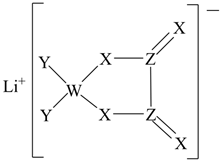 A、W位于第2周期IVA族 B、原子半径:Z>X>Y C、元素电负性:Y>Z>X D、最高化合价:Y>Z>W12. 下列图示的实验,能够实现相应实验目的的是( )
A、W位于第2周期IVA族 B、原子半径:Z>X>Y C、元素电负性:Y>Z>X D、最高化合价:Y>Z>W12. 下列图示的实验,能够实现相应实验目的的是( )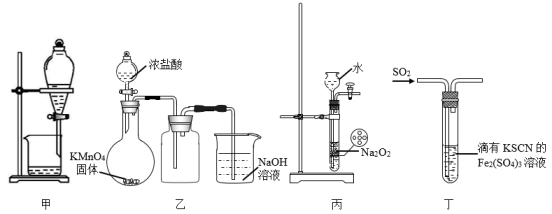 A、利用甲装置用CCl4从碘水中萃取碘 B、利用乙装置制取并收集少量纯净的氯气 C、利用丙装置控制制取氧气的速率 D、利用丁装置验证SO2的漂白性13. 工业上制备下列物质的生产流程合理的是( )A、由铝土矿冶炼铝:铝土矿Al2O3AlCl3Al B、由NaCl制漂白粉:饱和食盐水Cl2漂白粉 C、由石英砂制纯硅:石英砂粗硅SiHCl3纯硅 D、工业合成硝酸:N2NONO2HNO314. 实验室模拟工业处理含铬废水,操作及现象如图1所示,反应过程中铬元素的化合价变化如图2,已知:深蓝色溶液中生成了CrO5。下列说法不正确的是( )
A、利用甲装置用CCl4从碘水中萃取碘 B、利用乙装置制取并收集少量纯净的氯气 C、利用丙装置控制制取氧气的速率 D、利用丁装置验证SO2的漂白性13. 工业上制备下列物质的生产流程合理的是( )A、由铝土矿冶炼铝:铝土矿Al2O3AlCl3Al B、由NaCl制漂白粉:饱和食盐水Cl2漂白粉 C、由石英砂制纯硅:石英砂粗硅SiHCl3纯硅 D、工业合成硝酸:N2NONO2HNO314. 实验室模拟工业处理含铬废水,操作及现象如图1所示,反应过程中铬元素的化合价变化如图2,已知:深蓝色溶液中生成了CrO5。下列说法不正确的是( )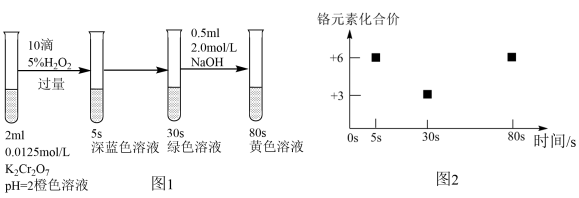 A、0-5 s过程中,发生的氧化还原反应为: B、实验开始至30 s溶液中发生的总反应离子方程式为: C、30-80 s过程中,Cr元素被氧化,可能是溶液中剩余的H2O2所致 D、80 s时,在碱性条件下,溶液中含铬微粒主要为15. 氮氧化物会对生态系统和人体健康造成危害。一种以沸石笼作为载体对氮氧化物进行催化还原的原理如图所示。下列叙述不正确的是( )
A、0-5 s过程中,发生的氧化还原反应为: B、实验开始至30 s溶液中发生的总反应离子方程式为: C、30-80 s过程中,Cr元素被氧化,可能是溶液中剩余的H2O2所致 D、80 s时,在碱性条件下,溶液中含铬微粒主要为15. 氮氧化物会对生态系统和人体健康造成危害。一种以沸石笼作为载体对氮氧化物进行催化还原的原理如图所示。下列叙述不正确的是( )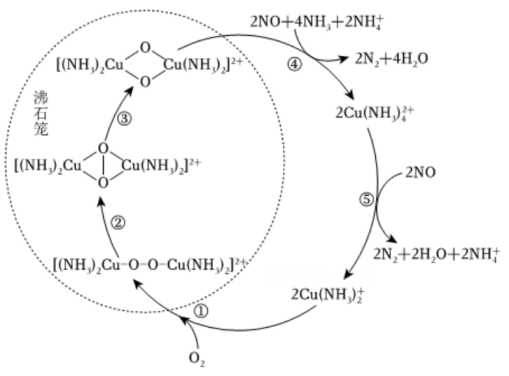 A、反应⑤变化过程可表示为: B、图中总过程中每吸收需要标准状况下的氧气为 C、反应③未涉及元素化合价的变化 D、反应④涉及非极性共价键的断裂与生成
A、反应⑤变化过程可表示为: B、图中总过程中每吸收需要标准状况下的氧气为 C、反应③未涉及元素化合价的变化 D、反应④涉及非极性共价键的断裂与生成二、非选择题
-
16. X、W、Y、Z、M、Q、R、L是元素周期表前四周期元素,且原子序数依次增大,其相关信息如表:
元素
相关信息
X
原子核外有6种不同运动状态的电子
Y
基态原子中s电子总数与p电子总数相等
Z
原子半径在同周期元素中最大
M
逐级电离能(kJ•mol-1)依次为578、1817、2745、11575、14830、18376
Q
基态原子的最外层p轨道上有两个电子的自旋方向与其他电子的自旋方向相反
R
基态原子核外有7个能级且能量最高的能级上有6个电子
L
基态原子核外有四个电子层,最外层只有一个电子,其它电子层均排满电子
请用化学用语填空:
(1)、X元素在元素周期表的位置:。(2)、请写出Q元素基态原子核外电子排布式:。(3)、X、Y、Z、M四种元素的原子半径由小到大的顺序是(用元素符号表示)。(4)、R元素可形成R2+和R3+ , 其中较稳定的是R3+ , 原因是。(5)、与M元素成“对角线规则”关系的某短周期元素T的最高价氧化物的水化物具有两性,写出该两性物质与Z元素的最高价氧化物的水化物反应的化学方程式:;M、Z晶体都是由金属原子密置层在三维空间堆积而成(最密堆积),M的熔点(930K)比Z的熔点(371K)高,原因是;已知T元素和Q元素的电负性分别为1.5和3.0,则它们形成的化合物是(填“离子化合物”或“共价化合物”)。(6)、硒(Se)是人体必需的微量元素,与Y为同一主族元素,Se原子比Y原子多两个电子层,则Se的原子序数为 , 其最高价氧化物对应的水化物化学式为。(7)、X射线衍射法可以测定某些分子结构,NH3分子结构为;其电子式为 , 中心原子的杂化类型(8)、L的基态原子价电子轨道表示式为;在周期表中该原子排在区(9)、水在液态时,几个水分子可以形成缔合水分子(H2O)n的原因是水分子之间存在 。(10)、三氟乙酸乙酯是制备某种抗新冠病毒药物的原料,合成该分子所需的原料三氟乙酸的酸性乙酸的酸性(填“大于”或“小于”),请理论解释原因17. 有资料显示过量的氨气和氯气在常温下可合成岩脑砂(主要成分为NH4Cl),某实验小组对该反应进行探究,并对岩脑砂进行元素测定,回答下列问题:(1)、岩脑砂的制备:
①利用装置A制取实验所需的氨气,写出反应的化学方程式:。
②该实验中用浓盐酸与MnO2反应制取所需氯气,装置B中盛放浓盐酸的仪器名称是 , 写出该反应的离子方程式:。则装置E中用于除气体杂质的试剂是(填写试剂名称)
③为了使氨气和氯气在D中充分混合,请确定上述装置的合理连接顺序
a→d→c→→ ←j←i←h←g←b
④证明氨气和氯气反应有岩脑砂生成,需要的检验试剂中,除了蒸馏水、稀HNO3、NaOH溶液外,还需要 、 等两种;岩脑砂的主要成分中所含化学键的类型、、
(2)、氨气和氯气反应制取岩脑砂时同时生成N2。氨气和氯气反应生成N2的化学方程式是。
(3)、和氮元素同主族的砷存在多种同素异形体——黄砷、黑砷、灰砷①黄砷结构与白磷相似,黄砷的空间构型为 , 第三周期,第一电离能介于Al和P之间的元素有种。
②近年来,黑砷在催化电解水方面的研究受到关注,其晶体结构与石墨类似。根据图中信息,下列说法正确的有(填标号)。

a.黑砷中As—As键的键能均相同
b.黑砷与C60都属于混合型晶体
c.黑砷单层中As原子与As—As键的个数比为2:3
d.黑砷层与层之间的作用力为范德华力
18. 我国是稀土储量大国,氧化铈(CeO2)是一种应用广泛的稀土氧化物。一种用氟碳铈矿(CeFCO3 , 含BaO、SiO2等杂质)为原料制备CeO2的工艺如下图。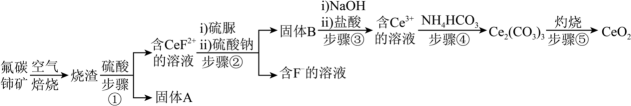
已知:①Ce3+可形成难溶于水的复盐[(Ce2(SO4)3·Na2SO4·nH2O],其氢氧化物也难溶于水。
②硫脲的结构简式为CS(NH2)2 , 在酸条件下易被氧化为(CSN2H3)2。
请回答:
 (1)、实验室常用下图所示仪器进行固体物质的粉碎,该仪器的名称是。步骤①和步骤②均有操作(填操作名称)(2)、焙烧后加入稀硫酸浸出,Ce元素的浸出率和稀硫酸浓度、温度的关系如图所示,下列说法正确的是
(1)、实验室常用下图所示仪器进行固体物质的粉碎,该仪器的名称是。步骤①和步骤②均有操作(填操作名称)(2)、焙烧后加入稀硫酸浸出,Ce元素的浸出率和稀硫酸浓度、温度的关系如图所示,下列说法正确的是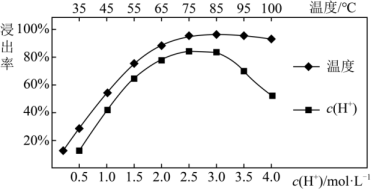
A.固体A的成分是SiO2
B.步骤②加入硫脲的目的将还原为
C.根据上图,焙烧后加入稀硫酸浸出时,适宜的条件为85℃,c(H2SO4)=2.5mol/L(3)、步骤④发生的离子方程式为。(4)、取ag所制CeO2 , 溶解后配制成250mL溶液。取bmL该溶液用0.01mol·L-1(NH4)2Fe(SO4)2溶液滴定,滴定时发生反应:Fe2++Ce4+=Fe3++Ce3+ , 达到滴定终点时消耗(NH4)2Fe(SO4)2溶液VmL。滴定过程中,接近终点时需采用半滴操作,具体操作是:慢慢旋转滴定管旋塞,使滴定管口悬挂液滴而不滴落,用靠落液滴,并用将液滴冲入溶液中,振荡锥形瓶使溶液充分混合。
(5)、该产品中CeO2的质量分数为 (列出表达式)(6)、与铈同为过度金属的Fe元素在自然界中形成黄铁矿(主要成分FeS2),FeS2晶体的晶胞结构如图4所示。在晶胞中,Fe2+位于所形成的(填“正四面体”或“正八面体”)空隙;若晶胞参数为anm,密度为ρg•cm−3 , 阿伏加德罗常数的值为NA , 则FeS2的摩尔质量M=g⋅mol-1(用含a、ρ、NA的代数式表示)。