2023-2024学年人教版初中化学九年级下册 9.2 溶解度 同步分层训练培优题
试卷更新日期:2024-01-13 类型:同步测试
一、选择题
-
1. 下列说法正确的是( )A、某种溶液可以是稀溶液,但同时不可能是饱和溶液 B、不改变溶液的量,饱和溶液不可能变成不饱和溶液 C、浓溶液中溶解的溶质多,这时的溶液肯定是饱和溶液 D、室温下固体溶质共存的溶液是该物质的饱和溶液2. 下列说法错误的是( )A、鱼缸中通空气可以增加水中溶氧量 B、鱼池中向空中喷水可以增加水中溶氧量 C、自制白糖晶体时加糖越多结晶越多 D、晃动有助于开盖的香槟更有力的喷出3. 室温下,将盛有接近饱和的硝酸钾溶液的小烧杯放在盛水的大烧杯中(如图所示),欲使硝酸钾溶液变为饱和溶液,可向大烧杯中加入的固体物质是( )
 A、硝酸钾 B、氯化钠 C、硝酸铵 D、氢氧化钠4. 下列关于溶解度的说法中正确的是( )。A、20℃时,100g水中溶解36g氯化钠恰好形成饱和溶液,则20℃时氯化钠的溶解度为36g B、60℃时,110g硝酸钾完全溶于水中形成饱和溶液,则60℃时硝酸钾的溶解度为110g C、20℃时,蔗糖的溶解度是20 D、36gNaCl溶于100g水中恰好形成饱和溶液,则NaCl的溶解度为36g5. 50℃时氯化铵的溶解度是50g,则50℃时氯化铵的饱和溶液中溶质、溶剂、溶液之间的质量比为( )。A、1:2:3 B、2:3:1 C、3:2: 1 D、1:3:26. 20℃时,向50 g氯化钾溶液中加入5g氯化钾晶体,充分搅拌后,尚有部分晶体未溶解,稍加热后,晶体全部溶解,下列说法正确的是( )。A、搅拌后,加热前一定是饱和溶液 B、搅拌后,加热前一定是不饱和溶液 C、稍加热后一定是不饱和溶液 D、稍加热后一定是饱和溶液7. 甲、乙两物质的溶解度曲线a、b如图所示,下列叙述中正确的是( )。
A、硝酸钾 B、氯化钠 C、硝酸铵 D、氢氧化钠4. 下列关于溶解度的说法中正确的是( )。A、20℃时,100g水中溶解36g氯化钠恰好形成饱和溶液,则20℃时氯化钠的溶解度为36g B、60℃时,110g硝酸钾完全溶于水中形成饱和溶液,则60℃时硝酸钾的溶解度为110g C、20℃时,蔗糖的溶解度是20 D、36gNaCl溶于100g水中恰好形成饱和溶液,则NaCl的溶解度为36g5. 50℃时氯化铵的溶解度是50g,则50℃时氯化铵的饱和溶液中溶质、溶剂、溶液之间的质量比为( )。A、1:2:3 B、2:3:1 C、3:2: 1 D、1:3:26. 20℃时,向50 g氯化钾溶液中加入5g氯化钾晶体,充分搅拌后,尚有部分晶体未溶解,稍加热后,晶体全部溶解,下列说法正确的是( )。A、搅拌后,加热前一定是饱和溶液 B、搅拌后,加热前一定是不饱和溶液 C、稍加热后一定是不饱和溶液 D、稍加热后一定是饱和溶液7. 甲、乙两物质的溶解度曲线a、b如图所示,下列叙述中正确的是( )。 A、t1℃时,甲和乙的溶解度均为30 B、t2℃时,甲和乙的饱和溶液中溶质的质量分数相等 C、t2℃时,在100 g水中加入60g甲,其溶质的质量分数为37.5% D、t2℃时,分别在100 g水中各溶解20g甲、乙,同时降低温度,甲先达到饱和8. 如图是甲、乙、丙三种固体物质的溶解度曲线,下列说法错误的是
A、t1℃时,甲和乙的溶解度均为30 B、t2℃时,甲和乙的饱和溶液中溶质的质量分数相等 C、t2℃时,在100 g水中加入60g甲,其溶质的质量分数为37.5% D、t2℃时,分别在100 g水中各溶解20g甲、乙,同时降低温度,甲先达到饱和8. 如图是甲、乙、丙三种固体物质的溶解度曲线,下列说法错误的是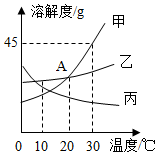 A、A点表示20℃时甲、乙溶解度相等 B、将30℃时甲、乙、丙三种物质的饱和溶液分别降温到10℃,它们的溶质质量分数都发生改变 C、甲中混有少量丙,可用冷却热饱和溶液的的方法提纯甲 D、30℃时,30g甲物质中加入50g水,充分溶解后得到72.5g溶液9. 下列表示实验过程物质质量变化的图象,其中正确的是()A、向两份等量、等浓度的稀盐酸中分别加入足量Fe、Mg
A、A点表示20℃时甲、乙溶解度相等 B、将30℃时甲、乙、丙三种物质的饱和溶液分别降温到10℃,它们的溶质质量分数都发生改变 C、甲中混有少量丙,可用冷却热饱和溶液的的方法提纯甲 D、30℃时,30g甲物质中加入50g水,充分溶解后得到72.5g溶液9. 下列表示实验过程物质质量变化的图象,其中正确的是()A、向两份等量、等浓度的稀盐酸中分别加入足量Fe、Mg B、向一定量硫酸铜溶液中不断加入铁粉
B、向一定量硫酸铜溶液中不断加入铁粉  C、向饱和的石灰水中加入少量氧化钙后,恢复到室温
C、向饱和的石灰水中加入少量氧化钙后,恢复到室温  D、向一定量氯化钠和碳酸钠的混合物中滴加足量稀盐酸
D、向一定量氯化钠和碳酸钠的混合物中滴加足量稀盐酸  10.
10.图甲为蔗糖的溶解度曲线。现将剩有蔗糖固体的饱和溶液降温,则烧杯底部的蔗糖固体质量将
 A、变大 B、不变 C、变小 D、先变小后变大
A、变大 B、不变 C、变小 D、先变小后变大二、填空题
-
11. 实验探究:影响硝酸钾固体溶解速率的因素.根据下表所探究的内容和方法,将空格填写完整
内容
探究方法
现象
结论
颗粒大小对溶解速率的影响
取大、中、小三块相同质量的KNO3固体分别放入相同质量的水中
小块KNO3固体首先溶解完
12. KNO3和KCl的溶解度曲线如下图所示: (1)、t3℃时,KCl的溶解度为。(2)、A点的含义是。(3)、将t3℃时KCl的饱和溶液210.0g稀释成质量分数为20.0%的KCl溶液,需加水g(精确到0.1g)。查阅相关物质的密度后,在实验室完成该实验通常需要的玻璃仪器有胶头滴管、玻璃棒、(填字母)。
(1)、t3℃时,KCl的溶解度为。(2)、A点的含义是。(3)、将t3℃时KCl的饱和溶液210.0g稀释成质量分数为20.0%的KCl溶液,需加水g(精确到0.1g)。查阅相关物质的密度后,在实验室完成该实验通常需要的玻璃仪器有胶头滴管、玻璃棒、(填字母)。A.托盘天平 B.烧杯 C.药匙 D.量筒 E.漏斗
(4)、含有少量氯化钾的硝酸钾样品,要除去氯化钾固体,具体操作是____(填字母)。A、溶解、蒸发结晶、过滤、冷水洗涤、干燥 B、溶解、加热浓缩、降温结晶、过滤、冷水洗涤、干燥 C、溶解、升高温度、过滤、热水洗涤、干燥三、综合题
-
13. 下图为KNO3和NaCl两种固体的溶解度曲线,请回答下列问题:
 (1)、t2℃时,KNO3的溶解度为克;(2)、t2℃时,d点处的KNO3溶液是(填“饱和”或“不饱和”)溶液;(3)、分别将KNO3和NaCl两种饱和溶液由t2℃降温到t1℃,得到的溶液的溶质质量分数关系为KNO3NaCl(填“等于”、“大于”或“小于”);(4)、关于d点处对应的KNO3溶液,下列说法正确的有____。A、其溶质质量分数为37.5% B、其变成b点对应的KNO3溶液时溶质质量分数不变 C、其变成c点对应的KNO3溶液,只能通过加入硝酸钾实现 D、其通过某一操作变成KNO3饱和溶液后,其溶质质量分数可能变大、变小或不变
(1)、t2℃时,KNO3的溶解度为克;(2)、t2℃时,d点处的KNO3溶液是(填“饱和”或“不饱和”)溶液;(3)、分别将KNO3和NaCl两种饱和溶液由t2℃降温到t1℃,得到的溶液的溶质质量分数关系为KNO3NaCl(填“等于”、“大于”或“小于”);(4)、关于d点处对应的KNO3溶液,下列说法正确的有____。A、其溶质质量分数为37.5% B、其变成b点对应的KNO3溶液时溶质质量分数不变 C、其变成c点对应的KNO3溶液,只能通过加入硝酸钾实现 D、其通过某一操作变成KNO3饱和溶液后,其溶质质量分数可能变大、变小或不变四、实验探究题
-
14. 某种镁矿石的主要成分是碳酸镁,还含有较多的脉石(SiO2)和少量石灰石。下图是利用该镁矿石制备七水硫酸镁(MgSO4·7H2O)的工艺流程:

已知CaSO4和MgSO4的溶解度曲线如下图所示:

根据以上信息回答下列问题:
(1)、写出步骤①中碳酸镁与硫酸发生反应的化学方程式。(2)、上述流程中多次用到了过滤操作,实验室过滤时需要用到的玻璃仪器是玻璃棒、烧杯和。(3)、沉淀A的成分是SiO2和部分硫酸钙,过滤I后得到的滤液中的溶质除了MgSO4还有。(4)、步骤④趁热过滤的作用是。(5)、步骤⑥的操作a名称是。五、计算题
-
15. 某纯碱样品中混有少量的氯化钠,为了测定样品的纯度,小明做了如下实验:准确称取样品12.0g,向其中加入57.9g稀盐酸,恰好完全反应,共产生气体4.4g,请回答下列问题:(1)、小明要从反应后的溶液中提取NaCl应采用的方法是;(2)、纯碱样品中的Na2CO3的质量分数是多少?(结果保留一位小数,要求写出计算过程)(3)、反应后所得溶液中NaCl的质量分数是多少?(要求写出计算过程)
-
-