2023-2024学年人教版初中化学九年级下册 实验活动4 金属的物理性质和某些化学性质 同步分层训练培优题
试卷更新日期:2024-01-12 类型:同步测试
一、选择题
-
1. 2021年3月20日,在成都举行的“考古”中国重大项目工作进展会上通报,三星堆遗址新发现6座三星堆文化“祭祀坑”,出土了青铜面具、青铜神树、瓷器等重要文物,其中青铜是人类最早使用的铜、锡合金。下列有关这些文物的说法中,错误的是( )A、青铜耐腐蚀 B、青铜属于混合物 C、青铜的硬度大于铜或锡 D、青铜和氧化铜都属于金属材料2. 根据下列实验方案进行实验,能达到相应实验目的的是( )
编号
A
B
C
D
实验
方案

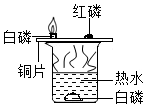


实验
目的
验证质量守恒定律
探究燃烧条件之一需要可燃物
探究铁钉生锈时O2是否参与反应
比较Zn和Fe的金属活动性强弱
A、A B、B C、C D、D3. 将X、Y、Z三块大小相同的金属片分别投入到10%的稀硫酸中,X表面无明显现象,Y表面缓慢产生气泡,Z表面迅速产生大量气泡。则X、Y、Z的金属活动性顺序为A、X>Z>Y B、Z>X>Y C、X>Y>Z D、Z>Y>X4. 下列物质不能由金属与酸直接反应制得的是( )。A、FeCl3 B、FeSO4 C、AlCI3 D、ZnSO45. 下列金属中,不能与稀硫酸反应放出氢气的是( )。A、镁 B、铂 C、铁 D、铝6. 关于金属及金属材料,下列说法错误的是( )A、可以用互相刻画的方法比较合金及组成合金的金属的硬度 B、生铁和钢的含碳量不同,故二者性能不同 C、铜在金属活动性顺序中排在H后,故氧化铜不能与稀盐酸反应 D、可以利用Zn、FeSO4溶液、Cu间的相互反应,比较Zn、Fe、Cu的活动性7. 将一定量的锌粉加入硫酸亚铁、硫酸铜和硫酸镁的混合溶液中,过一段时间后过滤,向滤渣中加入稀盐酸有气泡产生,则下列对滤渣滤液的描述正确的是( )①滤渣中一定含有锌
②滤渣中一定含有铜和铁,可能含有锌
③向滤渣中加入一定量稀盐酸, 最后溶液一定变成浅绿色
④滤液中溶质一定含有硫酸锌和硫酸镁
⑤滤液的颜色不可能为浅绿色
A、①③⑤ B、②③④⑤ C、②③④ D、②④8. 下列图象能正确反映对应变化关系的是( )



A.向一定质量的二氧化 锰中加入过氧化氢溶液
B.向等 质量的镁 粉和 铝粉中分别加入等浓度 的稀盐酸
C.镁在氧气中燃烧
D.向一定量铁粉和铜粉混 合物中加入硫酸铜溶液
A、A B、B C、C D、D9. 某不纯的铁5.6克与足量的稀硫酸反应生成0.28克氢气,则铁中混有的物质可能是( )A、锌 B、碳 C、铝 D、银10. 向一定质量AgNO3和Cu(NO3)2的混合溶液中加入Zn粉,溶液质量与加入Zn粉的质量关系如图所示。下列说法错误的是() A、a点溶液溶质为AgNO3、Cu(NO3)2和Zn(NO3)2 B、b点溶液为蓝色 C、取c点的固体滴加稀盐酸,无气泡产生 D、d点溶液中溶质为Zn(NO3)2
A、a点溶液溶质为AgNO3、Cu(NO3)2和Zn(NO3)2 B、b点溶液为蓝色 C、取c点的固体滴加稀盐酸,无气泡产生 D、d点溶液中溶质为Zn(NO3)2二、填空题
-
11. 古代冶金技术彰显了我国劳动人民的智慧。(1)、战国《韩非子·内储说上》提到,早期采金技术均是“沙里淘金”。金在自然界中主要以(填“单质”或“化合物”)形式存在,金具有(填“难溶”或“易溶”)于水的性质。(2)、《淮南万毕术》记载有“曾青(指硫酸铜溶液)得铁化为铜”,该反应的化学方程式是 , 反应的基本类型是(3)、《格致粗谈》记载“赤铜入炉甘石炼为黄铜,其色如金”。把赤铜(Cu2O)和炉甘石、木炭粉混合高温制得黄铜。
I、Cu2O中铜元素的化合价是 , 1mol Cu2O中约含有个Cu原子。
II、反应的化学方程式:X+Cu2O+CZn+2Cu+2CO2↑。则炉甘石主要成分X的化学式是 , 根据产物可知黄铜中含有的金属是
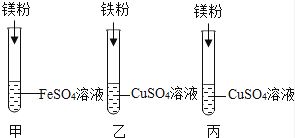
12.化学小组探究镁、铁、铜三种金属的活动性顺序,设计了下图所示实验方案.
(1)试管乙中观察到的现象是 , 反应的化学方程式为 .
(2)同学们经讨论后认为该方案可以优化,试管的实验是多余的.
(3)去掉多余的实验,同学们将另两只试管中反应后的物质倒入同一大烧杯中,一段时间后过滤,
向滤渣中加入稀硫酸,有气泡产生,则滤渣的成分可能是 .
三、综合题
-
13. 某种手机电路板中含金属:Fe、Cu、Au、Ag,如图所示是某工厂利用废旧手机回收部分金属的工艺流程。
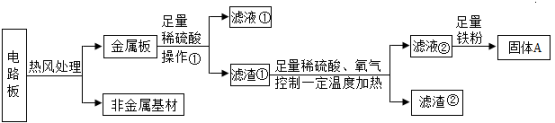
【查阅资料】在一定条件下能发生反应: , 而Au、Ag不能反应。
(1)、操作①的名称是。(2)、滤渣②中含有(填化学式)。(3)、写出滤液②和铁粉发生反应的化学方程式:(一个即可),该反应基本类型为反应。四、实验探究题
-
14. 某兴趣小组想通过实验对铁、铜、锌三种金属的活动性强弱进行探究,现提供的药品有:铁粉、铜丝、锌粒、20%稀硫酸、CuSO4溶液、ZnSO4溶液、FeSO4溶液。(1)、甲同学设计用铁粉、铜丝、锌粒分别与等质量20%稀硫酸进行实验,立刻有同学提出反对,理由。(2)、乙同学设计如下方案进行实验:
实验步骤

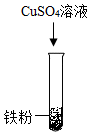
实验现象
无明显变化
。
实验结论
。
(3)、发生反应的化学方程式为。(4)、丙同学将两支试管中的物质倒在一个洁净的烧杯中,发现烧杯内的红色固体明显增多。充分反应后过滤,同学们分别对滤渣和滤液的成分展开了探究。【作出猜想】猜想一:滤渣中一定有铜,猜想二:。
(5)、【进行实验】实验步骤
实验现象
实验结论
向滤渣中加入20%稀硫酸
有气泡产生
猜想二正确
【交流讨论】
滤液中一定含有的溶质是(填化学式)。
(6)、丁同学掌握了比较金属活动性的正确方法后,他选择了另组试剂 , 进一步验证了三种金属的活动性强弱。五、计算题
-
15. 将铁粉和铜粉混合物10.0 g投入盛100.0 g稀盐酸(足量)的烧杯中,充分反应后,称得剩余物质的总质量为109.8 g,求:(1)、生成氢气的质量是多少克;(2)、该混合物中铜粉的质量分数。
-
-