2023-2024学年人教版初中化学九年级下册 8.3 金属资源的利用和保护 同步分层训练培优题
试卷更新日期:2024-01-12 类型:同步测试
一、选择题
-
1. 下列关于金属材料的说法中正确的是( )A、在常温下,铝制品具有很好的抗腐蚀性能 B、铁锅清洗后,表面的水可隔绝空气减缓锈蚀 C、电线一般用铜制不用银制,是因为银的导电性较弱 D、含铅、汞的废旧电池要埋在土壤中,减少对环境的污染2. 用图1所示装置对暖宝宝(主要成分有铁粉、水、活性炭、食盐等)的发热过程进行探究,传感器获得图2和图3所示的实验数据。下列说法错误的是( )
 A、暖宝宝的发热是一种放热反应 B、由图2可知,足量暖宝宝原料发热过程能消耗掉瓶中全部氧气 C、图3表明,瓶内氧气减少造成的气压变小量与温度升高造成的气压增大量相等 D、装置冷却至室温,图3中的曲线会逐渐降低至03. 下列叙述正确的是( )A、英国化学家拉瓦锡用定量的方法研究了空气的成分,弄清了燃烧的本质 B、工业炼铁的原理是在高温的条件下,利用一氧化碳将铁矿石中的铁置换出来 C、含有同种元素且由一种物质组成,则该物质一定是单质 D、将煤砸成小块可以使煤充分的燃烧,减少一氧化碳和二氧化硫的产生4. 根据以下铁钉生锈实验的设计,得出的结论错误的是( )
A、暖宝宝的发热是一种放热反应 B、由图2可知,足量暖宝宝原料发热过程能消耗掉瓶中全部氧气 C、图3表明,瓶内氧气减少造成的气压变小量与温度升高造成的气压增大量相等 D、装置冷却至室温,图3中的曲线会逐渐降低至03. 下列叙述正确的是( )A、英国化学家拉瓦锡用定量的方法研究了空气的成分,弄清了燃烧的本质 B、工业炼铁的原理是在高温的条件下,利用一氧化碳将铁矿石中的铁置换出来 C、含有同种元素且由一种物质组成,则该物质一定是单质 D、将煤砸成小块可以使煤充分的燃烧,减少一氧化碳和二氧化硫的产生4. 根据以下铁钉生锈实验的设计,得出的结论错误的是( ) A、对比甲、乙,说明铁生锈一定要有氧气参加 B、对比甲、丙,说明铁生锈一定要有水参加 C、对比乙、丙,说明铁生锈一定要有氧气参加 D、对比丙、丁,说明铁在水面附近生锈的速度最快5. 镁带能在 气体中燃烧: ,该反应中的还原剂是( )A、 B、 C、 D、C6. 某同学将沾有清水的细铁丝放入图示装置中,一段时间后,可观察到的现象是( )
A、对比甲、乙,说明铁生锈一定要有氧气参加 B、对比甲、丙,说明铁生锈一定要有水参加 C、对比乙、丙,说明铁生锈一定要有氧气参加 D、对比丙、丁,说明铁在水面附近生锈的速度最快5. 镁带能在 气体中燃烧: ,该反应中的还原剂是( )A、 B、 C、 D、C6. 某同学将沾有清水的细铁丝放入图示装置中,一段时间后,可观察到的现象是( ) A、铁丝不变,b液面升高 B、铁丝不变,b液面不变 C、铁丝生锈,b液面升高 D、铁丝生锈,b液面不变7. 如右图实验,放置 周时间后,装置中能出现的现象是( )
A、铁丝不变,b液面升高 B、铁丝不变,b液面不变 C、铁丝生锈,b液面升高 D、铁丝生锈,b液面不变7. 如右图实验,放置 周时间后,装置中能出现的现象是( ) A、 铁丝不变化 B、试管中的液面不变化 C、铁丝逐渐消失 D、试管中的液面上升8.
A、 铁丝不变化 B、试管中的液面不变化 C、铁丝逐渐消失 D、试管中的液面上升8.下图是探究铁制品锈蚀的条件时做的五个实验(铁钉在不同环境中),实验一段时间后,得出的结论错误的是
 A、甲、乙中铁钉生锈快慢的顺序为:乙>甲 B、丙中的铁钉最不易生锈 C、铁生锈的主要条件是与空气、水直接接触 D、丁中铁钉生锈最严重9.
A、甲、乙中铁钉生锈快慢的顺序为:乙>甲 B、丙中的铁钉最不易生锈 C、铁生锈的主要条件是与空气、水直接接触 D、丁中铁钉生锈最严重9.右图是探究铁锈蚀条件的装置。调节L端与R端的液面高度一致,塞紧木塞,一周后观察。下列推断错误的是
 A、b管中铁钉不会锈蚀 B、L端与R端液面高度仍然保持一致 C、该实验说明铁锈蚀与空气、水有关 D、若将a管中的水改为食盐水能加快铁的锈蚀10. 30克不纯的铁与足量的稀盐酸反应,产生了1克氢气,则该铁样品中含的杂质可能是( )A、Cu B、Mg C、Al D、Na
A、b管中铁钉不会锈蚀 B、L端与R端液面高度仍然保持一致 C、该实验说明铁锈蚀与空气、水有关 D、若将a管中的水改为食盐水能加快铁的锈蚀10. 30克不纯的铁与足量的稀盐酸反应,产生了1克氢气,则该铁样品中含的杂质可能是( )A、Cu B、Mg C、Al D、Na二、填空题
-
11. 2019年政府工作报告明确今年继续执行新能源汽车购置优惠政策,同时培育新能源汽车产业集群,推动新能源汽车产业发展,是一项非常迫切的任务。太阳能燃料电池是一种零排放、无污染的新能源。

①如图所示,汽车外壳大多使用钢或者铝合金,汽车轮胎使用的是合成橡胶,其中属于金属材料的是
A 钢 B 铝合金 C 合成橡胶
②在铜的催化作用下由F2和足量的NH3反应可得到三氟化氮(NF3)和NH4F,三氟化氮在太阳能电池制造中有广泛应用。请写出此反应的化学方程式。
12. 如图所示它演示在什么条件下容易生锈,实验中看到的现象是 , 原因是 . 根据该实验验证铁生锈条件可以推知铁锈中一定含有的元素是 .
三、综合题
-
13. 金属材料在生产生活中的应用广泛,请回答下列问题:(1)、“三星堆遗址”出土了黄金面罩、象牙、青铜艺术品、残存的丝织品等重要文物,其中属于金属材料的有(选填序号)。
a.黄金面罩 b.象牙 c.青铜面具 d.丝织品
(2)、《吕氏春秋·别类篇》载有“金(铜)柔锡柔,合两柔则刚”,表明青铜的硬度比纯铜(选填“大”或“小”)。(3)、2022年6月17日,我国第三艘航母下水。航母的飞行甲板,既能承受舰载机起降时产生的强烈冲击和摩擦,也能承受舰载机的尾焰炙烤,还能承受潮湿盐雾的海洋大气环境侵蚀。由此可推知,制造飞行甲板的材料具有的性质是____。A、耐高温 B、良好的导电 C、耐腐蚀 D、硬度大(4)、探究铁锈蚀的实验中,试管(填字母)中的铁钉最易生锈。通过对比试管A、C中的现象,可以得出铁生锈需要与接触。为防止铁制品生锈,通常采取的具体措施。(写一条)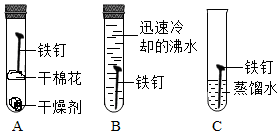
四、实验探究题
-
14. 黄铜是铜锌合金,铜质量分数为67%-70%。某兴趣小组对纯铜和黄铜进行以下探究。
【查阅资料】①铜与空气中的气体作用可以生成Cu2(OH)2CO3(绿色固体)。
②黄铜中Zn含量越高硬度越大。
(1)、【实验Ⅰ】区别纯铜和黄铜方法一:划画法
将黄铜片和纯铜片互相划观察到纯铜表面有刻痕,说明硬度更大;
(2)、方法二:取样,分别加入稀硫酸。有一个反应有气泡产生。写出该反应的化学方程式:。(3)、【实验Ⅱ】比较黄铜与纯铜抗锈蚀能力该兴趣小组设计了如下图所示的两个实验方案。

组内同学经过讨论,认为方案一不合理。写出改进方法:。
(4)、同学们按方案二进行实验,发现B试管固体表面绿色更明显。由此可知(填“黄铜”或“纯铜”)抗锈蚀性较强。(5)、写出Cu2(OH)2CO3生成的反应方程式:。(6)、【实验Ⅲ】测定黄铜中铜的质量分数方法一:利用如下图所示的实验测定黄铜中铜的质量分数。

将④的锥形瓶中所得的固体经一系列处理后进行称量,得质量为1.35g。计算黄铜中铜的质量分数为。
(7)、方法二:利用如下图所示实验测定黄铜中铜的质量分数。
根据电子秤显示,可得黄铜样品粉末与稀硫酸反应生成氢气g。
(8)、计算方法二测得的黄铜中铜的质量为g。五、计算题
-
15. 将6.8 g含杂质的锌粒加入到80 g过量的稀硫酸中(杂质不溶于水,也不与稀硫酸反应),充分反应后过滤,称得滤液质量为86.3g。试计算:
(1)反应生成氢气的质量;
(2)锌粒中所含锌的质量分数(精确到0.1%)。
-
-