广东省普宁市重点实验学校2023-2024学年高二上学期第三次月考化学试题
试卷更新日期:2024-01-12 类型:月考试卷
一、单项选择题(1-10题每小题2分,11-16题每小题4分,共44分)
-
1. 下列有关能量的说法不正确的是( )A、化学能可转变为电能 B、化学反应伴随能量变化是化学反应基本特征之一 C、化学反应能量转换遵守能量守恒定律 D、化学变化时断裂化学键需放出能量2. 化学与生产、生活紧密相关,下列说法不正确的是( )A、镀铜铁器的镀层破损后,铁的腐蚀速度不会加快 B、燃烧煤炭时将煤炭碾碎并吹入炉膛的目的是为了让煤炭充分燃烧 C、泡沫灭火器的使用是利用了盐类水解的原理 D、用浓的碳酸钠溶液除去锅炉水垢中的硫酸钙利用了沉淀转化原理3. 反应C(s)+H2O(g)=CO(g)+H2(g)在一个容积可变的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是( )
①增加C(s)的量 ②将容器的体积缩小一半
③保持体积不变,充入N2使体系压强增大 ④保持压强不变,充入N2使容器体积变大
A、①③ B、②③ C、①④ D、②④4. 下列关于水的说法正确的是( )A、水的离子积仅适用于纯水 B、水的电离需要通电 C、升高温度一定使水的离子积增大 D、加入电解质一定会破坏水的电离平衡5. 下列现象能用勒夏特列原理解释的是( )①Fe(SCN)3溶液中加入固体KSCN后颜色变深
②棕红色NO2加压后颜色先变深后变浅
③SO2与O2生成SO3的反应,往往需要用催化剂
④H2、I2、HI平衡混和气加压后颜色变深
A、①和② B、①和④ C、②和③ D、①②④6. 下列有关热化学方程式的叙述不正确的是( )A、在稀溶液中:H+(aq)+OH-(aq)=H2O(1) △H=-57.3 kJ/mol,若将含0.6 mol H2SO4的稀硫酸与含1 mol NaOH的稀溶液混合,放出的热量等于57.3 kJ B、已知正丁烷(g)→异丁烷(g) △H<0,则异丁烷比正丁烷稳定 C、2H2(g)+O2(g)=2H2O(l) △H=-571.6 kJ·mol-1 , 则H2的燃烧热为285.8 kJ·mol-1 D、已知2C(s)+2O2(g)=2CO2(g) △H1;2C(s)+O2(g)=2CO(g) △H2 , 则△H1>△H27. 对饱和AgCl溶液(有AgCl固体存在)进行下列操作后,c(Ag+)保持不变的是( )A、加少量水稀释 B、加热 C、加入少量浓盐酸 D、加入少量固体AgNO38. 关于常温下pH为2的盐酸,下列叙述正确的是( )A、将10mL该溶液稀释至100mL后, B、向该溶液中加入等体积pH为12的氨水恰好完全中和 C、该溶液中盐酸电离出的c(H+)与水电离出的c(H+)之比为1010:1 D、该溶液中由水电离出的 (H+)9. 室温下,下列离子组在给定条件下能大量共存的是( )A、的溶液中: , 、、 B、pH=1的溶液中:、、、 C、的溶液中: , , 、 D、由水电离的的溶液中: , , 、10. 可逆反应aA(g)+bB(g) cC(g)+dD(g)△H同时符合下列两图中各曲线的是( ) A、a+b>c+d T1>T2 △H>0 B、a+b>c+d T1<T2 △H<0 C、a+b<c+d T1>T2 △H>0 D、a+b<c+d T1<T2 △H<011. 在如图装置中,观察到图1装置铜电极上产生大量无色气泡,而图2装置中铜电极上无气泡产生,铬电极上产生大量有色气泡。下列叙述不正确的是( )
A、a+b>c+d T1>T2 △H>0 B、a+b>c+d T1<T2 △H<0 C、a+b<c+d T1>T2 △H>0 D、a+b<c+d T1<T2 △H<011. 在如图装置中,观察到图1装置铜电极上产生大量无色气泡,而图2装置中铜电极上无气泡产生,铬电极上产生大量有色气泡。下列叙述不正确的是( )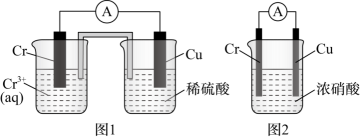 A、图1装置中 Cu 电极上电极反应式是 B、图2装置中 Cu 电极上发生的电极反应为 C、图2装置中 Cr电极上电极反应式为 D、两个装置中,电子均由 Cr电极经导线流向 Cu 电极12. 煤的间接液化可先转化为一氧化碳和氢气,后在催化剂作用下合成甲醇,其中一氧化碳与氢气的反应历程如下图所示,吸附在催化剂表面上的物种用*标注。下列说法正确的是( )
A、图1装置中 Cu 电极上电极反应式是 B、图2装置中 Cu 电极上发生的电极反应为 C、图2装置中 Cr电极上电极反应式为 D、两个装置中,电子均由 Cr电极经导线流向 Cu 电极12. 煤的间接液化可先转化为一氧化碳和氢气,后在催化剂作用下合成甲醇,其中一氧化碳与氢气的反应历程如下图所示,吸附在催化剂表面上的物种用*标注。下列说法正确的是( ) A、煤中含有苯和甲苯,可以通过分馏的方式将它们分离出来 B、该反应历程中决速步骤的活化能为1.6eV C、石油裂解和煤的干馏都是化学变化,而石油的分馏和煤的气化都是物理变化 D、虚线框内发生的化学反应方程式可能为H3CO*+H2=CH3OH*13. 根据下列实验操作,现象和结论都正确的是( )
A、煤中含有苯和甲苯,可以通过分馏的方式将它们分离出来 B、该反应历程中决速步骤的活化能为1.6eV C、石油裂解和煤的干馏都是化学变化,而石油的分馏和煤的气化都是物理变化 D、虚线框内发生的化学反应方程式可能为H3CO*+H2=CH3OH*13. 根据下列实验操作,现象和结论都正确的是( )实验操作
现象
结论
A
用pH试纸测定饱和新制氯水的pH
pH试纸变红色
饱和新制氯水呈酸性
B
向AgNO3溶液中依次滴加NaCl、KI溶液
依次出现白色、黄色沉淀
C
用pH试纸测定NaCl与NaF溶液的pH
前者小于后者
非金属性:F<Cl
D
等体积、pH=3的两种酸HA和HB,分别与足量Zn反应
HA放出的氢气多
酸性:HA<HB
A、A B、B C、C D、D14. 下列说法错误的有几句( )①NaHCO3溶液加水稀释,的比值保持增大
②浓度均为0.1mol·L-1的Na2CO3、NaHCO3混合溶液:2c(Na+)=3[c(CO)+c(HCO)]
③在0.1mol·L-1氨水中滴加0.1mol·L-1盐酸,恰好完全中和时溶液的pH=a,则由水电离产生的c(OH-)=10-amol·L-1
④向0.1mol/LNa2SO3溶液中加入少量NaOH固体,c(Na+)、c(SO)均增大
⑤在Na2S稀溶液中,c(H+)=c(OH-)+c(H2S)+c(HS-)
A、4 B、3 C、2 D、115. 下,三种硫酸盐、、的沉淀溶解平衡曲线如下图所示。已知。下列说法正确的是( )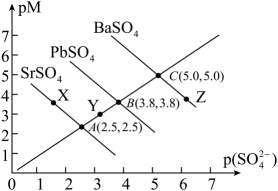 A、溶度积: B、点对是不饱和溶液,能继续溶解 C、点对应的溶液中 , 二者的浓度积等于 D、不可能转化成16. 常温下,向0.1mol·L1H3PO4溶液中加入NaOH的过程中各微粒的物质的量分数(δ)随pH的变化关系如图所示(H3PO4的三级电离常数依次为Ka1、Ka2、Ka3)。下列叙述错误的是( )
A、溶度积: B、点对是不饱和溶液,能继续溶解 C、点对应的溶液中 , 二者的浓度积等于 D、不可能转化成16. 常温下,向0.1mol·L1H3PO4溶液中加入NaOH的过程中各微粒的物质的量分数(δ)随pH的变化关系如图所示(H3PO4的三级电离常数依次为Ka1、Ka2、Ka3)。下列叙述错误的是( ) A、Ka2=10-7.2 , HPO42-的水解平衡常数为10-6.8 B、为获得尽可能纯的NaH2PO4 , pH应控制在4~5 C、反应H2PO4-+H2O
A、Ka2=10-7.2 , HPO42-的水解平衡常数为10-6.8 B、为获得尽可能纯的NaH2PO4 , pH应控制在4~5 C、反应H2PO4-+H2O H3PO4+OH- 的K=10-11.9
D、Na2HPO4溶液中存在c(OH-)+c(PO43-)=c(H+)+c(H2PO4-)+c(H3PO4)
H3PO4+OH- 的K=10-11.9
D、Na2HPO4溶液中存在c(OH-)+c(PO43-)=c(H+)+c(H2PO4-)+c(H3PO4)
二、 非选择题(本题共4小题,共56分)
-
17. 绿水青山是习总书记构建美丽中国的伟大设想,研究碳、氮、硫等废气的处理对建设美丽中国具有重要意义。(1)、用CO2可以生产燃料甲醇。
已知: △H= - a kJ/mol
△H= - b kJ/mol
则表示燃烧的热化学方程式为。
(2)、某温度下,将6 mol CO2和8 molH2充入一容积为2 L的密闭容器中发生 △H<0反应,测得H2的物质的量随时间变化如图实线所示。
请回答下列问题:
①前分钟内,H2的平均反应速率为(保留两位小数)。
②下列表述能表示该反应已达平衡的是(填序号)。
a.容器内压强不再改变 b.容器内气体的密度不再改变
c.容器内气体的平均摩尔质量不再改变 d.容器内各物质的物质的量相等
③在温度时,该反应的化学平衡常数为。
④仅改变某一条件再进行实验,测得H2的物质的量随时间变化如图中虚线所示。与实线相比,改变条件的方式可能是。
(3)、二氧化硫一空气质子交换膜燃料电池将化学能转变成电能的同时,实现了制硫酸、发电、环保三位一体的结合,降低了成本提高了效益,其原理如图所示。
在该燃料电池中,负极的电极方程式为。
18. 25℃时,有关物质的电离平衡常数如下,回答下列问题:化学式
CH3COOH
H2CO3
HClO
电离平衡常数
(1)、常温下,醋酸钠的溶液呈性,原因是(写离子方程式)(2)、物质的量浓度为的下列四种溶液,pH由大到小的顺序是(填编号)。
A.Na2CO3
B.NaClO
C.CH3COONa
D.NaHCO3(3)、体积均为10mL、pH均为2的醋酸溶液与HX溶液分别加水稀释至1000mL,稀释过程中pH变化如图所示。则HX的电离平衡常数(填“大于”、“等于”或“小于”)醋酸的电离平衡常数,HX是酸(填“强”或“弱”)。 (4)、25℃时,若测得CH3COOH与CH3COONa的混合溶液pH=6,则溶液中c(CH3COO-) - c(Na+)=(填计算式,不用求具体值)(5)、在室温下,0.175 mol·L-1醋酸钠溶液的pH约为(6)、标准状况下,将1.12L CO 2通入100mL 0.75mol·L -1的NaOH溶液中,则溶液中离子的浓度由大到小的顺序19. 已知某烧碱样品中含有NaCl杂质,为测定该样品中NaOH的质量分数,进行如下实验:
(4)、25℃时,若测得CH3COOH与CH3COONa的混合溶液pH=6,则溶液中c(CH3COO-) - c(Na+)=(填计算式,不用求具体值)(5)、在室温下,0.175 mol·L-1醋酸钠溶液的pH约为(6)、标准状况下,将1.12L CO 2通入100mL 0.75mol·L -1的NaOH溶液中,则溶液中离子的浓度由大到小的顺序19. 已知某烧碱样品中含有NaCl杂质,为测定该样品中NaOH的质量分数,进行如下实验:①称量1.00g样品溶于水配成250mL溶液:
②用碱式滴定管准确量取25.00mL所配溶液于锥形瓶中,滴加2—3滴指示剂:
③用的标准盐酸滴定并重复三次,每次实验数据记录如下:
滴定序号
待测液体积/mL
消耗盐酸的体积/mL
滴定前
滴定后
1
2
3
25.00
25.00
25.00
0.50
6.00
1.10
20.60
26.00
21.00
请回答下列问题:
(1)、实验步骤②中所滴加的指示剂是。(2)、排除碱式滴定管胶管中气泡的方法是(填字母)。 (3)、在该实验的滴定过程中用左手控制。(填仪器及部位),眼睛 , 直至滴定终点。(4)、判断达到滴定终点时的现象为。(5)、若出现下列情况,导致测定结果偏高的是(填序号)。
(3)、在该实验的滴定过程中用左手控制。(填仪器及部位),眼睛 , 直至滴定终点。(4)、判断达到滴定终点时的现象为。(5)、若出现下列情况,导致测定结果偏高的是(填序号)。a.滴定前用蒸水冲洗锥形瓶
b.滴定过程中振荡锥形瓶时不慎使瓶内溶液溅出
c.滴定过程中不慎将数滴酸液滴在链形瓶外
d.酸式滴定管中在滴定前有气泡,滴定后气泡消失
e.滴定前仰视读数,滴定后俯视读数
f.酸式滴定管在使用前没有用标准液润洗
(6)、通过计算可知该烧碱样品的纯度为。20. 辉铜矿主要成分Cu2S,此外还含有少量SiO2、Fe2O3等杂质,软锰矿主要含有MnO2 , 以及少量SiO2、Fe2O3等杂质。研究人员开发综合利用这两种资源,用同槽酸浸湿法冶炼工艺,制备硫酸锰和碱式碳酸铜。主要工艺流程如下:已知:①MnO2有较强的氧化性,能将Cu+氧化成Cu2+②[Cu(NH3)4]SO4常温稳定,在热水溶液中会分解生成NH3
③部分金属阳离子生成氢氧化物沉淀的pH范围(开始沉淀和完全沉淀的pH):Fe3+:1.5~3.2 Mn2+:8.3~9.8 Cu2+:4.4~6.4。
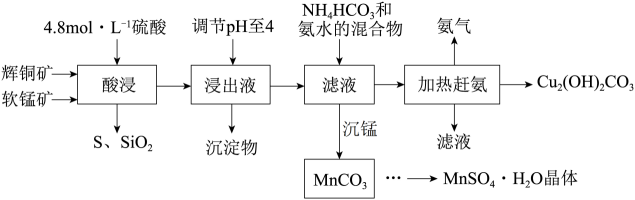 (1)、实验室配制250mL4.8mol/L的稀硫酸,所需的玻璃仪器除玻璃棒、量筒、烧杯以外还需要。(2)、酸浸时,为了提高浸取率可采取的措施有(任写一点)。(3)、酸浸时,得到浸出液中主要含有CuSO4、MnSO4等。写出该反应的化学方程式。(4)、调节浸出液pH=4的作用是。(5)、本工艺中可循环使用的物质是(写化学式)。(6)、获得的MnSO4·H2O晶体后常用酒精洗涤,优点是。(7)、用标准的BaCl2溶液测定样品中MnSO4·H2O质量分数时,发现样品纯度大于100%(测定过程中产生的误差可忽略)其可能原因有(任写一种)。
(1)、实验室配制250mL4.8mol/L的稀硫酸,所需的玻璃仪器除玻璃棒、量筒、烧杯以外还需要。(2)、酸浸时,为了提高浸取率可采取的措施有(任写一点)。(3)、酸浸时,得到浸出液中主要含有CuSO4、MnSO4等。写出该反应的化学方程式。(4)、调节浸出液pH=4的作用是。(5)、本工艺中可循环使用的物质是(写化学式)。(6)、获得的MnSO4·H2O晶体后常用酒精洗涤,优点是。(7)、用标准的BaCl2溶液测定样品中MnSO4·H2O质量分数时,发现样品纯度大于100%(测定过程中产生的误差可忽略)其可能原因有(任写一种)。