2023-2024学年人教版初中化学九年级下册 8.2 金属的化学性质 同步分层训练培优题
试卷更新日期:2024-01-11 类型:同步测试
一、选择题
-
1. 铁制菜刀在生产时要通过“淬火”处理来增加刀的硬度,其原理为;3Fe+4H2OFe3O4+4H2 , 该反应属于基本反应类型中的( )A、分解反应 B、化合反应 C、复分解反应 D、置换反应2. 下列成语所描述的过程,从化学的角度理解正确的是( )A、釜底抽薪:木柴燃烧必须达到着火点 B、真金不怕火炼:金的化学性质比较稳定 C、滴水穿石:主要发生了化学变化 D、百炼成钢:只发生了物理变化3. 2021年7月20日,中国自主知识产权,世界首套时速600公里高速磁悬浮列车成功下线,“科技强国”、“交通强国”战略具有重大而深远的意义。磁悬浮列车核心部件使用了“钕(Nd)铁(Fe)硼(B)”三元稀土永磁合金材料。下列说法错误的是( )A、“钕铁硼”具有磁性 B、“钕铁硼”具有导电性 C、“钕铁硼”具有延展性 D、“钕铁硼”是由三种元素组成的化合物4. 把等质量的X、Y、Z、M四种金属分别加入到足量相同质量分数的稀盐酸中,再把X加入到Z(NO3)2溶液中,M加入到Y(NO3)2溶液中,反应关系如图甲、乙、丙、据此判断四种金属的活动性顺序为( )
 A、X>Z>M>Y B、Y>M>Z>X C、X>Z>Y>M D、Z>X>M>Y5. 现有X、Y、Z三种金属,如果把X、Y分别放入稀硫酸中,X溶解并产生氢气,Y不反应;如果把Y、Z分别放入到硝酸银溶液中,Y表面有银析出,而Z没有变化。判断这三种金属的活动性由强到弱的顺序是( )A、Z>X>Y B、X>Y>Z C、X>Z>Y D、Y>X>Z6. 小明为探究金属与盐的反应,将一定质量的某种金属M的粉末放入AgNO3与Cu(NO3)2的混合溶液中,充分反应后发现,溶液呈现无色,溶液底部有少量固体粉末;过滤后在滤渣和滤液中分别加入适量稀盐酸,滤渣中有无色气体产生,滤液中无沉淀产生。结合实际现象判断,小明得出的以下结论正确的是( )A、滤液中一定没有银离子, 可能含有铜离子 B、滤渣中一定含有金属银和铜 C、滤渣中一定不含有金属M D、加入的金属M 可能是单质铁7. 某兴趣小组在研究Mg-Al合金、Fe-Al合金、Zn-Fe合金、Fe-Cu合金时,发现其中一种合金3g与足量的稀盐酸充分反应后产生了0.2g气体,该合金可能是( )A、Mg-Al合金 B、Fe-Al合金 C、Zn-Fe合金 D、Fe-Cu合金8. 向AgNO3溶液中加入一定量的Mg粉和Fe粉,充分反应后过滤,得到滤渣和浅绿色的滤液.关于该滤渣和滤液有下列四种说法:
A、X>Z>M>Y B、Y>M>Z>X C、X>Z>Y>M D、Z>X>M>Y5. 现有X、Y、Z三种金属,如果把X、Y分别放入稀硫酸中,X溶解并产生氢气,Y不反应;如果把Y、Z分别放入到硝酸银溶液中,Y表面有银析出,而Z没有变化。判断这三种金属的活动性由强到弱的顺序是( )A、Z>X>Y B、X>Y>Z C、X>Z>Y D、Y>X>Z6. 小明为探究金属与盐的反应,将一定质量的某种金属M的粉末放入AgNO3与Cu(NO3)2的混合溶液中,充分反应后发现,溶液呈现无色,溶液底部有少量固体粉末;过滤后在滤渣和滤液中分别加入适量稀盐酸,滤渣中有无色气体产生,滤液中无沉淀产生。结合实际现象判断,小明得出的以下结论正确的是( )A、滤液中一定没有银离子, 可能含有铜离子 B、滤渣中一定含有金属银和铜 C、滤渣中一定不含有金属M D、加入的金属M 可能是单质铁7. 某兴趣小组在研究Mg-Al合金、Fe-Al合金、Zn-Fe合金、Fe-Cu合金时,发现其中一种合金3g与足量的稀盐酸充分反应后产生了0.2g气体,该合金可能是( )A、Mg-Al合金 B、Fe-Al合金 C、Zn-Fe合金 D、Fe-Cu合金8. 向AgNO3溶液中加入一定量的Mg粉和Fe粉,充分反应后过滤,得到滤渣和浅绿色的滤液.关于该滤渣和滤液有下列四种说法:①向滤渣中加入稀盐酸,一定有气泡产生; ②向滤液中加入稀盐酸一定有沉淀产生;
③滤渣中一定有Ag; ④滤液中一定有Fe(NO3)2、一定不含AgNO3、可能有Mg(NO3)2 .
以上说法中正确的个数为( )
A、1个 B、2 个 C、3个 D、4个9. 某实验小组在相同条件下探究金属与酸反应的放热情况,实验装置如图1,实验所用药品如表。
实验编组
等质量稀硫酸
金属粉末质量
①
含H2SO4 9.8g
6.5g铁
②
含H2SO4 9.8g
6.5g锌
③
含H2SO4 9.8g
6.5镁
溶液温度随反应时间变化如图2。下列分析正确的是( )
A、实验①对应图2中曲线a B、反应结束后,实验①和②有金属粉末剩余 C、实验③能产生0.2g氢气 D、反应结束后,烧杯中的溶液都呈无色10. 在5.6g 铁粉中,先逐滴加入一定量的硝酸铜溶液,充分反应后再逐滴加入硝酸银溶液,固体质量与所加溶液总质量的关系如图所示。下列有关说法正确的是( )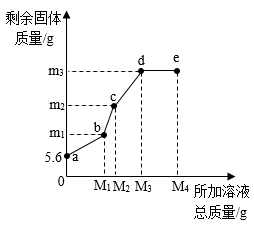 A、b点时,生成铜的质量等于m1g B、be段反应的化学方程式为Cu+2AgNO3=2Ag+Cu(NO3)2 C、e点时,溶液中含有的溶质有2种 D、m3的数值为21.6
A、b点时,生成铜的质量等于m1g B、be段反应的化学方程式为Cu+2AgNO3=2Ag+Cu(NO3)2 C、e点时,溶液中含有的溶质有2种 D、m3的数值为21.6二、填空题
-
11. 向AgNO3和Fe(NO3)2的混合溶液中加入一定量Zn粉,充分反应后过滤,得到滤渣和滤液,滤渣中一定含有(填化学式),滤液中一定含有(化学式),除了上述一定发生的反应外,溶液中还有一个可能发生反应的化学方程式为。12. 金属在生产、生活和社会发展中有着广泛的应用。(1)、铝制品耐腐蚀的原因是。(2)、铁与空气中的O2和H2O发生反应锈蚀,请列举一种家庭中菜刀防锈的方法。(3)、某废液含有Fe(NO3)2、Cu(NO3)2、AgNO3 , 小组同学设计如下方案回收Ag:滤液A的溶质是 , 步骤Ⅲ中发生反应的化学方程式是。

三、综合题
-
13. 我国自主设计的大型客机成功试飞,国产航母正式下水,标志着我国的合金制造技术取得重大突破。根据所学知识回答问题。(1)、生铁和钢都是铁的合金,其中含碳量较高的是。(2)、建造航母和飞机均用到了钛合金,构成金属钛的粒子是(填“原子”“分子”或“离子”),工业制钛中的一步反应为TiF4+2H2SO44HF+2X+TiO2 , X的化学式为。(3)、为了探究航母材料中锌、铁、铜三种金属活动性强弱,某同学设计了下列实验(每步均充分反应),其中能达到目的的是____(填字母)。A、稀盐酸中加入足量铁粉后,再加铜粉,最后加入锌粉 B、ZnCl2溶液中加入足量铁粉后,再加入CuCl2溶液 C、ZnCl2溶液中加入足量铜粉后,再加入铁粉
四、实验探究题
-
14. 订书钉是生活中常用的文具,主要成分是铁,其表面镀有镁、锌、铜中的一种,为探究是哪种金属,进行以下实验:
【实验步骤】
①取一块订书钉(40根钉),如图甲所示,浸入酒精中,一段时间后从表面取下一层胶水薄膜;
②用棉花擦去酒精,待干燥后称量质量为m1;
③将其放入图乙所示装置,并在干燥管口用氢气传感器测量氢气的质量,同时记录电子天平显示的质量变化(如图丙所示);
④5.8min时停止反应取出装置剩余订书钉,洗涤、干燥、称量、剩余订书钉质量为m2.
根据实验操作,分析实验数据,请回答:
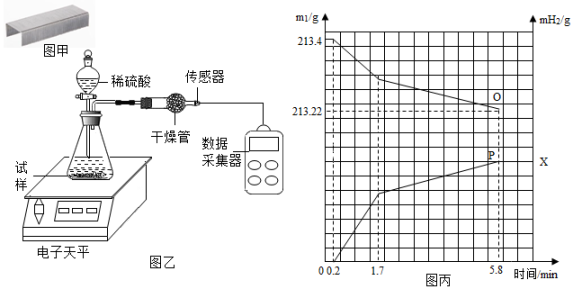 (1)、从订书钉的外观看,可以首先排除的金属是。(2)、图丙中,表示电子天平读数的曲线是点所在的曲线(填“O”或“P”),P点纵坐标X的值为。(3)、0~0.2min不产生氢气的原因主要是。(4)、你觉得1.7min后化学反应速率减慢的最主要原因是。(5)、金属铝也是生活中常用的金属材料,化学兴趣小组的同学把用砂纸打磨过的铝片迅速放入气密性良好的塑料瓶中,利用氧气浓度传感器测得瓶内氧气含量的变化情况如图所示。
(1)、从订书钉的外观看,可以首先排除的金属是。(2)、图丙中,表示电子天平读数的曲线是点所在的曲线(填“O”或“P”),P点纵坐标X的值为。(3)、0~0.2min不产生氢气的原因主要是。(4)、你觉得1.7min后化学反应速率减慢的最主要原因是。(5)、金属铝也是生活中常用的金属材料,化学兴趣小组的同学把用砂纸打磨过的铝片迅速放入气密性良好的塑料瓶中,利用氧气浓度传感器测得瓶内氧气含量的变化情况如图所示。
实验过程中瓶内氧气含量先减少后基本不变的原因。
五、计算题
-
15. 烧杯中现有质量为11.2g的铁,先逐滴向烧杯中加入一定量的Cu(NO3)2溶液,充分反应后再逐滴加入AgNO3溶液,剩余固体质量与所加溶液总质量的关系如图所示。
 (1)、写出铁与硝酸铜溶液反应的化学方程式:。(2)、图中C点的溶液中所含溶质是。(3)、计算m2的质量。(写出计算过程)
(1)、写出铁与硝酸铜溶液反应的化学方程式:。(2)、图中C点的溶液中所含溶质是。(3)、计算m2的质量。(写出计算过程)
-
-