浙江省杭州市精诚联盟2023-2024学年高二上学期10月月考化学试题
试卷更新日期:2024-01-11 类型:月考试卷
一、选择题(本大题共 25 小题,每小题 2 分共 50 分。每小题只有一个正确答案)
-
1. 下列关于反应热的叙述正确的是( )A、需要加热的反应一定是吸热反应 B、放热反应不需要加热 C、化学反应中旧键断裂需要吸收能量,新键生成会释放能量 D、若 , 则 SO2(g)的能量大于 SO3的能量2. 下列化学反应中,反应物总能量高于生成物总能量的是( )A、碳酸氢钠与盐酸反应 B、浓硫酸溶于水 C、石灰石分解 D、醋酸与氢氧化钠反应3. 某化学反应其△H=-122 kJ/mol,∆S=231 J/(mol·K),则此反应在下列哪种情况下可自发进行( )A、在任何温度下都能自发进行 B、在任何温度下都不能自发进行 C、仅在高温下自发进行 D、仅在低温下自发进行4. 下列说法不正确的是( )A、化学反应中的能量变化以物质变化为基础 B、所有的反应热都可以由量热计直接测得 C、其他条件相同,升高温度,化学反应速率加快 D、实验中可以通过定性观察的方法来比较反应速率的大小5. 在中,表示该反应速率最快的是( )A、v(A)=0.5mol•L-1•min-1 B、v(B)=1.2mol•L-1•min-1 C、v(C)=0.9mol•L-1•min-1 D、v(D)=1mol•L-1•min-16. 工业上二氧化硫制备三氧化硫时,采用 500℃左右的温度,其原因是( )
①提高 SO2 的转化率
②提高 O2 的转化率
③适当加快 SO3 的合成速率
④催化剂在 500℃左右时活性最好
A、①② B、① C、③④ D、①②④7. 下列说法正确的是( )A、若反应 , 则该反应在较低温度下不能自发 B、熵增的反应都是自发的,现象一定非常明显 C、若反应中反应物总键能低于生成物总键能,则该反应为吸热反应 D、科学家应大力研究 的条件,从而解决含碳不充分燃烧引起的环境问题8. 恒温恒容下反应达到平衡状态时,再通入一定量的 N2。下列说法正确的是(K 为平衡常数,Q 为浓度商)( )A、Q 不变,K 变大,H2 转化率增大 B、Q 增大,K 变大,N2转化率减小 C、Q 变小,K 不变,N2 转化率减小 D、Q 增大,K 不变,H2转化率增大9. 下列有关仪器使用或实验操作说法正确的是( )A、容量瓶、分液漏斗和蒸馏烧瓶使用前一定要检漏 B、锥形瓶、烧杯和蒸发皿都不能用酒精灯直接加热 C、用托盘天平称量 5.10 克氯化钠固体 D、中和热测定时每组实验温度计至少使用 3 次10. 一定温度下,某反应达到了化学平衡,其反应过程对应的能量变化如图。下列说法不正确的是( ) A、Ea 为正反应活化能,Ea'为逆反应活化能 B、该反应为放热反应,△H=Ea-Ea' C、温度升高,降低反应活化能,化学反应速率增大 D、所有活化分子的平均能量高于所有分子的平均能量11. 在反应中,其他条件不变,采取下列措施,既能加快反应速率又能使平衡正移的是( )A、缩小体积 B、增加碳的量 C、恒容通入 CO2 D、恒容通入 N212. 下列说法正确的是( )A、已知中和热 ΔH=-57.3kJ·mol-1 , 则 含1mol H2SO4的稀 H2SO4溶液和足量 Ba(OH)2溶液充分反应,放出热量114.6kJ B、已知在一定条件下, , 则该反应消耗 2mol N2后放出热量 184.8kJ C、甲烷的标准燃烧热 ΔH=–890.3kJ·mol-1 , 则 D、 , 则∆H1>∆H213. 下列事实不能用勒夏特列原理解释的是( )A、棕红色 NO2加压后颜色最终变深 B、氯气中混有氯化氢气体用饱和食盐水除杂 C、工业生产硫酸中使用过量的空气来提高 SO2 的转化率 D、已知 , 升高温度,混合气体颜色变深14. 下列说法正确的是( )A、催化剂可以降低反应的活化能,从而改变化学反应速率,影响平衡移动 B、加入或减少反应物的量,可以提高活化分子百分数,从而提高反应速率 C、升高温度能改变化学反应速率主要原因是增加了反应物中活化分子的百分数 D、有气体参加的化学反应,若增大压强(即缩小反应容器的体积),可增加活化分子的百分数,从而使反应速率增大15. 恒温下, 该反应达到平衡时 CO2浓度为 a mol•L-1 , 再充入 CO2使其浓度变为 2a mol•L-1 , 再次达到平衡后 CO2浓度为( )A、2a B、a C、介于 a 与 2a 之间 D、>2a16. 一定温度下,在 2L 密闭容器中发生该反 应,下列说法不正确的是( )
A、Ea 为正反应活化能,Ea'为逆反应活化能 B、该反应为放热反应,△H=Ea-Ea' C、温度升高,降低反应活化能,化学反应速率增大 D、所有活化分子的平均能量高于所有分子的平均能量11. 在反应中,其他条件不变,采取下列措施,既能加快反应速率又能使平衡正移的是( )A、缩小体积 B、增加碳的量 C、恒容通入 CO2 D、恒容通入 N212. 下列说法正确的是( )A、已知中和热 ΔH=-57.3kJ·mol-1 , 则 含1mol H2SO4的稀 H2SO4溶液和足量 Ba(OH)2溶液充分反应,放出热量114.6kJ B、已知在一定条件下, , 则该反应消耗 2mol N2后放出热量 184.8kJ C、甲烷的标准燃烧热 ΔH=–890.3kJ·mol-1 , 则 D、 , 则∆H1>∆H213. 下列事实不能用勒夏特列原理解释的是( )A、棕红色 NO2加压后颜色最终变深 B、氯气中混有氯化氢气体用饱和食盐水除杂 C、工业生产硫酸中使用过量的空气来提高 SO2 的转化率 D、已知 , 升高温度,混合气体颜色变深14. 下列说法正确的是( )A、催化剂可以降低反应的活化能,从而改变化学反应速率,影响平衡移动 B、加入或减少反应物的量,可以提高活化分子百分数,从而提高反应速率 C、升高温度能改变化学反应速率主要原因是增加了反应物中活化分子的百分数 D、有气体参加的化学反应,若增大压强(即缩小反应容器的体积),可增加活化分子的百分数,从而使反应速率增大15. 恒温下, 该反应达到平衡时 CO2浓度为 a mol•L-1 , 再充入 CO2使其浓度变为 2a mol•L-1 , 再次达到平衡后 CO2浓度为( )A、2a B、a C、介于 a 与 2a 之间 D、>2a16. 一定温度下,在 2L 密闭容器中发生该反 应,下列说法不正确的是( )物质
A
B
C
初始量/mol
1
2
0
平衡量/mol
0.5
A、反应达到平衡时,B 的转化率为 50% B、改变温度可改变此反应的平衡常数 C、反应前后压强保持不变 D、反应达平衡后,再充入 1mol A 与 2mol B,则达到新平衡后 C 的百分含量不变17. 关于一定条件下的化学平衡 , 下列说法正确的是( )A、升高温度,ν (正)减小,ν(逆)增大,平衡左移 B、增大压强,ν(正)、ν(逆)不变,平衡不移动 C、恒温恒容,充入 H2 , ν (正)增大,平衡右移 D、恒温恒压,充入 He,ν(正)减小,平衡右移18. 氢气作为一种清洁能源,一直是能源研究的热点,工业上制取氢气有多种方法: , 则 H-H 键的键能为( )化学键
C-H
H-O
键能/kJmol-1
414
1068
463
A、436 B、573 C、273 D、41919. T1 时,在 1L 的密闭容器中进行反应: , A、B 的起始浓度均为 0.5mol·L-1 , 起始压强为 p0 , 反应达到平衡状态时压强为p,且 , 下列说法不正确的是( )A、T1 时,该反应的 K= B、T1时,A 的平衡转化率为 80% C、升高温度,平衡常数为 100,可知该反应为吸热反应 D、T1达到平衡时,再充入 0.1molC 和 0.1molB,则平衡将正向移动20. 某密闭容器中充入等物质的量的A和B,一定温度下发生反应A(g)+xB(g)2C(g),达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间变化如图所示。下列说法中正确的是( )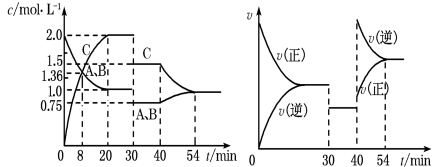 A、30min时降低温度,40min时升高温度 B、反应方程式中的x=1,正反应为吸热反应 C、8min前A的平均反应速率为0.08mol/(L·min) D、30min~40min间该反应使用了催化剂21. 下列关于如图所示转化关系(X 代表卤素)的说法不正确的是( )
A、30min时降低温度,40min时升高温度 B、反应方程式中的x=1,正反应为吸热反应 C、8min前A的平均反应速率为0.08mol/(L·min) D、30min~40min间该反应使用了催化剂21. 下列关于如图所示转化关系(X 代表卤素)的说法不正确的是( )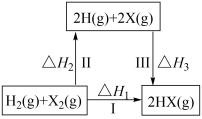 A、ΔH2> 0 B、 C、HX(g)分解反应,正反应活化能比逆反应大 D、按照 Cl、Br、I的顺序,ΔH3 依次减少22. 我国科研人员提出了由 CO2和 CH4 转化为高附加值产品CH3COOH 的催化反应历程,该历程如图所示:下列说法正确的是( )
A、ΔH2> 0 B、 C、HX(g)分解反应,正反应活化能比逆反应大 D、按照 Cl、Br、I的顺序,ΔH3 依次减少22. 我国科研人员提出了由 CO2和 CH4 转化为高附加值产品CH3COOH 的催化反应历程,该历程如图所示:下列说法正确的是( )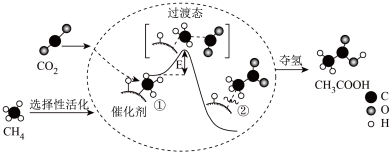 A、该反应为吸热反应 B、反应过程中,只有 C-H 键发生断裂 C、状态①②之间的能量差即该反应的焓变 D、反应速率与催化剂表面积有关23. 对于化学反应 , 某研究小组经研究后绘制了4幅图像,下列说法正确的是( )
A、该反应为吸热反应 B、反应过程中,只有 C-H 键发生断裂 C、状态①②之间的能量差即该反应的焓变 D、反应速率与催化剂表面积有关23. 对于化学反应 , 某研究小组经研究后绘制了4幅图像,下列说法正确的是( )

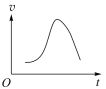
图a
图b
图c
图d
A、由图 a 可知该反应 ΔH >0 B、由图 b 可知,该反应 a+b<c C、若图 c 是绝热条件下速率和时间的图象,由此说明该反应吸热 D、图 d 中,曲线 a 一定增加了催化剂24. 反应物(S)转化为产物(P 或 P·Z)的能量与反应进程的关系如下图所示:
下列有关四种不同反应进程的说法正确的是( )
A、进程Ⅰ是吸热反应 B、平衡时 P 的产率:Ⅰ与Ⅱ相等 C、生成 P 的速率:Ⅲ大于Ⅱ D、上述反应进程Ⅳ中,Z 起催化作用25. 下列实验操作、现象和所得到的结论均正确的是( )选项
实验内容
实验结论
A
向2支均盛有2mL不同浓度Na2SO3溶液的试管中,同时加入2mL5%H2O2溶液,观察并比较实验现象
探究浓度对反应速率的影响
B
取两支试管,分别加入等浓度等体积的双氧水,试管①加入0.01mol·L-1的FeCl3溶液1mL,试管②加入0.01mol·L-1的CuCl2溶液1mL
试管①产生气泡快,说明加入FeCl3时,双氧水分解反应的活化能较小
C
取1mL0.1mol/LKI溶液于试管中,加入5mL0.1mol/LFeCl3 , 充分反应后滴入5滴15%KSCN溶液
溶液变血红色,则KI和FeCl3反应有一定限度
D
当反应达平衡后加入KCl固体
溶液颜色变浅,平衡逆移
A、A B、B C、C D、D二、填空题(本小题共 5 题,共 50 分)
-
26. 回答下列问题(1)、已知 1g 甲烷完全燃烧生成二氧化碳和液态水释放 56kJ 的热量,则甲烷燃烧的热化学方程式。(2)、 增大压强,平衡 填(“正向移动”“逆向移动”或“不移动”),颜色 (填“变深”“变浅”或“不变”)。(3)、工业制备纯硅的反应为 , 若将生成的HCl 通入 100mL1mol·L-1 的 NaOH 溶液中恰好完全反应,则此制备纯硅反应过程中的热效应是 kJ。27. 氨是氮循环过程中的重要物质,氨的合成是目前普遍使用的人工固氮方法。298.15K 时,N2、H2与 NH3 的平均能量与合成氨反应的活化能的曲线图如下所示,据图回答问题:
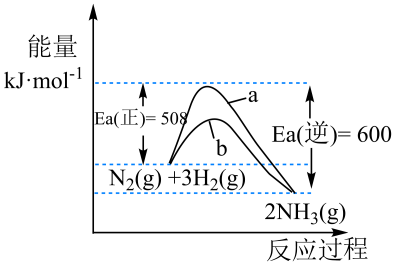 (1)、若反应中生成 2 mol 氨气,则反应 (填“吸热”或 “放热”) kJ(2)、图中曲线(填“a”或“b”)表示加入催化剂的能量变化曲线,催化剂能加快反应速率的原理: ;(3)、目前合成氨工业广泛采用的反应条件是 500℃、20~50MPa、铁触媒作催化剂,反应转化率不超过 50%。工业上为了进一步提高氨气的产率,你认为下列措施经济可行的是:____ ;A、升高反应温度,让更多的分子变成活化分子 B、降低反应温度,让反应向着有利于氨气生成的方向进行 C、将液氨及时从反应体系中分离出来 D、寻求能在更低的温度下有很强催化活性的新型催化剂(4)、合成氨所需的氢气可由甲烷与水反应制得,发生反应;在一定温度下,在体积为 1L 的容器中发生上述反应,各物质的物质的量浓度变化如下
(1)、若反应中生成 2 mol 氨气,则反应 (填“吸热”或 “放热”) kJ(2)、图中曲线(填“a”或“b”)表示加入催化剂的能量变化曲线,催化剂能加快反应速率的原理: ;(3)、目前合成氨工业广泛采用的反应条件是 500℃、20~50MPa、铁触媒作催化剂,反应转化率不超过 50%。工业上为了进一步提高氨气的产率,你认为下列措施经济可行的是:____ ;A、升高反应温度,让更多的分子变成活化分子 B、降低反应温度,让反应向着有利于氨气生成的方向进行 C、将液氨及时从反应体系中分离出来 D、寻求能在更低的温度下有很强催化活性的新型催化剂(4)、合成氨所需的氢气可由甲烷与水反应制得,发生反应;在一定温度下,在体积为 1L 的容器中发生上述反应,各物质的物质的量浓度变化如下t/min
CH4(mol/L)
H2O(mol/L)
CO(mol/L)
H2(mol/L)
0
0.2
0.3
0
0
2
n1
n2
n3
0.3
3
n1
n2
n3
0.3
4
0.09
0.19
x
0.33
①表中 x= mol/L;前 2min 内 CH4 的平均反应速率为
②下列不能作为反应达到平衡的判据是。
A.气体的压强不变 B.v 正(CH4)=v 逆(CO) C.K 不变
D.容器内气体的密度不变 E.断开 1molH-O 键同时断开 3molH-H 键
28. 在一个体积为 2L 的密闭容器中发生以下反应: ,其平衡常数(K)和温度(t)的关系如下表所示t/℃
700
800
830
1000
1200
K
0.6
0.9
1.0
1.7
2.6
(1)、该反应的平衡常数表达式 K= ;该反应 反应(填“吸热”或“放热”)(2)、600℃时,向容器中充入 1mol H2和 1mol CO2 气体,平衡时 CO 气体有 0.4mol,则 600℃时K=(3)、在 830℃向容器中充入 2mol CO 和 2mol H2O,保持温度不变,5 分钟后反应达到平衡后,其平衡常数 (填“大于”“小于”或“等于”)1,此时 H2O 的转化率为 。(4)、若 1000℃时,某时刻反应混合物中 CO2、H2、CO、H2O 物质的量分别为 2mol 、2mol 、4mol 、4mol ,则此时上述反应的平衡移动方向为 (填“正反应方向”“逆反应方向”或“不移动”)(5)、为提高平衡时 H2的转化率,除了适当控制反应温度,还可以采取的措施是 。29.(1)、Ⅰ.某同学利用控制变量法探究影响硫代硫酸钠与稀硫酸反应速率的因素时,设计了如下系列实验:
该实验①、②可探究对反应速率的影响,因此 V1= 。实验序号
反应温度/℃
Na2S2O3浓度
稀硫酸
H2O
V/mL
c/mol/L)
V/mL
c/mol/L)
V/mL
①
20
10.0
0.10
10.0
0.50
0
②
40
V1
0.10
V2
0.50
V3
③
20
V4
0.10
4.0
0.50
V5
(2)、实验(填实验序号)可探究硫酸浓度对反应速率的影响,因此V5= 。(3)、Ⅱ.用 0.5 mol·L−1 的盐酸与 0.55 mol·L−1 的 NaOH 溶液在下图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。请回答下列问题: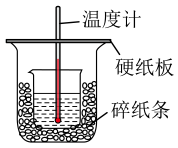
从实验装置上看,图中尚缺少的一种玻璃仪器是 , 该装置图还有一处错误是 。
(4)、取 50mLNaOH 溶液和 50mL 盐酸进行实验,实验数据如表。( 密度都是 1.0g/mL c=4.0J·g-1·℃-1)温度实验次数
起始温度/℃
终止温度t2/℃
HCl
NaOH
平均值
1
26.2
26.0
26.1
29.5
2
259
25.9
25.9
30.4
3
26.4
26.2
26.3
29.9
根据实验数据,计算中和热反应的 ΔH=
(5)、上述实验值与-57.3kJ·mol-1 有偏差,产生偏差的原因可能是a.实验装置保温、隔热效果差
b.量取盐酸溶液时仰视读数
c.分多次把 NaOH 倒入盛有盐酸的小烧杯中
d.用温度计测量 NaOH 溶液后直接测量盐酸溶液的温度
(6)、将一定量的稀氨水、稀氢氧化钡溶液、稀氢氧化钠溶液分别与 0.5mol·L−1 的盐酸恰好完全反应,其反应热分别是 ΔH1、ΔH2、ΔH3 , 则 ΔH1、ΔH2、ΔH3 的大小关系为 。30. 催化还原 CO2是解决“碳中和”及能源问题的重要手段之一、研究表明,在 Cu/ZnO/ZrO2催化剂存在下,CO2和 H2可发生两个平行反应,分别生成 CH3OH 和 CO。I
II
请回答(不考虑温度变化对 ΔH、ΔS 的影响):
(1)、高温时,副反应生产的 CO 也可以与 H2 反应生产甲醇。①写出该反应的热化学方程式 。
②该反应在 下能自发进行(选填“高温”“低温”或“任意温度”)。
(2)、在 2L 的密闭容器中按物质的量之比为 1∶3 充入 CO2和 H2 , 体系中仅发生主反应 I,测得平衡混合物中 CH3OH 的体积分数在不同压强下随温度的变化,如图所示。下列说法正确的是____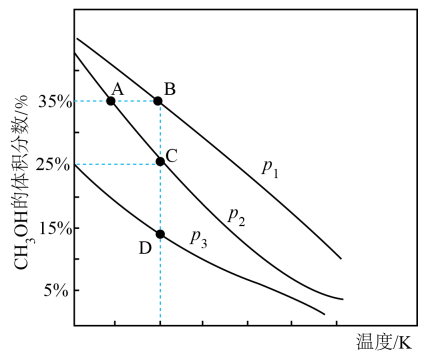 A、压强的大小关系为 p1>p2>p3 B、A、B、D 的平衡常数大小关系: C、若其它条件相同时,按 n(CO2)∶n(H2)=1∶2 充入容器,则 CO2平衡转化率变小 D、在 C 点时,CO2的转化率为 75%(3)、低温催化下只发生反应 I 和 II,在不同温度和压强下,CO2 的平衡转化率的变化曲线如图所示,请画出在压强 p3 下(p3>p1),CO2 平衡转化率随温度的变化曲线。
A、压强的大小关系为 p1>p2>p3 B、A、B、D 的平衡常数大小关系: C、若其它条件相同时,按 n(CO2)∶n(H2)=1∶2 充入容器,则 CO2平衡转化率变小 D、在 C 点时,CO2的转化率为 75%(3)、低温催化下只发生反应 I 和 II,在不同温度和压强下,CO2 的平衡转化率的变化曲线如图所示,请画出在压强 p3 下(p3>p1),CO2 平衡转化率随温度的变化曲线。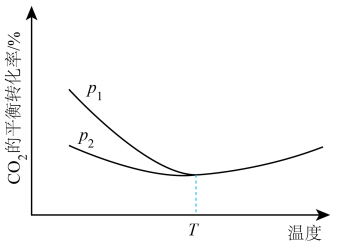 (4)、催化剂和反应条件与反应物的转化率和产物的选择性高度相关。某实验室控制 CO2 和 H2 的初始投料比为 1:2.2,在相同压强下,经过相同的反应时间测得如下实验数据:
(4)、催化剂和反应条件与反应物的转化率和产物的选择性高度相关。某实验室控制 CO2 和 H2 的初始投料比为 1:2.2,在相同压强下,经过相同的反应时间测得如下实验数据:实验编号
温度/K
催化剂
CO2的转化率/%
甲醇的选择性/%
A
543
Cu/ZnO纳米棒
12.3
42.3
B
543
Cu/ZnO纳米片
11.9
72.7
C
553
Cu/ZnO纳米棒
15.3
39.1
D
553
Cu/ZnO纳米片
12.0
70.6
(甲醇的选择性:转化的 CO2中生成甲醇的百分比)
根据上表所给数据,用 CO2 生产甲醇的最优条件为 (填写实验编号),请说明选择理由 。