浙江省嘉兴市2023-2024学年高三上学期一模化学试题(12月)
试卷更新日期:2024-01-09 类型:月考试卷
一、选择题(每小题只有一个选项符合题意,每小题3分,共48分)
-
1. 下列物质中属于新型无机非金属材料的是( )A、碳化硅 B、陶瓷 C、铝合金 D、普通玻璃2. 下列化学用语或说法中正确的是( )A、在氨水中,与分子间的氢键主要形式可表示为:
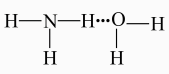 B、B原子由 , 时,由基态转化为激发态,形成吸收光谱
C、的VSEPR模型为
B、B原子由 , 时,由基态转化为激发态,形成吸收光谱
C、的VSEPR模型为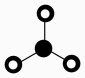 D、1个乙烯分子中有5个“”键和1个“”键
3. 下列说法不正确的是( )A、胆矾可以和石灰乳混合制成农药波尔多液 B、食品中添加适量二氧化硫可以起到漂白、防腐和抗氧化等作用 C、用乙烯和氧气在银催化下制备环氧乙烷是理想的“原子经济性反应” D、不锈钢是最常见的一种合金钢,它的主要元素是铬和镍4. 物质的性质决定用途,下列两者对应关系不正确的是( )A、漂白粉具有强氧化性,可用作游泳池等场所的消毒剂 B、纯铝的硬度和强度较小,可用来制造机器零件 C、碱石灰有吸水性,在实验室中常用作干燥剂 D、碳酸钠溶液显碱性,可用作食用碱或工业用碱5. 下列说法正确的是( )
D、1个乙烯分子中有5个“”键和1个“”键
3. 下列说法不正确的是( )A、胆矾可以和石灰乳混合制成农药波尔多液 B、食品中添加适量二氧化硫可以起到漂白、防腐和抗氧化等作用 C、用乙烯和氧气在银催化下制备环氧乙烷是理想的“原子经济性反应” D、不锈钢是最常见的一种合金钢,它的主要元素是铬和镍4. 物质的性质决定用途,下列两者对应关系不正确的是( )A、漂白粉具有强氧化性,可用作游泳池等场所的消毒剂 B、纯铝的硬度和强度较小,可用来制造机器零件 C、碱石灰有吸水性,在实验室中常用作干燥剂 D、碳酸钠溶液显碱性,可用作食用碱或工业用碱5. 下列说法正确的是( )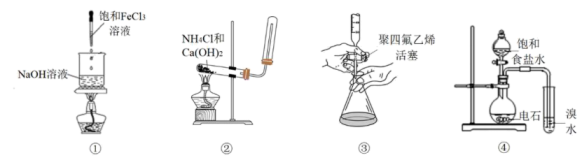 A、图①操作可用于实验室制取少量氢氧化铁胶体 B、图②装置可用于实验室制取并收集氨气 C、图③操作可用于氢氧化钠标准溶液滴定未知浓度的盐酸 D、图④装置可用于实验室制取乙炔并进行性质检验6. 是一种高效、环保的消毒剂,以下是常见的三种制备方法:
A、图①操作可用于实验室制取少量氢氧化铁胶体 B、图②装置可用于实验室制取并收集氨气 C、图③操作可用于氢氧化钠标准溶液滴定未知浓度的盐酸 D、图④装置可用于实验室制取乙炔并进行性质检验6. 是一种高效、环保的消毒剂,以下是常见的三种制备方法:①
②
③
下列说法正确的是( )
A、反应①中发生还原反应 B、上述反应中是氧化剂 C、反应③中HCl既体现酸性,又体现还原性 D、消毒效率是的2.5倍(消毒效率:单位质量的消毒剂得到的电子数)7. 是阿伏加德罗常数的值,下列说法正确的是( )A、1L的溶液中,硫酸根和氢氧根的总数目为 B、标准状况下,11.2L分子所含的原子数为 C、5.8g含有的键数目为 D、向含1mol的水溶液中加入足量充分反应,转移的电子数为8. 下列说法不正确的是( )A、蒸馏、萃取、重结晶和色谱法都可用于分离、提纯有机物 B、核苷酸通过缩聚反应可以得到核酸,核酸属于生物大分子 C、根据纤维在火焰上燃烧产生的气味,可以鉴别蚕丝与棉花 D、糖类都含有醛基,对氢氧化铜等弱氧化剂表现出还原性9. 下列离子反应方程式正确的是( )A、硫酸铝铵溶液中加入过量氢氧化钡: B、常温下铁加入过量浓硝酸中: C、澄清石灰水与过量碳酸氢钠溶液混合: D、硫化钠溶液中加入少量氯化铁溶液:10. 某药物具有清热解毒功效,其有效成分结构如下。下列有关该物质的说法不正确的是( )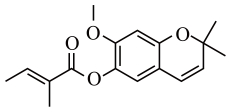 A、所有碳原子不可能处于同一平面上 B、存在顺反异构体 C、与足量充分反应后的产物中共含6个手性碳原子 D、1mol该物质最多可与2molNaOH反应11. X、Y、Z、R、Q是元素周期表中原子序数依次增大的前四周期元素,X是宇宙中含量最多的元素;Y与Z同周期,Y基态原子有3个未成对电子,Z元素原子的价层电子排布为;R元素简单离子在同周期离子中半径最小;Q元素最高能层只有1个电子,其余能层均充满电子。下列说法不正确的是( )A、是含有极性键和非极性键的极性分子 B、第一电离能: C、Q在周期表的ds区 D、电负性:12. 一水硫酸四氨合铜(Ⅱ)的化学式为是一种重要的染料及农药中间体。某学习小组以废铜料(含少量铁及难溶性杂质)为主要原料合成该物质,合成路线如下:
A、所有碳原子不可能处于同一平面上 B、存在顺反异构体 C、与足量充分反应后的产物中共含6个手性碳原子 D、1mol该物质最多可与2molNaOH反应11. X、Y、Z、R、Q是元素周期表中原子序数依次增大的前四周期元素,X是宇宙中含量最多的元素;Y与Z同周期,Y基态原子有3个未成对电子,Z元素原子的价层电子排布为;R元素简单离子在同周期离子中半径最小;Q元素最高能层只有1个电子,其余能层均充满电子。下列说法不正确的是( )A、是含有极性键和非极性键的极性分子 B、第一电离能: C、Q在周期表的ds区 D、电负性:12. 一水硫酸四氨合铜(Ⅱ)的化学式为是一种重要的染料及农药中间体。某学习小组以废铜料(含少量铁及难溶性杂质)为主要原料合成该物质,合成路线如下: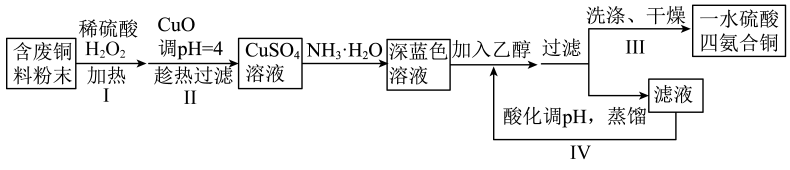
下列说法不正确的是( )
A、操作I中发生的主要反应为: B、操作II中趁热过滤除去的是难溶性杂质和氢氧化铁 C、操作III中洗涤可用乙醇和水的混合液,干燥可采用减压干燥方式 D、设计操作IV的目的是为了提高乙醇的利用率13. 现在广泛使用的锂离子电池有多种类型,某可充电钴酸锂电池的工作原理如图所示。下列叙述正确的是( )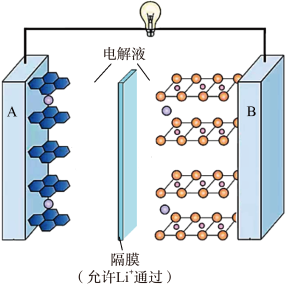 A、该电池放电时,其中正极的电极反应式是 B、充电时A极与电源的正极相连 C、放电时,移向电势较高的电极后得到电子发生还原反应 D、拆解废电池前先进行充电处理既可以保证安全又有利于回收锂14. 一定条件下,1mol和发生反应时,生成CO、或HCHO的能量变化如图所示[反应物和生成物略去]。下列说法不正确的是( )
A、该电池放电时,其中正极的电极反应式是 B、充电时A极与电源的正极相连 C、放电时,移向电势较高的电极后得到电子发生还原反应 D、拆解废电池前先进行充电处理既可以保证安全又有利于回收锂14. 一定条件下,1mol和发生反应时,生成CO、或HCHO的能量变化如图所示[反应物和生成物略去]。下列说法不正确的是( )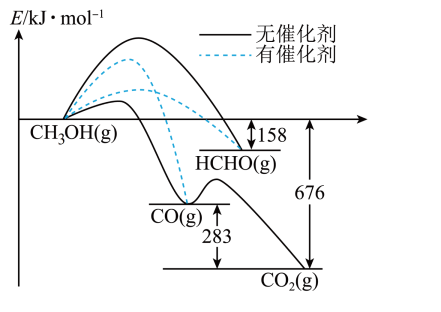 A、有催化剂时,主要产物为HCHO B、无催化剂时,升高温度更有利于提高甲醛的产率 C、该条件下比CO更稳定 D、加入该催化剂能提高图中各反应的速率,但不能改变反应的焓变15. 向AgCl饱和溶液(有足量AgCl固体)中滴加氨水,发生反应和 , 与的关系如下图所示(其中M代表、、或)。下列说法正确的是( )
A、有催化剂时,主要产物为HCHO B、无催化剂时,升高温度更有利于提高甲醛的产率 C、该条件下比CO更稳定 D、加入该催化剂能提高图中各反应的速率,但不能改变反应的焓变15. 向AgCl饱和溶液(有足量AgCl固体)中滴加氨水,发生反应和 , 与的关系如下图所示(其中M代表、、或)。下列说法正确的是( )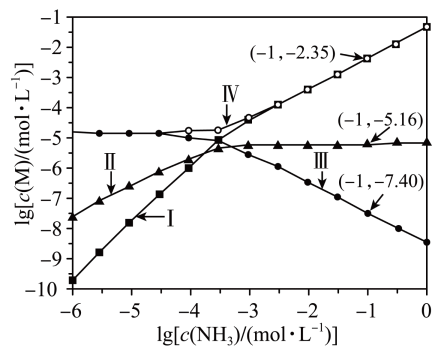 A、时,溶液中 B、曲线IV为随的变化曲线 C、时,溶液中 D、反应的平衡常数K的值为16. 探究硫元素单质及其化合物的性质,下列方案设计、现象和结论都正确的是( )
A、时,溶液中 B、曲线IV为随的变化曲线 C、时,溶液中 D、反应的平衡常数K的值为16. 探究硫元素单质及其化合物的性质,下列方案设计、现象和结论都正确的是( )实验方案
现象
结论
A
将硫黄与浓KOH溶液共热,待固体消失后,加入足量稀硫酸
溶液变浑浊
说明硫黄与碱反应生成硫化物和硫酸盐
B
测定均为离子化合物的和的熔点
的熔点更高
说明中离子键强于
C
向溶有的溶液中加入溶液
产生白色沉淀
说明可将氧化
D
将某固体溶于水,取上层清液,先滴加足量稀盐酸再滴加氯化钡溶液
滴加稀盐酸无明显现象,滴加氯化钡后产生白色沉淀
说明该固体中含有
A、A B、B C、C D、D二、非选择题填空题(本题有5小题,共52分)
-
17. 含氮族元素的物质种类繁多,应用广泛。回答下列问题:(1)、基态As原子的简化电子排布式为。(2)、下列说法正确的是____。A、基态P原子核外电子的空间运动状态有9种 B、键角大小: C、水溶液中的碱性: D、甘氨酸()可分别与水、乙醇形成分子间氢键,故甘氨酸在水、乙醇中均可溶解(3)、磷酸通过分子间脱水缩合形成多磷酸,如:

如果有n个磷酸分子间脱水形成环状的多磷酸,则该酸的分子式为。
(4)、已知是次磷酸的正盐,的结构式为。(5)、我国科学家制备的超大晶体已应用于大功率固体激光器,填补了国家战略空白。分别用〇、●表示和 , 晶体的四方晶胞(晶胞为长方体)如图(a)所示,图(b)、图(c)分别显示的是、在晶胞xz面、yz面上的位置。
①与紧邻的数目为。
②若晶胞底边的边长均为anm、高为cnm,为阿伏加德罗常数的值,则晶胞的密度(写出表达式)。
18. 氨气用途非常广泛,以下是氨气的部分转化关系图。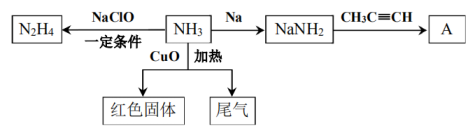
已知:①
②随着杂化轨道中s成分的增加,电子云更靠近原子核,核对电子的吸引力增强
(1)、又称联氨,不如氨气稳定,还原性强于氨气,与反应释放出大量热、产物无污染、产生大量气体,可作为火箭推进剂。①写出用于火箭推进剂反应的化学方程式。
②从分子结构角度分析,不如氨气稳定的原因是。
(2)、下列说法正确的是____。A、以上转化关系中只表现出还原性 B、若CuO无剩余,红色固体的组分可能有三种情况 C、制备氨基钠需在无水、无氧环境中进行 D、为了增加的产量,往往加入过量的NaClO(3)、结合已知信息,写出生成A的化学方程式。(4)、实验中在加热条件下通入过量的与CuO反应,设计实验验证尾气中比较活泼的两种气体。19. 乙烷是一种重要的化工原料,可用作制冷剂、燃料、制备乙烯的原料。回答下列问题:已知:①
②
③
(1)、乙烷催化氧化裂解法是一种新型的制备乙烯的方法,则。(2)、1000℃时,在某刚性密闭容器内充入一定量的 , 只发生反应①,若平衡时容器中总压为pPa,乙烷的转化率为 , 则该反应的平衡常数Pa(用含p、的代数式表示,为用分压表示的平衡常数)。达到平衡后,欲同时增大反应速率和乙烷的转化率,可采取的措施有(填选项字母)。A.升高温度B.通入惰性气体C.增加乙烷浓度D.加入催化剂
(3)、乙烷的氧化裂解反应产物中除了外,还存在、CO、C等副产物。图甲为温度对乙烷氧化裂解反应性能的影响,图乙为的值对乙烷氧化裂解反应性能的影响。
[乙烯选择性;乙烯收率=乙烷转化率×乙烯选择性]
下列说法正确的是____。
A、有利于提高乙烷平衡转化率的条件是高温低压 B、乙烷的转化率随温度的升高而增大的原因是此时反应未达平衡,升高温度,反应速率加快,反应物的转化率增大 C、较低时,生成乙烯的选择性较低的原因可能是氧气过量,乙烷发生深度氧化而导致乙烯的选择性降低 D、反应的最佳温度为700℃左右(4)、最新研究发现在乙烷的氧化裂解反应体系中充入一定量能更好的提高乙烷的转化率和乙烯的收率,请结合方程式说明原因。(5)、科技工作者结合实验与计算机模拟结果,研究了乙烷在催化剂表面脱氢制乙烯的反应,其部分历程如下图所示(吸附在催化剂表面的物种用*标注,TS表示过渡态)。此部分历程中决速步骤的反应方程式为。 20. 某研究小组模拟工业湿法制备新型绿色消毒剂高铁酸钾,按如下流程开展实验。
20. 某研究小组模拟工业湿法制备新型绿色消毒剂高铁酸钾,按如下流程开展实验。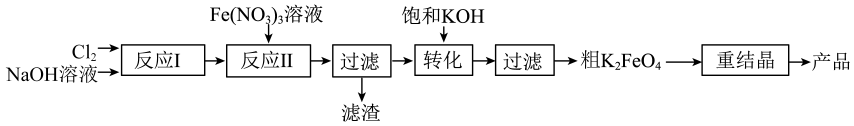
用以下装置可以完成上述反应I和反应Ⅱ:
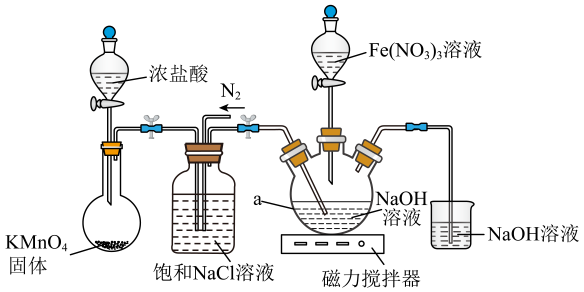
信息:①易溶于水,微溶于KOH溶液,难溶于乙醇;具有强氧化性,在酸性或中性溶液中快速产生;在0~5℃碱性溶液中较稳定。
②部分物质在水中的溶解度见下表
物质
溶解度/g
10℃
20℃
30℃
80℃
NaCl
35.8
36.0
36.3
38.4
80.0
88.0
96.0
148.0
(1)、仪器a的名称是 , 反应I中为了减少因反应过热而产生 , 可以采取的操作是。(2)、下列说法正确的是____。A、反应Ⅱ中为了加快反应速率,可进行搅拌与加热 B、反应Ⅱ结束后应通一段时间氮气,然后再拆下装置进行后续实验 C、加入饱和KOH溶液发生的是复分解反应 D、若用溶液代替溶液作铁源,的产率和纯度都会降低(3)、为了提高纯度需要对粗产品进行重结晶操作,从下列选项中选出合理的操作并排序:()→()→()→置于冰水浴中→()→用乙醇洗涤→干燥→得产品
a.将粗产品溶于水b.将粗产品溶于冷的稀KOH溶液 c.过滤取沉淀
d.过滤取滤液e.蒸发浓缩,趁热过滤f.加入饱和KOH溶液g.冷却结晶
(4)、测定产品的纯度(式量为M)称取ag左右碘化钾于碘量瓶中,加入100mLNaOH溶液和bg左右的固体氟化钠,待溶解完毕;准确称取mg样品于碘量瓶中,待样品充分溶解后,加硫酸酸化至反应完全;淀粉作指示剂,用标准溶液进行滴定,消耗标准液体积为VmL。已知: , (方程式未配平)
①本次实验测得纯度为 , 然后重复上述过程,平行测试3次。
②实验过程中往往需要加入过量且比理论计算所需量过量2~3倍左右的KI,理由是。
21. 有机物H是一种新型大环芳酰胺的合成原料,可通过以下方法合成(部分反应条件已省略)。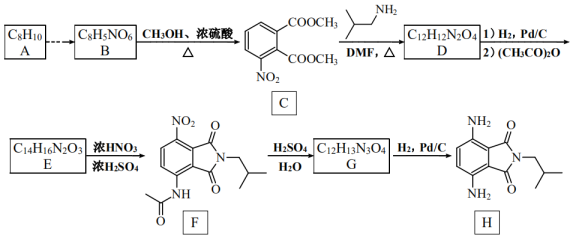
已知:①为邻、对位定位基,—COOH为间位定位基;
②苯胺有还原性,易被氧化。
(1)、化合物G的结构简式是 , F的官能团名称是。(2)、下列说法正确的是____。A、化合物B可与溶液反应 B、可依次通过取代反应、氧化反应实现A→B的转化 C、1mol化合物E最多可与3molNaOH发生反应 D、化合物H的分子式为(3)、写出C→D的化学方程式。(4)、B转化为C的过程中可能产生副产物I( ),写出4种同时符合下列条件的化合物I的同分异构体的结构简式。
),写出4种同时符合下列条件的化合物I的同分异构体的结构简式。①分子中含有苯环,无其他环;
②谱和IR谱检测表明:分子中有4种不同化学环境的氢原子,有
 , 无—OH和—O—O—(5)、凯夫拉(
, 无—OH和—O—O—(5)、凯夫拉(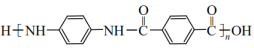 )材料广泛应用于防弹衣、坦克等兵器的生产。利用以上合成线路及已知信息,设计由苯胺(
)材料广泛应用于防弹衣、坦克等兵器的生产。利用以上合成线路及已知信息,设计由苯胺( )、、
)、、 为原料制备凯夫拉的合成路线(用流程图表示,无机试剂任选)。
为原料制备凯夫拉的合成路线(用流程图表示,无机试剂任选)。