浙江省舟山名校2023-2024学年高三上学期12月月考化学试题
试卷更新日期:2024-01-09 类型:月考试卷
一、选择题(本大题共16小题,每小题3分,共48分。每个小题列出的四个备选项中只有一个是符合题目要求的,不选、多选、错选均不得分)
-
1. 电解质对维持人体健康具有诸多作用,下列物质属于电解质的是( )A、SiO2 B、C2H5OH C、KCl D、Cu2. 下列化学用语表示正确的是( )A、HClO的结构式:H-Cl-O B、有机物(CH3CH2)2CHCH3的名称:3-甲基戊烷 C、乙二酸的实验式:C2H2O4 D、基态氧原子的轨道表示式:
 3. 过氧化钠是一种常用的化工试剂,下列说法不正确的是( )A、过氧化钠属于氧化物 B、过氧化钠可由钠和氧气反应制得 C、过氧化钠可用作呼吸面具中的氧气来源 D、过氧化钠在工业上常用于制备氢氧化钠4. 物质的性质决定用途,下列两者对应关系不正确的是( )A、Al(OH)3有弱碱性,可用于治疗胃酸过多 B、生铁硬度大、抗压性强,可用于铸造机器底座 C、稀硝酸有强氧化性,可清洗附着在试管内壁的银镜 D、单晶硅是良好的半导体材料,常用于制备光导纤维5. 下列说法不正确的是( )
3. 过氧化钠是一种常用的化工试剂,下列说法不正确的是( )A、过氧化钠属于氧化物 B、过氧化钠可由钠和氧气反应制得 C、过氧化钠可用作呼吸面具中的氧气来源 D、过氧化钠在工业上常用于制备氢氧化钠4. 物质的性质决定用途,下列两者对应关系不正确的是( )A、Al(OH)3有弱碱性,可用于治疗胃酸过多 B、生铁硬度大、抗压性强,可用于铸造机器底座 C、稀硝酸有强氧化性,可清洗附着在试管内壁的银镜 D、单晶硅是良好的半导体材料,常用于制备光导纤维5. 下列说法不正确的是( ) A、图①装置可用于加热分解NaHCO3固体 B、图②装置可通过喷泉现象证明氨气极易溶于水 C、图③装置可用于探究温度对化学平衡移动的影响 D、图④装置可用于测定中和反应的反应热6. 硼氢化钾制备纳米铜粉的反应方程式为:Cu2++2+6H2O=Cu+2HBO3+7H2↑,已知反应前后B元素价态不变。下列说法不正确的是( )A、还原剂是KBH4 B、还原产物是H2 C、生成3.2g铜时共转移0.4mol电子 D、若用Ag+替换Cu2+参加反应,可能制得纳米银粉7. 设NA为阿伏加德罗常数的值,下列说法正确的是( )A、1molCH3COOH中含有的σ键数目为8NA B、0.01mol/LBaCl2溶液含有的Ba2+数目为0.01NA C、加热条件下,3.2g铜与足量浓硫酸充分反应生成的SO2分子数目为0.05NA D、0.1molFeCl3加入沸水中充分反应,生成的Fe(OH)3胶体粒子的数目为0.1NA8. 下列说法正确的是( )A、如果苯酚浓溶液沾到皮肤,应立即用酒精洗 B、糖类都能发生水解反应,但各自水解的产物不相同 C、汽油和植物油都属于烃类,所以汽油和植物油都可以燃烧 D、向2mL蛋白质溶液中加入适量饱和硫酸铵溶液,产生沉淀,说明蛋白质发生了变性9. 下列离子方程式书写正确的是( )A、MgSO4与Ba(OH)2溶液反应:Ba2++=BaSO4↓ B、FeCl3溶液刻蚀电路铜板:2Fe3++3Cu=2Fe+3Cu2+ C、在Ca(HCO3)2溶液中加入过量澄清石灰水:Ca2+++OH-=CaCO3↓+H2O D、向苯酚钠溶液中通入少量CO2:2
A、图①装置可用于加热分解NaHCO3固体 B、图②装置可通过喷泉现象证明氨气极易溶于水 C、图③装置可用于探究温度对化学平衡移动的影响 D、图④装置可用于测定中和反应的反应热6. 硼氢化钾制备纳米铜粉的反应方程式为:Cu2++2+6H2O=Cu+2HBO3+7H2↑,已知反应前后B元素价态不变。下列说法不正确的是( )A、还原剂是KBH4 B、还原产物是H2 C、生成3.2g铜时共转移0.4mol电子 D、若用Ag+替换Cu2+参加反应,可能制得纳米银粉7. 设NA为阿伏加德罗常数的值,下列说法正确的是( )A、1molCH3COOH中含有的σ键数目为8NA B、0.01mol/LBaCl2溶液含有的Ba2+数目为0.01NA C、加热条件下,3.2g铜与足量浓硫酸充分反应生成的SO2分子数目为0.05NA D、0.1molFeCl3加入沸水中充分反应,生成的Fe(OH)3胶体粒子的数目为0.1NA8. 下列说法正确的是( )A、如果苯酚浓溶液沾到皮肤,应立即用酒精洗 B、糖类都能发生水解反应,但各自水解的产物不相同 C、汽油和植物油都属于烃类,所以汽油和植物油都可以燃烧 D、向2mL蛋白质溶液中加入适量饱和硫酸铵溶液,产生沉淀,说明蛋白质发生了变性9. 下列离子方程式书写正确的是( )A、MgSO4与Ba(OH)2溶液反应:Ba2++=BaSO4↓ B、FeCl3溶液刻蚀电路铜板:2Fe3++3Cu=2Fe+3Cu2+ C、在Ca(HCO3)2溶液中加入过量澄清石灰水:Ca2+++OH-=CaCO3↓+H2O D、向苯酚钠溶液中通入少量CO2:2 +CO2+H2O→2
+CO2+H2O→2 +
10. 奥培米芬是一种雌激素受体调节剂,下列说法正确的是( )
+
10. 奥培米芬是一种雌激素受体调节剂,下列说法正确的是( )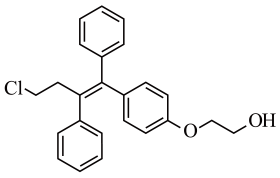 A、属于芳香烃 B、存在3种官能团 C、含有-OH等亲水基团,具有较好的水溶性 D、在KOH醇溶液或浓硫酸中加热均能发生消去反应11. 原子序数依次增大的4种短周期主族元素X、Y、Z、M,已知基态X原子含3个未成对电子,Y在同周期元素中的原子半径最小,Z的价层电子只有一种自旋方向,基态M原子s能级上电子总数比p能级少1。下列说法正确的是( )A、元素最高正价:Y>X>M>Z B、简单离子半径:M> Z>X>Y C、第一电离能:X>Y>Z>M D、最简单氢化物的稳定性:Y>X12. 某学习小组按下图探究金属电化学腐蚀与防护的原理,下列说法正确的是( )
A、属于芳香烃 B、存在3种官能团 C、含有-OH等亲水基团,具有较好的水溶性 D、在KOH醇溶液或浓硫酸中加热均能发生消去反应11. 原子序数依次增大的4种短周期主族元素X、Y、Z、M,已知基态X原子含3个未成对电子,Y在同周期元素中的原子半径最小,Z的价层电子只有一种自旋方向,基态M原子s能级上电子总数比p能级少1。下列说法正确的是( )A、元素最高正价:Y>X>M>Z B、简单离子半径:M> Z>X>Y C、第一电离能:X>Y>Z>M D、最简单氢化物的稳定性:Y>X12. 某学习小组按下图探究金属电化学腐蚀与防护的原理,下列说法正确的是( )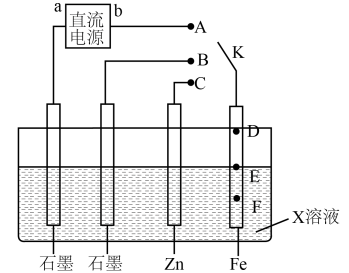 A、若b为正极,K连接A时,铁棒防腐的方式称为牺牲阳极的阴极保护法 B、相同条件下,若X为食盐水,K分别连接B、C时前者铁棒的腐蚀速度更慢 C、若X为模拟海水,K未闭合时铁棒上E点表面铁锈最多,腐蚀最严重的位置则是F D、若在X溶液中预先加入适量的K4[Fe(CN)6]溶液,可有效提升铁棒腐蚀或防腐的观察效果13. 利用如图装置,工业上燃料燃烧产生的SO2废气可与O2协同转化为重要的化工原料。下列说法不正确的是( )
A、若b为正极,K连接A时,铁棒防腐的方式称为牺牲阳极的阴极保护法 B、相同条件下,若X为食盐水,K分别连接B、C时前者铁棒的腐蚀速度更慢 C、若X为模拟海水,K未闭合时铁棒上E点表面铁锈最多,腐蚀最严重的位置则是F D、若在X溶液中预先加入适量的K4[Fe(CN)6]溶液,可有效提升铁棒腐蚀或防腐的观察效果13. 利用如图装置,工业上燃料燃烧产生的SO2废气可与O2协同转化为重要的化工原料。下列说法不正确的是( ) A、电极A为负极,X为阴离子交换膜 B、电极B上发生的电极反应为:O2+4e-+4H+=2H2O C、电池工作时,消耗O2、SO2物质的量之比为1:1 D、电池工作段时间后,右室中电解质溶液的pH无明显变化14. 苯与Br2在一定条件下能发生如下反应,其中部分转化历程与能量变化如图所示:
A、电极A为负极,X为阴离子交换膜 B、电极B上发生的电极反应为:O2+4e-+4H+=2H2O C、电池工作时,消耗O2、SO2物质的量之比为1:1 D、电池工作段时间后,右室中电解质溶液的pH无明显变化14. 苯与Br2在一定条件下能发生如下反应,其中部分转化历程与能量变化如图所示:
下列说法不正确的是( )
A、反应焓变:反应Ⅰ>反应Ⅱ B、在该条件下,反应Ⅲ能自发进行 C、苯与Br2主要发生取代反应,生成有机主产物Ⅱ D、选择相对较短的反应时间能有效增加产物Ⅰ的比例15. 已知: , , CuR难溶于水。常温下,Ka1()=1×10-9 , Ka2()=2×10-13 , 当10mL0.1mol/LH2R溶液中缓慢加入少量CuSO4粉末,溶液中c(H+)与(Cu2+)的变化如图所示(忽略溶液的体积变化)。下列有关说法不正确的是( ) A、X点溶液的pH≈5 B、根据Y点数据可求得Ksp(CuR)=1×10-24 C、Z点溶液中含R微粒的主要存在形式为H2R D、Y点对应的溶液中:c(H+)+2c(Cu2+)=2c(R2-)+c(HR-)+2c()+c(OH-)16. 探究氧族元素单质及其化合物的性质,下列方案设计、现象和结论都正确的是( )
A、X点溶液的pH≈5 B、根据Y点数据可求得Ksp(CuR)=1×10-24 C、Z点溶液中含R微粒的主要存在形式为H2R D、Y点对应的溶液中:c(H+)+2c(Cu2+)=2c(R2-)+c(HR-)+2c()+c(OH-)16. 探究氧族元素单质及其化合物的性质,下列方案设计、现象和结论都正确的是( )实验方案
现象
结论
A
向H2O2溶液中滴入几滴FeCl3溶液,并在试管口放置带火星的木条
带火星的木条复燃
FeCl3能催化H2O2分解产生O2
B
向滴有酚酞的NaOH溶液中通入SO2
溶液的红色褪去
SO2具有漂白性
C
向盛有少量Na2SO3固体、NaBr固体的两支试管中分别加入等量浓H2SO4
分别产生无色和红棕色的刺激性气味气体
氧化性:Br2>SO2
D
向Na2S溶液中依次加入几滴酸性KMnO4溶液、BaCl2溶液
产生大量白色沉淀
S2-能被氧化为
A、A B、B C、C D、D二、非选择题(本大题共5小题,共52分)
-
17. 铜的化合物种类繁多,应用广泛。请回答:(1)、Cu在周期表中的区,当焰色试验时Cu的一个3d轨道电子会跃迁至4p轨道,写出该激发态Cu核外的电子排布式。(2)、[Cu(NH3)4]SO4·H2O是一种农业杀虫剂。
①下列相关说法正确的是。
A.该化合物中NH3的中心原子的杂化轨道类型为sp3
B.该化合物中存在的化学键有离子键、共价键、配位键和氢键
C.组成该化合物的元素N、O、S中,第一电离能最大的是N
D.根据VSEPR模型预测的的空间结构是正四面体形
②比较键角∠H-N-H的大小:NH3[Cu(NH3)]2+(填“>”或“<”),理由是。
(3)、某磷青铜晶体的晶胞结构如图所示,则该晶体中与磷原子距离最近的铜原子共有个,若晶体的密度为g/cm3 , 阿伏加德罗常数的值为NA , 则晶胞的边长a=nm。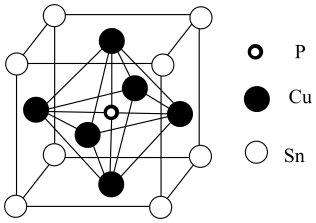 18. 亚硝酰氯(NOCl)是有机药物制备的重要试剂,可按以下流程合成和利用。
18. 亚硝酰氯(NOCl)是有机药物制备的重要试剂,可按以下流程合成和利用。
已知:亚硝酰氯有毒,沸点-5.5℃,分子中各原子均满足8电子稳定结构。
请回答:
(1)、NOCl的电子式为 , 化合物X的结构简式为。(2)、下列说法正确的是____。A、NOCl中的氮元素呈正价 B、NOCl分子的空间结构为V形 C、化合物X的沸点低于氯乙酰胺( )
D、工业上可以用蒸馏水吸收多余的NOCl,防止污染环境
(3)、已知浓盐酸和浓硝酸混合配制王水时也会产生亚硝酰氯,写出该反应的化学方程式。(4)、设计实验验证化合物X中含有Cl元素;写出实验过程中涉及的反应方程式。19. 研究海洋中珊瑚礁(主要成分CaCO3)的形成机制及其影响具有重要意义,相关主要反应有:
)
D、工业上可以用蒸馏水吸收多余的NOCl,防止污染环境
(3)、已知浓盐酸和浓硝酸混合配制王水时也会产生亚硝酰氯,写出该反应的化学方程式。(4)、设计实验验证化合物X中含有Cl元素;写出实验过程中涉及的反应方程式。19. 研究海洋中珊瑚礁(主要成分CaCO3)的形成机制及其影响具有重要意义,相关主要反应有:反应Ⅰ:CO2(aq)+H2O(l)(aq)+H+(aq) K1=4.5×10-7
反应Ⅱ:(aq)(aq)+H+(aq) K2= 4.7×10-11
反应Ⅲ:CaCO3(s)Ca2+(aq)+(aq) K3=3.4×10-9
请回答:
(1)、珊瑚礁形成的总反应可表示为Ca2+(aq)+2(aq)=CaCO3(s)+CO2(aq)+H2O(l)。有利于珊瑚礁形成的环境是(填“温暖海域”或“冰冷海域”),该反应的平衡常数K=(用K1、K2、K3表示)。(2)、海水的pH为8.0~8.3,下列有关珊瑚礁形成过程的叙述中正确的是____。A、海水中最主要的含碳微粒为 B、海水中的c(Ca2+)>c()+c() C、、的水解反应是海水呈弱碱性的主要原因 D、珊瑚礁形成的反应阻碍了的电离(3)、温室气体CO2的浓度上升,会导致海水酸化,促使珊瑚礁的溶解。科学家模拟海洋环境探究不同温度下海水中CO2浓度与浓度间的关系。已知T1℃下测得c(CO2)与c()的关系如图,请画出T2℃(T2>T1)时c()随c(CO2)的变化趋势。 (4)、工业上可用(NH4)2CO3溶液捕获CO2以减少其排放:(NH4)2CO3(aq)+H2O(1)+CO2(g)=2NH4HCO3(aq) △H。不同温度下,在同一密闭容器中充入同浓度的CO2 , 加入同浓度同体积的(NH4)2CO3溶液,经相同时间,测得CO2浓度如图,则△H0(填“>”“<”或“=”);随温度的升高,容器中CO2的浓度在T3温度下出现最低值的原因是。
(4)、工业上可用(NH4)2CO3溶液捕获CO2以减少其排放:(NH4)2CO3(aq)+H2O(1)+CO2(g)=2NH4HCO3(aq) △H。不同温度下,在同一密闭容器中充入同浓度的CO2 , 加入同浓度同体积的(NH4)2CO3溶液,经相同时间,测得CO2浓度如图,则△H0(填“>”“<”或“=”);随温度的升高,容器中CO2的浓度在T3温度下出现最低值的原因是。 20. 某化学兴趣小组拟按如下步骤合成铁系催化剂的中间体[Fe(CO)2Cl2]:
20. 某化学兴趣小组拟按如下步骤合成铁系催化剂的中间体[Fe(CO)2Cl2]:
其中步骤①实验装置如图所示:

已知:
(I)多聚甲醛为(CH2O)n(n=6~100),当n<12的多聚甲醛可溶于水,当n≥12则不溶于水;加酸或160~200℃加热时会解聚。
(Ⅰ)[Fe(CO)2Cl2]遇氧气、水都会反应,其中Fe的化合价为+2价。
(Ⅱ)SnCl2有强还原性,可被弱氧化剂HgCl2氧化:2HgCl2+SnCl2=Hg2Cl2↓+SnCl4
请回答:
(1)、步骤③产物干燥后仍需放置在干燥器中,以下称为干燥器的是____。A、 B、
B、 C、
C、 D、
D、 (2)、操作步骤②时仍需在氩气氛围下完成,理由是。(3)、写出生成[Fe(CO)2Cl2]的化学反应方程式。(4)、仪器a中盛放的试剂为 , 装置b的作用是。(5)、测定产品纯度时,先称取一定量[Fe(CO)2Cl2],经多步处理并转化为Fe2+后,再用KMnO4标准溶液(用Na2C2O4标准溶液标定)滴定其含量。从下列选项中选出合理的操作并排序: 。
(2)、操作步骤②时仍需在氩气氛围下完成,理由是。(3)、写出生成[Fe(CO)2Cl2]的化学反应方程式。(4)、仪器a中盛放的试剂为 , 装置b的作用是。(5)、测定产品纯度时,先称取一定量[Fe(CO)2Cl2],经多步处理并转化为Fe2+后,再用KMnO4标准溶液(用Na2C2O4标准溶液标定)滴定其含量。从下列选项中选出合理的操作并排序: 。c→→a→→→f
a.将准确称量的[Fe(CO)2Cl2]溶解于水
b.准确称量Na2C2O4并配制一定物质的量浓度的溶液,进行滴定
c.将制备的KMnO4溶液加热煮沸,冷却后滤去MnO2
d.用HgCl2除过量的SnCl2 , 滤去沉淀
e.加入足量SnCl2进行还原
f.用Na2C2O4标准溶液标定后的KMnO4溶液进行滴定
下列情况会导致测量结果偏大的是。
A.[Fe(CO)2Cl2]产品含少量多聚甲醛杂质
B.过量的SnCl2未被除尽
C.[Fe(CO)2Cl2]产品部分氧化或潮解
D.配好的KMnO4标准溶液久置后使用
21. 抗帕金森病药物恩他卡朋的一种合成路线如下(部分反应条件已省略):
已知:
(Ⅰ)R1-OHR1-X;
(Ⅱ)R2COOHR2-COX;
(Ⅲ)R-COXR3-CONH2
请回答:
(1)、恩他卡朋含氧官能团的名称是。(2)、化合物J的结构简式是。(3)、下列有关说法不正确的是____。A、恩他卡朋的分子式是C14H14N2O5 B、反应①②③④⑤涉及取代、氧化、加成等反应类型 C、化合物D与足量H2充分还原后的产物中共含3个手性碳原子 D、工业上在低温、CH2Cl2溶剂条件下实现D→E转化主要为了调控反应的速率(4)、写出反应⑥的化学方程式。(5)、设计上图中以甲醛(HCHO)为原料制备化合物G的路线 (用流程图表示,无机试剂任选)。(6)、化合物E同时符合以下条件的同分异构体(不包括立体异构体)中,其结构简式除 外还有。
外还有。①只含有一个环的芳香族化合物
②核磁共振氢谱显示共有3组峰,强度比为2:2:3
③分子中不含有亚硝基(-N=O)和酯基