浙江省嘉兴名校2023-2024学年高二上学期第二次教学调研(12月)化学试题
试卷更新日期:2024-01-09 类型:月考试卷
一、选择题Ⅰ(本大题共25小题,每小题2分,共50分。每小题列出的四个备选项中只有一个是符合题目要求的,不选、多选、错选均不得分)
-
1. 下列物质含共价键且属于盐的是( )A、 B、 C、KClO D、2. 下列粒子对水的电离没有影响的是( )A、CH3COOH B、
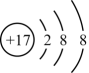 C、M3+:1s22s22p6
D、
C、M3+:1s22s22p6
D、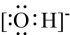 3. 下列表示的不同状态的N元素原子中,第一电离能最小的是( )A、 B、 C、 D、4. 下列说法正确的是( )A、铜元素位于元素周期表的d区 B、中子数为32的铁原子: C、的空间结构为三角锥形 D、Cl-Cl的键电子云图形为:
3. 下列表示的不同状态的N元素原子中,第一电离能最小的是( )A、 B、 C、 D、4. 下列说法正确的是( )A、铜元素位于元素周期表的d区 B、中子数为32的铁原子: C、的空间结构为三角锥形 D、Cl-Cl的键电子云图形为: 5. 下列生活中常用的方法,其原理与盐类的水解反应有关的是( )A、用草木灰去除油污 B、用氢氢化铝中和过多胃酸 C、用食盐腌制腊肉 D、用白醋清洗水壶中的水垢6. 下列说法错误的是( )A、下列离子在溶液中能大量共存:Al3+、Na+、S2﹣、NO B、为保存FeCl3溶液,要在溶液中加入少量盐酸 C、实验室盛放Na2CO3 , Na2SiO3等溶液的试剂瓶应用橡皮塞,而不能用玻璃塞 D、相同浓度的NaX、NaY、NaZ的溶液,其pH依次增大则HX、HY、HZ的酸性依次减弱7. 下列离子方程式书写正确的是( )A、NaHCO3溶液的水解: B、向溶液中通入少量SO2: C、向溶液中滴加Na2CO3溶液: D、向CaCl2溶液中通入CO2:8. 下列物质的水溶液在空气中小心加热蒸干至质量不再减少,能得到较纯净的原溶质的是( )
5. 下列生活中常用的方法,其原理与盐类的水解反应有关的是( )A、用草木灰去除油污 B、用氢氢化铝中和过多胃酸 C、用食盐腌制腊肉 D、用白醋清洗水壶中的水垢6. 下列说法错误的是( )A、下列离子在溶液中能大量共存:Al3+、Na+、S2﹣、NO B、为保存FeCl3溶液,要在溶液中加入少量盐酸 C、实验室盛放Na2CO3 , Na2SiO3等溶液的试剂瓶应用橡皮塞,而不能用玻璃塞 D、相同浓度的NaX、NaY、NaZ的溶液,其pH依次增大则HX、HY、HZ的酸性依次减弱7. 下列离子方程式书写正确的是( )A、NaHCO3溶液的水解: B、向溶液中通入少量SO2: C、向溶液中滴加Na2CO3溶液: D、向CaCl2溶液中通入CO2:8. 下列物质的水溶液在空气中小心加热蒸干至质量不再减少,能得到较纯净的原溶质的是( )① ② ③ ④ ⑤ ⑥
A、全部 B、仅①② C、仅①⑤ D、仅①9. 有5种元素X、Y、Z、Q、T。X原子M电子层上p能级有2个未成对电子且无空轨道;Y原子的价层电子排布式为3d64s2;Z原子的L电子层的p能级上有一个空轨道;Q原子的L电子层的p能级上只有一对成对电子;T原子的M电子层上p轨道半充满。下列叙述不正确的是( )A、元素Y和Q可形成化合物Y2Q3 B、简单离子半径:T>X>Q C、的中心原子价层电子对数为3 D、XQ2的空间结构是V形10. 下列说法或有关化学用语的表达正确的是( )A、能级能量大小关系: B、基态铜原子(29Cu)的价层电子排布式: C、处于激发态的电子排布式可能为: D、基态的轨道表示式: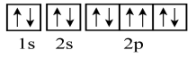 11. 下列有关比较正确的是( )A、熔点: B、熔、沸点:NaBr>NaCl>MgO C、酸性: D、热稳定性:12. 下列各组分子或离子中所有原子都可能处于同一平面的是( )A、、、 B、、、 C、、、 D、、、+13. 下列说法正确的是( )A、恒温恒容下, , 当混合气体的密度不再发生变化时,能表明该反应达到平衡状态 B、恒温恒容下,达到平衡,移走部分N,平衡向正反应方向移动 C、 , 反应达至平衡后,升温,则反应速率和的平衡转化率均增大 D、实验室制氢气,为了加快反应速率,可在稀硫酸中加少量固体14. 下列依据热化学方程式得出的结论正确的是( )A、已知 , 则氢气的燃烧热为 B、在一定温度和压强下,将和置于密闭容器中充分反应生成 , 放出热量19.3kJ,则其热化学方程式为 C、已知酸和碱发生中和反应生成1mol水,这时的反应热叫中和热 D、已知 , 虽然该反应为可逆反应,但该反应的焓变仍可通过一定的实验方法直接测得15. 根据杂化轨道理论和价层电子对互斥模型判断,下列说法不正确的是( )
11. 下列有关比较正确的是( )A、熔点: B、熔、沸点:NaBr>NaCl>MgO C、酸性: D、热稳定性:12. 下列各组分子或离子中所有原子都可能处于同一平面的是( )A、、、 B、、、 C、、、 D、、、+13. 下列说法正确的是( )A、恒温恒容下, , 当混合气体的密度不再发生变化时,能表明该反应达到平衡状态 B、恒温恒容下,达到平衡,移走部分N,平衡向正反应方向移动 C、 , 反应达至平衡后,升温,则反应速率和的平衡转化率均增大 D、实验室制氢气,为了加快反应速率,可在稀硫酸中加少量固体14. 下列依据热化学方程式得出的结论正确的是( )A、已知 , 则氢气的燃烧热为 B、在一定温度和压强下,将和置于密闭容器中充分反应生成 , 放出热量19.3kJ,则其热化学方程式为 C、已知酸和碱发生中和反应生成1mol水,这时的反应热叫中和热 D、已知 , 虽然该反应为可逆反应,但该反应的焓变仍可通过一定的实验方法直接测得15. 根据杂化轨道理论和价层电子对互斥模型判断,下列说法不正确的是( )选项
粒子
中心原子杂化方式
VSEPR模型
空间结构
A
直线形
直线形
B
四面体形
三角锥形
C
四面体形
平面三角形
D
四面体形
三角锥形
A、A B、B C、C D、D16. 下列说法一定正确的是( )A、25℃时,向溶液中加入的NaOH溶液,当水电离出的时,滴加氢氧化钠溶液的体积可能出现两种情况,则HA为弱酸 B、常温下,将pH=2的一元酸HA溶液与pH=12的一元碱BOH溶液等体积混合,所得溶液pH=7 C、相同温度下,的NaCl溶液和的NaCN溶液中的离子总数相等 D、将冰醋酸加水稀释,冰醋酸的电离度逐渐增加,但电离常数Ka不变,逐渐增大,导电性逐渐增强17. 某种离子液体的结构如图所示,X、Y、Z、M、Q为原子序数依次增大的短周期元素,Z的原子序数等于X、Y原子序数之和,Q为非金属性最强的元素。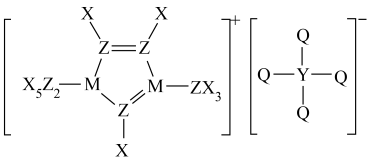
下列说法正确的是( )
A、氢化物的沸点: B、基态原子未成对电子数: C、简单离子半径: D、基态原子第一电离能由大到小的顺序为:18. 向含的废水中加入铁粉和可制备 , 发生反应: , 下列说法错误的是( )A、依据反应可知:;还原性: B、基态碳原子和基态氮原子的未成对电子之比为2∶3 C、位于周期表中第VIII族;反应中失去电子 D、离子半径大小:19. 相同金属在其不同浓度盐溶液中可形成浓差电池。如图所示装置是利用浓差电池电解Na2SO4溶液(a、b电极均为石墨电极),可以制得O2、H2、H2SO4和NaOH.下列说法正确的是( ) A、电池放电过程中,Cu(2)作正极,电极反应为Cu2++2e-═Cu B、c、d离子交换膜依次为阳离子交换膜和阴离子交换膜 C、b为电解池的阴极,电极反应为2H2O+2e-═H2↑+2OH- D、电池从开始工作到停止放电,电解池理论上可制得80gNaOH20. NaOH标准溶液的配制和标定,需经过NaOH溶液配制、基准物质的称量以及用NaOH溶液滴定等操作。下列有关说法中正确的是( )
A、电池放电过程中,Cu(2)作正极,电极反应为Cu2++2e-═Cu B、c、d离子交换膜依次为阳离子交换膜和阴离子交换膜 C、b为电解池的阴极,电极反应为2H2O+2e-═H2↑+2OH- D、电池从开始工作到停止放电,电解池理论上可制得80gNaOH20. NaOH标准溶液的配制和标定,需经过NaOH溶液配制、基准物质的称量以及用NaOH溶液滴定等操作。下列有关说法中正确的是( )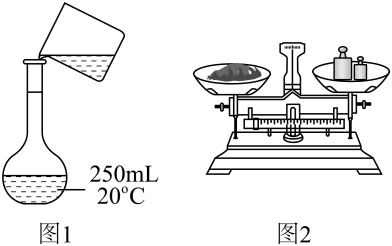
 A、用图1所示操作转移NaOH溶液到容量瓶中 B、用图2所示装置准确称得固体 C、用图3所示操作排出碱式滴定管中的气泡 D、用图4所示装置以NaOH待测液滴定21. “类比”是预测物质性质与化学反应的重要方法之一,但“类比”不能违背客观事实,下列“类比”合理的是( )A、Na2O2与CO2反应生成Na2CO3和O2 , 则Na2O2与SO2反应生成Na2SO3和O2 B、Na在空气中燃烧生成Na2O2 , 则同族的Li在空气中燃烧也生成Li2O2 C、Al(OH)3溶于NaOH溶液生成Na[Al(OH)4],则Be(OH)2也能溶于NaOH溶液生成Na2[Be(OH)4] D、Al3+与S2﹣在水溶液中因水解无法大量共存,则Fe3+与S2﹣在水溶液中也因水解无法大量共存22. 已知:T℃时,Ksp(CaSO4)=4.0×10-6、Ksp(CaCO3)=4.0×10-9、Ksp(PbCO3)=8.4×10-14 , 三种盐的沉淀溶解平衡曲线如图所示,pM=-lgc(阴离子)、pN=-lgc(阳离子)。下列说法错误的是( )
A、用图1所示操作转移NaOH溶液到容量瓶中 B、用图2所示装置准确称得固体 C、用图3所示操作排出碱式滴定管中的气泡 D、用图4所示装置以NaOH待测液滴定21. “类比”是预测物质性质与化学反应的重要方法之一,但“类比”不能违背客观事实,下列“类比”合理的是( )A、Na2O2与CO2反应生成Na2CO3和O2 , 则Na2O2与SO2反应生成Na2SO3和O2 B、Na在空气中燃烧生成Na2O2 , 则同族的Li在空气中燃烧也生成Li2O2 C、Al(OH)3溶于NaOH溶液生成Na[Al(OH)4],则Be(OH)2也能溶于NaOH溶液生成Na2[Be(OH)4] D、Al3+与S2﹣在水溶液中因水解无法大量共存,则Fe3+与S2﹣在水溶液中也因水解无法大量共存22. 已知:T℃时,Ksp(CaSO4)=4.0×10-6、Ksp(CaCO3)=4.0×10-9、Ksp(PbCO3)=8.4×10-14 , 三种盐的沉淀溶解平衡曲线如图所示,pM=-lgc(阴离子)、pN=-lgc(阳离子)。下列说法错误的是( ) A、a线是CaSO4沉淀溶解平衡曲线 B、T℃时,向0.001mol CaCO3沉淀中加入Na2SO4溶液(反应后溶液为1L),使CaCO3沉淀会转化为CaSO4沉淀,所需Na2SO4的物质的量至少为1.001mol C、T℃时,向10mL水中加入CaCO3和PbCO3至二者均饱和,溶液中= D、若d点表示CaCO3的饱和溶液加入CaSO4饱和溶液等体积混合则:c()<c(Ca2+)<c(SO)23. 我国科学家研究化合物催化氢化生成甲酸的机理,其中由化合物生成化合物过程的机理和相对能量曲线如下图所示。均为过渡态。下列说法正确的是( )
A、a线是CaSO4沉淀溶解平衡曲线 B、T℃时,向0.001mol CaCO3沉淀中加入Na2SO4溶液(反应后溶液为1L),使CaCO3沉淀会转化为CaSO4沉淀,所需Na2SO4的物质的量至少为1.001mol C、T℃时,向10mL水中加入CaCO3和PbCO3至二者均饱和,溶液中= D、若d点表示CaCO3的饱和溶液加入CaSO4饱和溶液等体积混合则:c()<c(Ca2+)<c(SO)23. 我国科学家研究化合物催化氢化生成甲酸的机理,其中由化合物生成化合物过程的机理和相对能量曲线如下图所示。均为过渡态。下列说法正确的是( )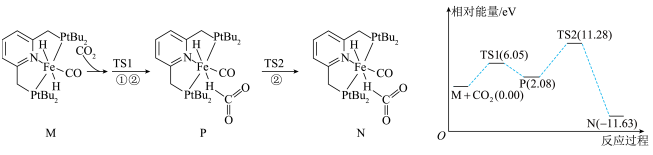 A、过渡态TS1比化合物Р更稳定 B、过程M→P为化合物M生成化合物N的决速步骤 C、化合物M催化氢化生成甲酸的反应过程中一定有键的生成和断裂 D、由生成的热化学方程式:24. 下列实验操作、现象及结论均正确是( )
A、过渡态TS1比化合物Р更稳定 B、过程M→P为化合物M生成化合物N的决速步骤 C、化合物M催化氢化生成甲酸的反应过程中一定有键的生成和断裂 D、由生成的热化学方程式:24. 下列实验操作、现象及结论均正确是( )选项
操作和现象
结论
A
常温下,用pH计分别测定等体积溶液和溶液的pH,pH均为7
两种溶液中水的电离程度相同
B
向2mL的KI溶液中滴加2mL的溶液,充分反应后加入2mL , 取上层溶液滴加KSCN溶液,溶液变红色
与KI的反应存在限度
C
向溶有的的溶液中通入气体X,出现白色沉淀
X具有强氧化性
D
向2mL溶液中滴入3滴NaOH溶液,再滴入4滴溶液,先产生白色沉淀,后产生红褐色沉淀
同温度下的:
A、A B、B C、C D、D25. 下列叙述及对应图示错误的是( )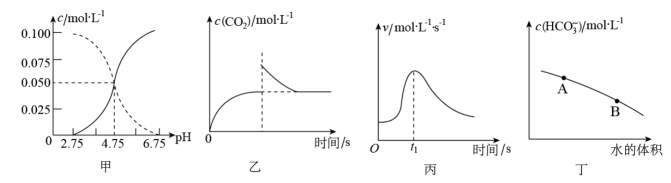 A、图甲是某温度下的醋酸与醋酸钠混合溶液中、与pH的关系曲线,的溶液中: B、图乙是恒温密闭容器中发生反应时,随反应时间变化的曲线,时刻改变的条件可能是缩小容器的体积 C、图丙是铁条与盐酸反应的反应速率随反应时间变化的曲线,时刻溶液的温度最高 D、图丁是在的溶液中加水稀释,随着加入水的体积的增大,溶液中的变化曲线,的水解程度:A点小于B点
A、图甲是某温度下的醋酸与醋酸钠混合溶液中、与pH的关系曲线,的溶液中: B、图乙是恒温密闭容器中发生反应时,随反应时间变化的曲线,时刻改变的条件可能是缩小容器的体积 C、图丙是铁条与盐酸反应的反应速率随反应时间变化的曲线,时刻溶液的温度最高 D、图丁是在的溶液中加水稀释,随着加入水的体积的增大,溶液中的变化曲线,的水解程度:A点小于B点二、非选择题(本大题共4小题,共50分)
-
26. 雄黄(As4S4)、雌黄(As2S3)均可入药,具有解毒、杀菌、去燥湿的功效,也是中国画主要的黄色矿物质颜料。回答下列问题:(1)、基态硫原子核外电子的空间运动状态有种;其核外电子运动最高能级的电子云轮廓图的形状为。(2)、基态砷原子的价层电子的轨道表示式为。(3)、第一电离能AsSe(填“>”或“<”)。(4)、基态原子的N能层有1个未成对电子,M能层未成对电子数最多的元素是(填元素符号,下同),其价层电子排布式为。该元素处于周期表的区。27. 工业合成氨是20世纪的伟大成就之一,但化肥的过度使用、硝酸工业废气和动车尾气的排放,给水体和大气带来了一定程度的污染,需要进行综合处理。(1)、工业合成氨反应为: kJ·mol , 下列说法正确的是____。A、采用高温以提高反应的平衡转化率 B、采用高压以加快反应速率,提高的产量 C、为提高转化率,可适当增大的浓度 D、生产过程中将液化分离,有利于氨的合成(2)、一种电化学合成氨的原理如图所示。产生的电极反应式是。
 (3)、Ⅱ.含氮污染的处理
(3)、Ⅱ.含氮污染的处理水体中氨氮处理:在微生物作用下,废水中经两步反应被氧化成:
kJ·mol
kJ·mol
则全部氧化成的热化学方程式是。
(4)、大气中NO处理:电解NaCl溶液(调节起始pH约为9)获得NaClO溶液,可用于去除大气中NO。其他条件相同,电解所得溶液中相关成分的浓度与电流强度的关系如图所示。
①用电解所得NaClO溶液氧化NO生成和 , 其离子方程式为。
②电流强度大于4A,随着电流强度增大,电解所得溶液对NO去除率下降,其原因是。
28. 工业上纳米的制备过程是以为载体,用和水蒸气反应生成 , 再控制温度生成纳米 , 测定产物组成的方法如下:步骤一:取样品用稀硫酸充分溶解得到溶液,再用足量铝将还原为 , 过滤并洗涤,将所得滤液和洗涤液混合并注入容量瓶,定容得到待测液。
步骤二:取待测液于锥形瓶中,加入几滴指示剂,用的标准溶液滴定,将氧化为 , 三次滴定测得数据记录如下:
实验编号
待测溶液的体积/mL
滴定前标准液的体积读数/mL
滴定后标准液的体积读数/mL
1
25.00
0.20
24.22
2
25.00
1.21
29.21
3
25.00
150
25.48
回答下列问题:
(1)、若对步骤一所得的溶液加水稀释,溶液中会产生少量偏钛酸沉淀,写出该反应的离子方程式。(2)、上述滴定实验中,可选择为指示剂,判断到达滴定终点的方法是。(3)、下列关于滴定分析的操作,错误的是____。A、滴定时要适当控制滴定速率 B、用量筒量取待测液转移至锥形瓶 C、滴定时应一直观察滴定管中溶液体积的变化 D、平行滴定时,须重新装液并调节液面至“0”刻度或“0”刻度以下 E、在接近终点时,滴加药品应慢慢控制滴定管,使滴定管尖嘴悬挂一滴液体,用锥形瓶内壁将其靠下,并用蒸馏水将其冲入锥形瓶内。(4)、通过分析、计算,该样品的组成为;若滴定前滴定管尖端有气泡,滴定过程中气泡消失,则测得比实际值(填“偏大”、“偏小”或“无影响”)。29. 三氧化碳的回收及综合利用越来越受到国际社会的重视,将二氧化碳转化为高附加值化学品是目前研究的热点之一。利用和合成甲醇,在催化剂作用下可发生如下两个平行反应。反应I:
反应Ⅱ:
请回答:
(1)、有利于提高甲醇平衡产率的条件是____。A、低温低压 B、低温高压 C、高温低压 D、高温高压(2)、反应的(3)、我国科研人员研究了在催化剂上加氢制甲醇过程中水的作用机理,其主反应历程如图(),下列说法正确的是____。 A、使用更高效的催化剂能提高甲醇的平衡产率 B、第④步的反应式为 C、加氢制甲醇符合绿色化学理念 D、若实验前用少量水对催化剂进行预处理,可能提升甲醇产率(4)、在催化剂下,向恒容密闭容器充入一定量及 , 起始和平衡时各组分的量如下:
A、使用更高效的催化剂能提高甲醇的平衡产率 B、第④步的反应式为 C、加氢制甲醇符合绿色化学理念 D、若实验前用少量水对催化剂进行预处理,可能提升甲醇产率(4)、在催化剂下,向恒容密闭容器充入一定量及 , 起始和平衡时各组分的量如下:总压/
起始/
10
3.0
0
0
0
平衡/
p
若反应均达平衡时, , 则表中;若此时 , 则反应I的平衡常数(无需带单位,用含总压p的式子表示)。
(5)、一定比例的合成气在装有催化剂的反应器中反应 , 体系中甲醇的产率和催化剂的催化活性与温度的关系如下图所示,此温度范围内,催化剂活性不受影响
①当温度高于后,甲醇产率减小的原因可能是。
②请在图中画出甲醇平衡产率随温度变化的曲线图。