浙江省百校2023-2024学年高三上学期12月测试化学试卷
试卷更新日期:2024-01-08 类型:月考试卷
一、单选题
-
1. 含有非极性键的离子化合物是( )A、 B、 C、 D、KOH2. 下列物质属于非电解质的是( )A、氯化镁 B、二氧化碳 C、碳酸氢钠 D、福尔马林3. 下列仪器的名称不正确的是( )
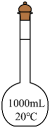

A容量瓶
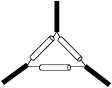
B三脚架
C坩埚钳
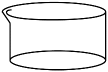
D结晶皿
A、A B、B C、C D、D4. 某些诗词中蕴含着丰富的化学知识,下列论述不正确的是( )A、“以曾青涂铁,铁赤色如铜”,涉及颜色变化和回收铜工艺 B、“东风扑酒香,吹醒殊乡愁”,涉及液体挥发并蕴涵酯化反应 C、“布衾(麻葛)多年冷似铁,娇儿恶卧踏里裂”,推测唐朝没有普及棉花种植 D、“五金(金银铜铁锡)元造化,九炼更精新”,自然界五金只能以化合态存在5. 化学与科学、社会、历史密切相关,下列叙述正确的是( )A、中国空间站核心舱有砷化镓半导体材料:位于周期表金属与非金属交界处 B、三星堆遗址出土大量铜器玉石,可通过断代法测玉石中含量来推测古蜀年代 C、明矾在一定条件下水解可生成胶体或浊液两种分散系,两种分散系互为同系物 D、螺环化合物(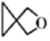 )可用于制造生物检测机器人,其二氯代物有4种(不考虑空间异构)
6. 下列说法不正确的是( )A、科学家在盐碱地培育出优质水稻,稻米中含有的淀粉、蛋白质和脂肪都是高分子化合物 B、酶是一类由生物细胞产生的蛋白质或核酸,酶对生物体内的化学反应具有高效催化作用 C、寡糖中的十糖()不能被人体直接消化吸收,十糖可以作为糖尿病患者的甜味剂 D、氨基酸分子间能形成肽键,肽键中的氧原子与氢原子之间的氢键可形成蛋白质二级结构7. 三水硫氰化亚铁可用作有机溶液中过氧化物的指示剂,其中S、C、N三原子没有形成大键。下列有关推断不正确的是( )A、电子式为
)可用于制造生物检测机器人,其二氯代物有4种(不考虑空间异构)
6. 下列说法不正确的是( )A、科学家在盐碱地培育出优质水稻,稻米中含有的淀粉、蛋白质和脂肪都是高分子化合物 B、酶是一类由生物细胞产生的蛋白质或核酸,酶对生物体内的化学反应具有高效催化作用 C、寡糖中的十糖()不能被人体直接消化吸收,十糖可以作为糖尿病患者的甜味剂 D、氨基酸分子间能形成肽键,肽键中的氧原子与氢原子之间的氢键可形成蛋白质二级结构7. 三水硫氰化亚铁可用作有机溶液中过氧化物的指示剂,其中S、C、N三原子没有形成大键。下列有关推断不正确的是( )A、电子式为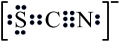 B、露置在空气中比更易氧化
C、配成溶液,加入过量过氧化氢,溶液最后显红色
D、还原性铁粉与HSCN溶液在隔绝空气条件下可制备硫氰化亚铁
8. 下列说法不正确的是( )A、二氧化硫、亚硫酸钠、苯甲酸钠都是食品中常用的脱氧剂 B、燕麦粉中添加微量、颗粒极细小铁粉,饮食后可暂时缓解缺铁性贫血 C、纯碱不仅是生产玻璃的原料,还可以去除玻璃表面的油污 D、硫酸钡不仅可以作白色颜料,还可用于医疗内服药剂“钡餐”9. 下列说法不正确的是( )A、工业上制备达98%的粗硅可直接用来生产卫星芯片 B、工业制备硫酸的主要设备为沸腾炉、接触室和吸收塔 C、硬度大的新型陶瓷材料碳化硅可用作砂纸的耐磨材料 D、某些胶态金属氧化物分散于玻璃中可制造有色玻璃10. 是HClO的酸性氧化物,具有强氧化性,加热易分解,可通过如下反应制取:。下列说法不正确的是( )A、还原产物是NaCl B、氧化剂与还原剂的物质的量之比为1:1 C、完全溶于水微热,会产生黄绿色气体 D、与还原剂接触或加热能发生剧烈反应,甚至爆炸11. 下列说法不正确的是( )A、某溶液焰色试验为黄色,说明溶液中肯定含钠元素,可能含钾元素 B、重铬酸钾溶液中滴入某液体,颜色由橙变绿,说明液体中肯定含乙醇,可能含乙醛 C、可用紫外可见分光光度法测定废水中苯酚的含量 D、浓硝酸可检测蛋白质分子中是否含苯环结构12. 为阿伏加德罗常数的值,下列说法正确的是( )A、的NaClO溶液含有的数目小于 B、78g苯含有双键数目为3 , 单键数目为9 C、标准状况下,5.6LNO和混合后分子总数为0.5 D、含溶液中阳离子数目为0.413. 下列有关离子方程式书写正确的是( )A、硫酸铵和硫酸铁混合液与过量NaOH溶液混合: B、碳酸氢钙溶液与氢氧化钙溶液混合: C、苯酚钠溶液中通入少量气体:2
B、露置在空气中比更易氧化
C、配成溶液,加入过量过氧化氢,溶液最后显红色
D、还原性铁粉与HSCN溶液在隔绝空气条件下可制备硫氰化亚铁
8. 下列说法不正确的是( )A、二氧化硫、亚硫酸钠、苯甲酸钠都是食品中常用的脱氧剂 B、燕麦粉中添加微量、颗粒极细小铁粉,饮食后可暂时缓解缺铁性贫血 C、纯碱不仅是生产玻璃的原料,还可以去除玻璃表面的油污 D、硫酸钡不仅可以作白色颜料,还可用于医疗内服药剂“钡餐”9. 下列说法不正确的是( )A、工业上制备达98%的粗硅可直接用来生产卫星芯片 B、工业制备硫酸的主要设备为沸腾炉、接触室和吸收塔 C、硬度大的新型陶瓷材料碳化硅可用作砂纸的耐磨材料 D、某些胶态金属氧化物分散于玻璃中可制造有色玻璃10. 是HClO的酸性氧化物,具有强氧化性,加热易分解,可通过如下反应制取:。下列说法不正确的是( )A、还原产物是NaCl B、氧化剂与还原剂的物质的量之比为1:1 C、完全溶于水微热,会产生黄绿色气体 D、与还原剂接触或加热能发生剧烈反应,甚至爆炸11. 下列说法不正确的是( )A、某溶液焰色试验为黄色,说明溶液中肯定含钠元素,可能含钾元素 B、重铬酸钾溶液中滴入某液体,颜色由橙变绿,说明液体中肯定含乙醇,可能含乙醛 C、可用紫外可见分光光度法测定废水中苯酚的含量 D、浓硝酸可检测蛋白质分子中是否含苯环结构12. 为阿伏加德罗常数的值,下列说法正确的是( )A、的NaClO溶液含有的数目小于 B、78g苯含有双键数目为3 , 单键数目为9 C、标准状况下,5.6LNO和混合后分子总数为0.5 D、含溶液中阳离子数目为0.413. 下列有关离子方程式书写正确的是( )A、硫酸铵和硫酸铁混合液与过量NaOH溶液混合: B、碳酸氢钙溶液与氢氧化钙溶液混合: C、苯酚钠溶液中通入少量气体:2 2
2 D、氯气通入70℃的浓氢氧化钠溶液中:
14. 下列说法正确的是( )A、卤代烃、饱和一元醇都可发生消去反应,得到不饱和有机烯烃 B、酚醛树脂是最早合成的高分子材料,它由苯酚和甲醛加聚而成 C、味精谷氨酸钠最早从海带中提取,现主要通过纤维素发酵法生产 D、向蛋白质溶液中分别加入饱和硫酸钠溶液和硝酸银溶液都有固体析出15. Sharpless教授和Meldal教授因“点击化学”“生物正交化学”研究获2022年诺贝尔化学奖。“点击化学”就是用简单的小分子与生物大分子进行合成。类似的分子结构修饰在药物设计与合成中应用广泛。布洛芬具有抗炎、镇痛、解热作用,但口服该药对胃、肠道有刺激性,结构修饰过程如图所示。下列说法不正确的是( )
D、氯气通入70℃的浓氢氧化钠溶液中:
14. 下列说法正确的是( )A、卤代烃、饱和一元醇都可发生消去反应,得到不饱和有机烯烃 B、酚醛树脂是最早合成的高分子材料,它由苯酚和甲醛加聚而成 C、味精谷氨酸钠最早从海带中提取,现主要通过纤维素发酵法生产 D、向蛋白质溶液中分别加入饱和硫酸钠溶液和硝酸银溶液都有固体析出15. Sharpless教授和Meldal教授因“点击化学”“生物正交化学”研究获2022年诺贝尔化学奖。“点击化学”就是用简单的小分子与生物大分子进行合成。类似的分子结构修饰在药物设计与合成中应用广泛。布洛芬具有抗炎、镇痛、解热作用,但口服该药对胃、肠道有刺激性,结构修饰过程如图所示。下列说法不正确的是( )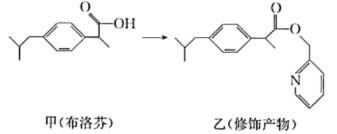 A、甲的分子式为 B、甲和乙都能与氢氧化钠溶液反应 C、甲分子中最多有8个碳原子共平面 D、乙可降低对胃、肠道的刺激16. X、Y、Z、W是原子序数依次增大的短周期元素,X的2p轨道有两个未成对电子,Y元素原子半径在同周期中最大,X与Y最外层电子数之和与Z的最外层电子数相等,在地壳的岩层中存在元素W的游离态。下列说法正确的是( )A、第一电离能: , 电负性: B、Y、W形成的化合物中只存在离子键 C、X、Z、W的单质形成的晶体类型相同,均为分子晶体 D、X、W形成的一种离子呈平面三角形,则中心原子价层电子对数为317. 空气污染物NO通常用含的溶液吸收,生成 , 再利用电解法将上述吸收液中的转化为无毒物质 , 同时生成 , 其电解原理如图所示。下列说法不正确的是( )
A、甲的分子式为 B、甲和乙都能与氢氧化钠溶液反应 C、甲分子中最多有8个碳原子共平面 D、乙可降低对胃、肠道的刺激16. X、Y、Z、W是原子序数依次增大的短周期元素,X的2p轨道有两个未成对电子,Y元素原子半径在同周期中最大,X与Y最外层电子数之和与Z的最外层电子数相等,在地壳的岩层中存在元素W的游离态。下列说法正确的是( )A、第一电离能: , 电负性: B、Y、W形成的化合物中只存在离子键 C、X、Z、W的单质形成的晶体类型相同,均为分子晶体 D、X、W形成的一种离子呈平面三角形,则中心原子价层电子对数为317. 空气污染物NO通常用含的溶液吸收,生成 , 再利用电解法将上述吸收液中的转化为无毒物质 , 同时生成 , 其电解原理如图所示。下列说法不正确的是( )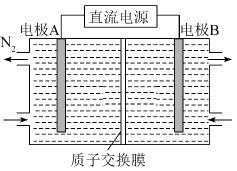 A、电极B为阳极,发生氧化反应 B、电极A上发生的电极反应: C、从电解槽右端上口流出,且可循环使用 D、若用阴离子交换膜代替质子交换膜,可提高电解效率,降低成本18. 乙烯在硫酸催化下制取乙醇的反应机理,能量与反应进程的关系如图所示。下列叙述正确的是( )
A、电极B为阳极,发生氧化反应 B、电极A上发生的电极反应: C、从电解槽右端上口流出,且可循环使用 D、若用阴离子交换膜代替质子交换膜,可提高电解效率,降低成本18. 乙烯在硫酸催化下制取乙醇的反应机理,能量与反应进程的关系如图所示。下列叙述正确的是( ) A、总反应速率由第①步反应决定 B、总反应 , 任何条件下反应都能自发进行 C、第②步反应过渡态物质比第③步反应过渡态物质稳定 D、第①步产生的乙基碳正离子两个碳都是杂化19. 某水溶液中存在、缓冲对。常温下,该水溶液中各缓冲对微粒浓度之比的对数值[G表示或]与溶液pH的变化关系如图所示(已知:常温下,的电离平衡常数为、 , 的电离平衡常数为 , , )。下列说法不正确的是( )
A、总反应速率由第①步反应决定 B、总反应 , 任何条件下反应都能自发进行 C、第②步反应过渡态物质比第③步反应过渡态物质稳定 D、第①步产生的乙基碳正离子两个碳都是杂化19. 某水溶液中存在、缓冲对。常温下,该水溶液中各缓冲对微粒浓度之比的对数值[G表示或]与溶液pH的变化关系如图所示(已知:常温下,的电离平衡常数为、 , 的电离平衡常数为 , , )。下列说法不正确的是( )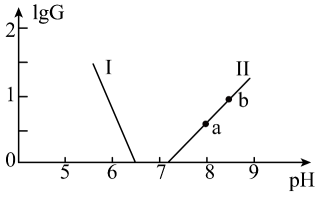 A、曲线Ⅰ表示与溶液pH的关系 B、的过程中,水的电离程度越来越大 C、当时, D、当溶液pH逐渐增大时,逐渐减小20. 某兴趣小组以牡蛎壳()为原料制备食品级添加剂丙酸钙 , 其工艺流程如下:
A、曲线Ⅰ表示与溶液pH的关系 B、的过程中,水的电离程度越来越大 C、当时, D、当溶液pH逐渐增大时,逐渐减小20. 某兴趣小组以牡蛎壳()为原料制备食品级添加剂丙酸钙 , 其工艺流程如下: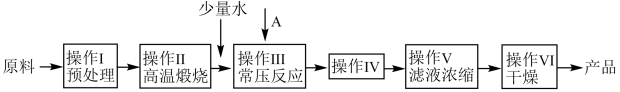
已知:丙酸有刺激性气味,沸点较低(141.1℃)。
下列叙述不正确的是( )
A、“操作Ⅱ”锻烧可以使用酒精灯加热,“操作Ⅲ”前加水目的是制取澄清石灰水 B、“操作Ⅳ”是常压过滤操作,该操作用到的玻璃仪器除漏斗外还有烧杯和玻璃棒 C、“操作Ⅴ”的滤液浓缩是在蒸发皿中进行,浓缩过程中可用玻璃棒搅拌滤液 D、“操作Ⅳ”产品干燥前要洗涤,洗涤剂为乙醇,当洗涤后滤液为中性时,说明杂质已洗净21. 甲胺()是合成太阳能敏化剂的原料。一定温度下,在三个体积均为2.0L的恒容密闭容器中按不同方式投入反应物,发生反应 , 测得有关实验数据如下:容器编号
温度/K
起始物质的量/mol
平衡物质的量/mol
Ⅰ
530
0.40
0.40
0
0
0.30
Ⅱ
530
0.80
0.80
0
0
Ⅲ
500
0
0
0.20
0.20
0.16
下列说法正确的是( )
A、正反应的平衡常数 B、达到平衡时,体系中关系: C、达到平衡时,转化率: D、向容器Ⅲ中加入高效催化剂,能增大反应活化能,提高反应转化率22. 标准状态下,下列物质气态时的相对能量如下表:物质(g)
O
H
HO
HOO
O2
H2O2
相对质量/()
249
218
39
10
0
0
-136
-242
可根据 HO(g)+HO(g)═H2O2(g) 计算出H2O2中氧氧单键的键能为214。下列说法不正确的是( )
A、H2的键能为436 B、的键能大于中氧氧单键的键能的两倍 C、解离氧氧单键所需能量: D、23. 翡翠手镯(如图)的主要成分是硬玉,硬玉化学式为 , 下列推测不合理的是( ) A、硬玉与氢氧化钠溶液反应生成、和 B、翡翠硬度大,熔点高,受到猛烈撞击不容易断裂或粉碎 C、碳酸钠与氧化铝、二氧化硅在高温熔融的条件下能制取硬玉 D、翡翠中含 , 高温分解翡翠,产物溶于氢碘酸加萃取,有机层呈紫红色24. 1774年,瑞典科学家舍勒在研究软锰矿时,意外发现黄绿色气体。二氯化锰在酸性介质中稳定,在碱性介质中易被氧化,高锰酸钾溶液见光或放置过久会分解。下列说法不正确的是( )A、向二氯化锰溶液中滴加NaOH溶液,产生白色沉淀,后迅速氧化为黑色的 B、硬锰矿的主要成分是 , 其与浓盐酸共热能产生黄绿色气体 C、高锰酸钾溶液要现用现配,并保存在棕色试剂瓶中 D、能氧化生成 , 可通过显色来检验溶液中是否存在大量 , 但样品中浓度要过量25. pH试纸上有甲基红、溴甲酚绿、百里酚蓝三种指示剂,实验室常用pH试纸检测物质的酸碱度(本实验使用的广泛pH试纸范围在1~14)。下列方案设计、现象和结论都正确的是( )
A、硬玉与氢氧化钠溶液反应生成、和 B、翡翠硬度大,熔点高,受到猛烈撞击不容易断裂或粉碎 C、碳酸钠与氧化铝、二氧化硅在高温熔融的条件下能制取硬玉 D、翡翠中含 , 高温分解翡翠,产物溶于氢碘酸加萃取,有机层呈紫红色24. 1774年,瑞典科学家舍勒在研究软锰矿时,意外发现黄绿色气体。二氯化锰在酸性介质中稳定,在碱性介质中易被氧化,高锰酸钾溶液见光或放置过久会分解。下列说法不正确的是( )A、向二氯化锰溶液中滴加NaOH溶液,产生白色沉淀,后迅速氧化为黑色的 B、硬锰矿的主要成分是 , 其与浓盐酸共热能产生黄绿色气体 C、高锰酸钾溶液要现用现配,并保存在棕色试剂瓶中 D、能氧化生成 , 可通过显色来检验溶液中是否存在大量 , 但样品中浓度要过量25. pH试纸上有甲基红、溴甲酚绿、百里酚蓝三种指示剂,实验室常用pH试纸检测物质的酸碱度(本实验使用的广泛pH试纸范围在1~14)。下列方案设计、现象和结论都正确的是( )选项
方案设计
现象和结论
A
将1~2mL水滴入1~2g过氧化钠固体的试管中,用pH试纸测定溶液的酸碱性强弱
pH试纸显蓝色,pH为12,说明有碱性物质产生,溶液无漂白性
B
把充满的试管倒立在含水的水槽中,一段时间后,取出试管,用pH试纸测定溶液的酸碱性强弱
pH试纸显红色,pH为2,说明有酸性物质产生,溶液无漂白性
C
收集某地雨水于锥形瓶中,每隔一段时间测定雨水样品的pH
测得雨水pH在5到6之间波动,说明该地区雨水为酸雨
D
用玻璃棒蘸取新制氯水,滴在pH试纸上
观察到试纸由里到外的颜色为白色、红色、黄色,说明产物显酸性且氯气具有漂白性
A、A B、B C、C D、D二、填空题
-
26. 自然资源部印发的《2021年全国地质勘查通报》显示,新发现矿产地95处,其中,铜矿2处,铅锌矿1处。查阅资料:Cu价层电子排布式为 , 在活化闪锌矿(主要成分为ZnS)方面有重要作用,主要是活化过程中生成CuS、等系列铜硫化物。(1)、的空间构型为(用文字描述);写出一种与互为等电子体的分子的化学式:。(2)、把铜粉放入装有浓氨水的试管中,塞紧试管塞,振荡后试管塞越来越紧,且溶液逐渐变为浅黄色(几乎呈无色),溶质主要为 , 打开试管塞后,溶液迅速变为蓝色 , 写出浅黄色物质生成蓝色物质的化学方程式:。(3)、试从价层结构方面解释为什么溶液近乎无色的原因:。(4)、在活化过程中,能转化为CuS的原因是;CuS比CuO熔点低的原因是。(5)、ZnS晶体结构如图所示,其晶胞边长为540.0pm,密度约为(列式并计算,精确到小数点后一位)
 27. 化合物X由三种元素组成,某实验小组按如下流程进行相关实验。
27. 化合物X由三种元素组成,某实验小组按如下流程进行相关实验。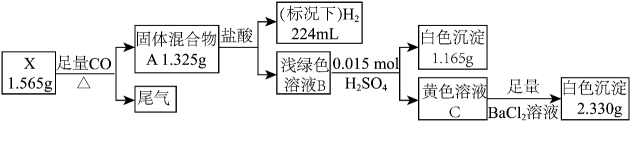 ;
;请回答:
(1)、组成X的三种元素为;X的化学式为。(2)、溶液B的溶质组成为(用化学式表示)。(3)、①写出由X转化为A的化学方程式:。②写出由B转化为C的离子方程式:。
(4)、设计简单实验,写出检验尾气中气体成分的方法:。28. 我国力争于2030年前完成碳达峰。2060年前实现碳中和,含碳化合物的合成与转化具有重要的研究价值和现实意义。(1)、Ⅰ.甲烷化反应是碳循环利用的重要路径之一。甲烷化主反应:。
副反应:a.;
b.;
c.。
副反应b所生成的CO也能发生甲烷化反应,则化学方程式为。(2)、催化剂的选择是甲烷化技术的核心。在两种不同催化剂条件下,反应时间相同测得转化率和生成选择性随温度变化的影响如下图所示。
提示:甲烷的选择性是指转化为甲烷的在全部反应物中所占的比例。
高于320℃后,以为催化剂转化率略有下降,而以Ni为催化剂转化率仍在上升,其原因是。
(3)、二氧化碳甲烷化反应在某催化剂催化下的反应机理如图所示。下列叙述不正确的是。
A.氢气在Pd表面被吸附解离成氢原子
B.MgO是反应的中间体
C.图中碳元素的价态有多种
D.浊液加热生成
(4)、Ⅱ.甲醚()是重要的化工原料,可用CO和制得,热化学方程式为;。
生产甲醚过程中存在副反应:。将反应物混合气按进料比通入反应装置,选择合适的催化剂。在不同温度和压强下,测得甲醚的选择性分别为如图1、图2所示。
图1中,温度一定,压强增大,甲醚选择性增大的原因是。 (5)、图2中,温度高于265℃后,甲醚选择性降低的原因是。(6)、向容积可变的密闭容器中充入mmolCO和在恒温恒压条件下发生反应: , 在图中画出CO的平衡转化率随温度、压强()的变化图。
(5)、图2中,温度高于265℃后,甲醚选择性降低的原因是。(6)、向容积可变的密闭容器中充入mmolCO和在恒温恒压条件下发生反应: , 在图中画出CO的平衡转化率随温度、压强()的变化图。 29. 亚硝酰氯(NOCl)是一种红褐色液体或黄色气体,熔点:-64.5℃,沸点:-5.5℃,遇水易水解。可用于合成清洁剂、触媒剂及中间体等。实验室可用下图装置由氯气与一氧化氮在常温常压下合成。
29. 亚硝酰氯(NOCl)是一种红褐色液体或黄色气体,熔点:-64.5℃,沸点:-5.5℃,遇水易水解。可用于合成清洁剂、触媒剂及中间体等。实验室可用下图装置由氯气与一氧化氮在常温常压下合成。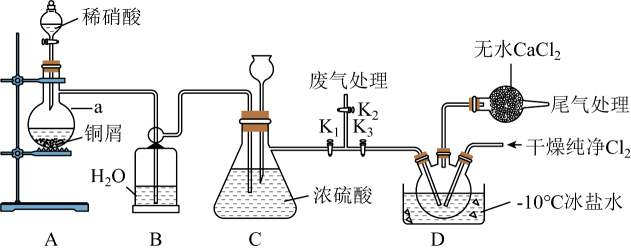
简要步骤如下:实验开始时,关闭 , 打开、 , 通入一段时间的氯气,直至三颈烧瓶中充满黄绿色气体,关闭 , 打开 , 打开分液漏斗塞子,向装置a中滴入适量稀硝酸。待装置C中某一现象发生时,关闭 , 打开 , 在三颈烧瓶中制备亚硝酰氯。
请回答:
(1)、写出铜与稀硝酸反应的离子方程式:。(2)、写出亚硝酰氯与NaOH溶液反应生成亚硝酸钠的化学方程式:。(3)、仪器a的名称是 , 装置B的作用是。(4)、步骤划线处,装置C出现的现象是。(5)、下列说法不正确的是____。A、从安全或避免环境污染方面考虑,宜在通风橱内进行实验 B、若不慎亚硝酰氯接触到皮肤,及时用流动清水反复冲洗 C、浓硫酸和无水仅起阻止水蒸气进入,避免亚硝酰氯水解的作用 D、冰盐水温度可达-10℃,装置D三颈烧瓶中充满黄色气体NOCl(6)、若制得的NOCl中含有少量杂质,为测定产品纯度进行如下实验:称取1.6625g样品溶于50.00mLNaOH溶液中,加入几滴溶液作指示剂,用足量硝酸酸化的溶液滴定至产生砖红色沉淀,消耗溶液50.00mL。则样品的纯度为%(保留1位小数)。30. 某研究小组按下列路线合成镇静催眠药扎来普隆。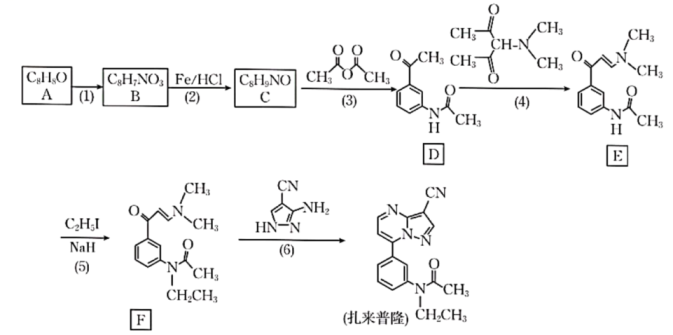
请回答:
(1)、下列说法不正确的是____。A、第(1)步中加入混酸试剂的顺序是浓硝酸、浓硫酸 B、化合物D中的含氧官能团是酮基和乙氧基 C、第(2)步反应类型是还原反应 D、1mol扎来普隆最多能消耗7mol氢气(2)、化合物A的结构简式是;扎来普隆的分子式是;化合物F生成扎来普隆的过程涉及多步反应,其反应类型有。(3)、写出E→F的化学方程式:。(4)、设计以苯和乙酸酐为原料合成止痛、退热药 的路线(用流程图表示,无机试剂任选):。 (5)、写出同时符合下列条件的化合物C的同分异构体的结构简式:。
的路线(用流程图表示,无机试剂任选):。 (5)、写出同时符合下列条件的化合物C的同分异构体的结构简式:。①谱和IR谱检测表明:分子结构苯环上只有2种不同化学环境的氢原子;
②分子中含有结构;
③能发生银镜反应。