广东省湛江市2023-2024学年高三上学期11月调研测试化学试题
试卷更新日期:2024-01-08 类型:月考试卷
一、选择题:本题共16小题,共44分.第1~10小题,每小题2分;第11~16小题,每小题4分.在每小题给出的四个选项中,只有一项是符合题目要求的.
-
1. 广东是岭南文化中心地、海上丝绸之路发祥地、中国近代民主革命策源地,拥有丰富的文化遗产资源.下列在广东发掘的珍贵文物中不是由硅酸盐材料制成的是( )
选项
A
B
C
D
文物




名称
台山红绿彩瓷片
南海Ⅰ号印花陶罐
博罗横岭山青铜鼎
五华狮雄山琉璃瓦当
A、A B、B C、C D、D2. 我国自主设计建造的亚洲第一深水导管架“海基一号”在广东珠海建造完工,开创了我国深海油气资源开发的新模式.下列有关说法正确的是( )A、“海基一号”成功从深海开采石油和天然气水合物,天然气属于新能源 B、深海开采勘察船采用的新型钛合金材料硬度大、韧性好,具有良好的抗压性能 C、石油的分馏和裂解都是化学变化 D、导管架海水浸泡区可采用镶嵌铜块的方法从而保障钢材不易被腐蚀3. 南粤大地,岭南风情.下列岭南文化内容中蕴含的化学知识叙述错误的是( )选项
A
B
C
D
文化类别
饮食文化
建筑文化
服饰文化
节日文化
文化内容
顺德姜汁撞奶(姜汁与牛奶混合使牛奶凝固)
珠海菉猗堂蚝壳墙
粤绣色彩富丽夺目,绣线种类繁多,独具匠心
揭阳烟花舞龙气势宏伟,景象壮观
化学知识
制作方法包含了胶体聚沉的原理
蚝壳的主要成分是
制作粤绣用的孔雀毛和马尾的主要成分都是纤维素
烟花利用了“焰色试验”原理,该变化属于物理变化
A、A B、B C、C D、D4. 下列实验操作正确的是( )A、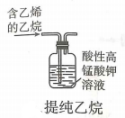 B、
B、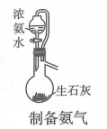 C、
C、 D、
D、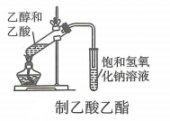 5. 下列化学用语或图示表达正确的是( )A、金刚石的晶体结构:
5. 下列化学用语或图示表达正确的是( )A、金刚石的晶体结构: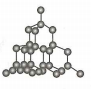 B、基态溴原子电子占据最高能级的电子云轮廓图:
B、基态溴原子电子占据最高能级的电子云轮廓图: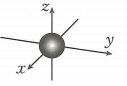 C、的空间填充模型:
C、的空间填充模型: D、的电子式:
D、的电子式: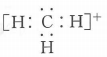 6. 海洋系统中氮循环的主要过程如图,图中虚线为缺氧条件,实线为富氧条件.已知大气中的能与臭氧发生反应,破坏臭氧层.下列叙述错误的是( )
6. 海洋系统中氮循环的主要过程如图,图中虚线为缺氧条件,实线为富氧条件.已知大气中的能与臭氧发生反应,破坏臭氧层.下列叙述错误的是( )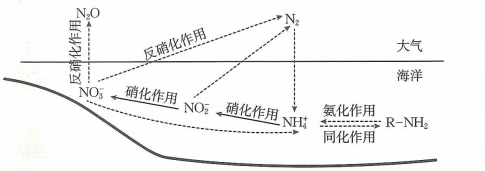 A、属于氮的固定 B、氨化作用中N元素化合价不变,反硝化作用中含氮物质被还原 C、海水富营养化可能促进向大气的释放,引起气候变化 D、在、、和中N原子的杂化方式相同7. 化学创造美好生活,下列实际应用与所述化学知识没有关联的是( )
A、属于氮的固定 B、氨化作用中N元素化合价不变,反硝化作用中含氮物质被还原 C、海水富营养化可能促进向大气的释放,引起气候变化 D、在、、和中N原子的杂化方式相同7. 化学创造美好生活,下列实际应用与所述化学知识没有关联的是( )选项
实际应用
化学知识
A
用食醋除去水壶中的水垢
乙酸能发生酯化反应
B
采用“石灰法”富集海水中的
C
清代釉里红瓷器釉下花纹呈暗红色
铜矿中的铜元素高温烧结生成
D
葡萄酒酿制过程中添加适量的二氧化硫
具有还原性
A、A B、B C、C D、D8. 某实验小组用如图装置制备氯气并探究其性质(夹持装置已省略),下列分析错误的是( )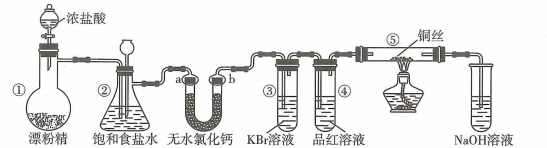 A、装置①中生成氯气反应的化学方程式: B、a、b分别放干燥和湿润的有色布条,可以验证干燥的不具有漂白性 C、反应开始后可观察到③中溶液变黄,④中溶液褪色,说明氯水具有氧化性和漂白性 D、反应开始后点燃酒精灯,可在⑤号硬质玻璃管中观察到棕黄色烟9. 布洛芬、对乙酰氨基酚都具有解热镇痛的作用,其结构简式如图.下列说法错误的是( )
A、装置①中生成氯气反应的化学方程式: B、a、b分别放干燥和湿润的有色布条,可以验证干燥的不具有漂白性 C、反应开始后可观察到③中溶液变黄,④中溶液褪色,说明氯水具有氧化性和漂白性 D、反应开始后点燃酒精灯,可在⑤号硬质玻璃管中观察到棕黄色烟9. 布洛芬、对乙酰氨基酚都具有解热镇痛的作用,其结构简式如图.下列说法错误的是( )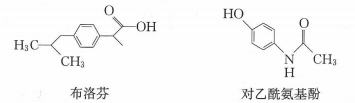 A、布洛芬可以发生加成反应、取代反应、氧化反应 B、布洛芬分子中最多有10个碳原子位于同一平面 C、1 mol对乙酰氨基酚与足量溶液反应,最多消耗 D、1mol对乙酰氨基酚分子中含有的键数目为10. 下列反应的离子方程式正确的是( )A、向中滴加少量溶液: B、向有沉淀的溶液中滴加氨水,沉淀消失: C、向溶液中通入一定量氯气,测得有的被氧化: D、的水解:11. 钛酸钡是太阳能电池材料.经X射线衍射分析测定,钛酸钡的晶胞结构如图所示(、均与接触),已知晶胞边长为 , 的半径为 , 为阿伏加德罗常数的值.下列叙述错误的是( )
A、布洛芬可以发生加成反应、取代反应、氧化反应 B、布洛芬分子中最多有10个碳原子位于同一平面 C、1 mol对乙酰氨基酚与足量溶液反应,最多消耗 D、1mol对乙酰氨基酚分子中含有的键数目为10. 下列反应的离子方程式正确的是( )A、向中滴加少量溶液: B、向有沉淀的溶液中滴加氨水,沉淀消失: C、向溶液中通入一定量氯气,测得有的被氧化: D、的水解:11. 钛酸钡是太阳能电池材料.经X射线衍射分析测定,钛酸钡的晶胞结构如图所示(、均与接触),已知晶胞边长为 , 的半径为 , 为阿伏加德罗常数的值.下列叙述错误的是( )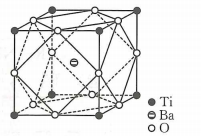 A、与等距离且最近的有8个 B、的半径为 C、钛酸钡的化学式为 D、钛酸钡的密度12. 2022年12月,首架国产大飞机C919正式交付,国之重器,世界瞩目.铼(Re)是生产飞机发动机叶片必不可少的材料.X、Y、Z、Q、W是原子序数依次增大且位于不同主族的短周期元素,其中X、Y、Z三种元素可与铼元素组成一种化合物(结构如图),该化合物与X的单质反应可得到铼.Q是地壳中含量最丰富的金属元素,Z与W形成的化合物为共价晶体.下列说法正确的是( )
A、与等距离且最近的有8个 B、的半径为 C、钛酸钡的化学式为 D、钛酸钡的密度12. 2022年12月,首架国产大飞机C919正式交付,国之重器,世界瞩目.铼(Re)是生产飞机发动机叶片必不可少的材料.X、Y、Z、Q、W是原子序数依次增大且位于不同主族的短周期元素,其中X、Y、Z三种元素可与铼元素组成一种化合物(结构如图),该化合物与X的单质反应可得到铼.Q是地壳中含量最丰富的金属元素,Z与W形成的化合物为共价晶体.下列说法正确的是( )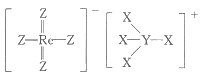 A、元素第一电离能: B、图中的阳离子存在三个共价键和一个配位键,四个键的性质不同 C、熔点:W晶体大于W、Y形成的晶体 D、Q的最高价氧化物对应水化物可以和强碱反应13. 根据下列实验操作及现象,不能推出相应结论的是( )
A、元素第一电离能: B、图中的阳离子存在三个共价键和一个配位键,四个键的性质不同 C、熔点:W晶体大于W、Y形成的晶体 D、Q的最高价氧化物对应水化物可以和强碱反应13. 根据下列实验操作及现象,不能推出相应结论的是( )选项
实验操作
现象
结论
A
向溶液中加入Cu片
溶液变蓝
的氧化性强于
B
取溶液于试管中,加热,后置于冷水中
加热后溶液变为黄绿色,冷却后变为蓝色
反应的
C
缓慢加热溶液至70℃
pH逐渐减小
溶液中逐渐增大,逐渐减小
D
恒温条件下,向两个锥形瓶中加入0.05g、表面积相同的镁条并塞紧瓶塞,然后用注射器分别注入的盐酸和醋酸,测量锥形 瓶内气体压强随时间变化
反应结束时,两个锥形瓶内的气体的压强基本相等
过量的镁分别与体积相同、物质的量浓度相同的盐酸和醋酸反应时,生成的氢气体积相同
A、A B、B C、C D、D14. 我国科学家团队打通了温和条件下草酸二甲酯催化加氢制乙二醇的技术难关,反应为.如图所示,在恒容密闭容器中,反应温度为时,和随时间的变化分别为曲线Ⅰ和Ⅱ,反应温度为时,随时间的变化为曲线Ⅲ.下列判断正确的是( )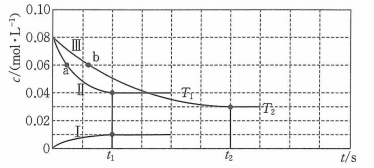 A、 B、a、b两时刻生成乙二醇的速率: C、在温度下,反应在内的平均速率为 D、其他条件相同,在温度下,起始时向该容器中充入一定量的氮气,则反应达到平衡的时间小于15. 电位滴定法是根据滴定过程中指示电极电位的变化来确定滴定终点的一种滴定分析方法.在化学计量点附近,被测离子浓度发生突跃,指示电极电位也产生了突跃,进而确定滴定终点.常温下,利用盐酸滴定某溶液中碳酸钠的含量,其电位滴定曲线与pH曲线如图所示(已知碳酸的电离常数 , ).下列说法正确的是( )
A、 B、a、b两时刻生成乙二醇的速率: C、在温度下,反应在内的平均速率为 D、其他条件相同,在温度下,起始时向该容器中充入一定量的氮气,则反应达到平衡的时间小于15. 电位滴定法是根据滴定过程中指示电极电位的变化来确定滴定终点的一种滴定分析方法.在化学计量点附近,被测离子浓度发生突跃,指示电极电位也产生了突跃,进而确定滴定终点.常温下,利用盐酸滴定某溶液中碳酸钠的含量,其电位滴定曲线与pH曲线如图所示(已知碳酸的电离常数 , ).下列说法正确的是( )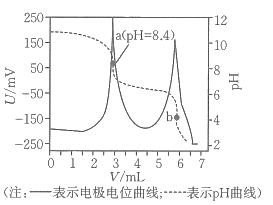 A、该滴定过程需要两种指示剂 B、a点溶液中存在: C、水的电离程度:a点<b点 D、a点溶液中16. 氢负离子具有强还原性,是一种颇具潜力的能量载体.2023年4月5日,我国科学家开发了首例室温全固态氢负离子二次电池,该电池通过固态氢负离子导体实现对的快速传导,其工作原理如图所示,其中放电时乙电极的电极反应式为(M为Li、Na、K、Mg、Ti等金属),下列说法错误的是( )
A、该滴定过程需要两种指示剂 B、a点溶液中存在: C、水的电离程度:a点<b点 D、a点溶液中16. 氢负离子具有强还原性,是一种颇具潜力的能量载体.2023年4月5日,我国科学家开发了首例室温全固态氢负离子二次电池,该电池通过固态氢负离子导体实现对的快速传导,其工作原理如图所示,其中放电时乙电极的电极反应式为(M为Li、Na、K、Mg、Ti等金属),下列说法错误的是( )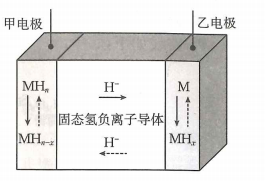 A、放电时,电子经外电路流向甲电极 B、放电时,氢负离子移向乙电极 C、充电时,甲电极发生的反应可表示为 D、可将固态离子导体替换成水溶液电解质,对氢负离子进行传导
A、放电时,电子经外电路流向甲电极 B、放电时,氢负离子移向乙电极 C、充电时,甲电极发生的反应可表示为 D、可将固态离子导体替换成水溶液电解质,对氢负离子进行传导二、非选择题:本题共4小题,共56分.
-
17. 实验题.(1)、Ⅰ.配制溶液.
该实验需要用到的玻璃仪器有:烧杯、量筒、玻璃棒、、.(2)、为了防止水解,在配置过程中可以加入少量.(3)、Ⅱ.探究与Cu的反应.原理预测:
请写出与Cu的反应的离子方程式:.
(4)、开展实验并观察现象:某实验小组在进行与Cu的反应时观察到了异常现象,决定对其进行进一步的探究.
实验Ⅰ:

提出问题:
实验前,小组同学预测步骤2后溶液不会变为红色,原因是.
查阅文献:i.CuSCN为难溶于水的白色固体;
ii.被称为拟卤素离子,性质与卤素离子相似.
提出猜想:经过实验测定白色固体为CuSCN,查阅资料后小组同学猜测CuSCN的生成有如下两种可能.
猜测1:与KSCN发生了氧化还原反应.
猜测2:亚铁离子将其还原 , .
(5)、猜测1的离子方程式为.设计实验:
实验序号
对比实验及试剂
实验步骤
实验现象
II
A试管溶液
加入KSCN溶液
开始时溶液的上方变为红色,一段时间后红色向下蔓延,最后充满整支试管
B试管溶液
加入KSCN溶液
溶液变成绿色
II
C试管溶液
加入 , 溶液
溶液变为淡蓝色
再加KSCN溶液
溶液的上层变为红色,有白色沉淀产生,一段时间后整支试管溶液呈深红色
得出结论:
(6)、实验Ⅱ中试管(填字母)中的现象可以证实猜测1不成立.(7)、的氧化性本应强于 , 结合实验Ⅲ中的现象解释能正向发生的原因:.18. 钕铁硼废料是一种具有较高经济价值的废弃物,主要成分为稀土元素钕(Nd)、Fe、B.一种采用分步沉淀从钕铁硼油泥中回收和的工艺流程如图:
已知:①200℃下氧化焙烧,钕铁硼废料中钕和铁主要以和的形式存在,硼常温下稳定,加热至300℃被氧化,不与稀酸反应.
②易与形成多种配合物离子,易与形成沉淀.
回答下列问题:
(1)、“预处理”是洗去钕铁硼表面的油污,可选择(填化学式)溶液.(2)、“滤渣1”的主要成分是(填名称).“浸出”时,盐酸浓度和固液比对钕、铁的浸出率影响如图所示,则浸出过程的最佳条件是. (3)、写出“沉钕”时生成沉淀的离子方程式:.(4)、“沉铁”时,加入铁粉的作用是.(5)、晶体结构片段如图所示.其中,的配位数为;碳原子采用杂化.现测定草酸亚铁晶体纯度.准确称取样品于锥形瓶,加入适量的稀硫酸,用溶液滴定至终点,消耗溶液.滴定反应:(未配平).该样品纯度为%.
(3)、写出“沉钕”时生成沉淀的离子方程式:.(4)、“沉铁”时,加入铁粉的作用是.(5)、晶体结构片段如图所示.其中,的配位数为;碳原子采用杂化.现测定草酸亚铁晶体纯度.准确称取样品于锥形瓶,加入适量的稀硫酸,用溶液滴定至终点,消耗溶液.滴定反应:(未配平).该样品纯度为%. 19. 2023年5月,中国神舟十六号载人飞船成功发射,三位航天员景海鹏、朱杨柱、桂海潮在天宫空间站开启长达半年的太空生活.(1)、法国化学家Paul Sabatier 提出并命名的“Sabatier反应”实现了甲烷化,科技人员基于该反应设计如图过程完成空间站中与的循环,从而实现的再生.
19. 2023年5月,中国神舟十六号载人飞船成功发射,三位航天员景海鹏、朱杨柱、桂海潮在天宫空间站开启长达半年的太空生活.(1)、法国化学家Paul Sabatier 提出并命名的“Sabatier反应”实现了甲烷化,科技人员基于该反应设计如图过程完成空间站中与的循环,从而实现的再生.
①写出与具有相同空间结构的一种微粒:.
②在特定温度下,由稳定态单质生成1mol化合物的焓变叫做该物质在此温度下的标准摩尔生成焓.表中为几种物质在298K的标准生成焓.
物质
标准摩尔生成焓
-393.51
-74.85
-241.82
0
则Sabatier反应.
③下列有关Sabatier反应说法正确的是.
A.输送进入Sabatier反应器的是电解水装置的阴极产物
B.采用高压和合适催化剂均有利于提高Sabatier反应的转化率
C.恒温条件下,在刚性容器中发生Sabatier反应,气体密度不变时,说明反应达到平衡
D.应该在Sabatier反应器的前端维持较高温度,后端维持较低温度
④一定条件下,分解形成碳的反应历程如图1所示,其中决定反应速率的是第步反应.

图1 图2
(2)、航天员呼吸产生的还可以利用Bosch反应:代替Sabatier反应.在250℃时,向体积为2L恒容密闭容器中通入和发生Bosch反应,测得容器内气压变化如图2所示.①试解释容器内气压先增大后减小的原因:.
②该温度下Bosch反应的(写出计算过程,为用气体的分压表示的平衡常数,分压=气体的体积分数×体系总压).
③在图2基础上画出其他条件相同,向体系加入催化剂时其压强随时间的变化曲线.
20. 基于生物质资源开发常见的化工原料,是绿色化学的重要研究方向.利用木质纤维素为起始原料结合生产聚碳酸对二甲苯酯可以实现碳减排,缓解日益紧张的能源危机,路线如下: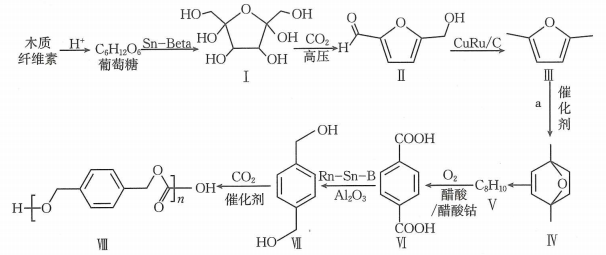
回答下列问题:
(1)、化合物Ⅰ的分子式为.(2)、分析化合物Ⅱ的结构,预测反应后形成的新物质,参考①的示例,完成下表.序号
变化的官能团的名称
可反应的试剂(物质)
反应后形成的新物质
反应类型
①

氧化反应
②
加成反应
(3)、化合物Ⅲ到化合物Ⅳ的反应是原子利用率100%的反应,且1molⅢ与1mol化合物a反应得到1mol Ⅳ,则化合物a为.(4)、已知化合物Ⅴ的核磁共振氢谱有2组峰,且峰面积之比为2:3,写出化合物Ⅴ的结构简式:.(5)、化合物Ⅶ的芳香族同分异构体中符合下列条件的有种(不含立体异构).①最多能与相同物质的量的反应;
②能与2倍物质的量的Na发生放出的反应.
(6)、关于Ⅶ生成Ⅷ的反应的说法中,不正确的有____.A、反应过程中,有H-O键断裂 B、反应过程中,有双键和C-O单键形成 C、该反应为缩聚反应 D、属于极性分子,分子中存在由p轨道“肩并肩”形成的键(7)、参照上述信息,写出以丙烯为起始有机原料合成 的路线(无机试剂任选).
的路线(无机试剂任选).