人教版高中化学2023-2024学年选择性必修一期末模拟试卷(三)
试卷更新日期:2024-01-04 类型:期末考试
一、选择题
-
1. 反应X+Y=M+N的能量变化关系如图所示。下列关于该反应的说法中,正确的是
 A、X的能量一定低于M的,Y的能量一定低于N的 B、X、Y的总能量一定低于M、N的总能量 C、因为该反应为吸热反应,故一定要加热才可发生 D、断裂X、Y的化学键所吸收的能量小于形成M、N的化学键所放出的能量2. 由下列键能数据大小,不能得出的事实是
A、X的能量一定低于M的,Y的能量一定低于N的 B、X、Y的总能量一定低于M、N的总能量 C、因为该反应为吸热反应,故一定要加热才可发生 D、断裂X、Y的化学键所吸收的能量小于形成M、N的化学键所放出的能量2. 由下列键能数据大小,不能得出的事实是化学键
O-H
H-H
O-O
键能kJ·mol-1
463
436
498.3
A、1molH2和molO2总能量大于1molH2O总能量 B、断开1molH2中的化学键所吸收的能量是436kJ C、H2(g)+O2(g)=H2O(g) ΔH=−240.85kJ·mol-1 D、生成1molH2O的化学键所放出热量是463kJ3. 在2A(g)+B(g)=3C(g)+4D(g)反应中,表示该反应速率最快的是A、v(A)=0.5mol/(L·s) B、v(B)=0.3mol/(L·s) C、v(C)=0.8mol/(L·s) D、v(D)=1.0mol/(L·s)4. 在一定条件下,反应 达到平衡后,改变条件,正、逆反应速率随时间的变化如图,下列说法正确的是 A、图①改变的条件是升高温度,达到新平衡后的转化率减小 B、图②改变的条件可能是增大的浓度,达到新平衡后的转化率增大 C、图③改变的条件可能是减小的浓度,达到新平衡后的转化率减小 D、图④改变的条件是增大压强,达到新平衡后的转化率不变5. 在硫酸工业中,在催化剂条件下使氧化为: 。下表列出了在不同温度和压强下,反应达到平衡时的转化率。下列说法正确的是
A、图①改变的条件是升高温度,达到新平衡后的转化率减小 B、图②改变的条件可能是增大的浓度,达到新平衡后的转化率增大 C、图③改变的条件可能是减小的浓度,达到新平衡后的转化率减小 D、图④改变的条件是增大压强,达到新平衡后的转化率不变5. 在硫酸工业中,在催化剂条件下使氧化为: 。下表列出了在不同温度和压强下,反应达到平衡时的转化率。下列说法正确的是温度
衡时的转化率
450
97.5
98.9
99.2
99.6
99.7
550
85.6
92.9
94.9
97.7
98.3
A、该反应在任何条件下均能自发进行 B、实际生产中,最适宜的条件是温度450℃、压强 C、使用催化剂可加快反应速率,提高的平衡产率 D、为提高的转化率,应适当充入过量的空气6. 工业合成氨是人类科学技术的一项重大突破。其合成原理为: , 下列说法错误的是A、增大压强,活化分子百分含量不变,单位体积内活化分子增多,反应速率加快 B、该反应在低温下能自发进行 C、为了防止混有的杂质使催化剂“中毒”,原料气必须经过净化 D、能用勒夏特列原理解释通常采用500℃有利于氨的合成7. 用蒸馏水逐渐稀释的醋酸,若维持温度不变,则在稀释过程中逐渐增大的是A、的物质的量浓度 B、的物质的量浓度 C、H+的物质的量浓度 D、和H+的物质的量8. 用一定浓度的盐酸标准溶液滴定未知浓度的NaOH溶液,下列有关说法正确的是A、若选用酚酞作指示剂,滴定终点的颜色变化为无色变为浅红色 B、锥形瓶应用待装NaOH溶液润洗 C、碱式滴定管滴定前尖嘴有气泡,滴定后气泡消失,测得的NaOH浓度偏大 D、酸式滴定管读数时滴定前仰视,滴定后俯视,测得的NaOH浓度偏小9. 已知25℃时,;。下列“类比”结果正确的是A、溶液中与会发生双水解反应,与主要也发生双水解反应 B、水解生成与 , 则水解同样生成 C、的浓度用硝酸银溶液滴定时,可选择作指示剂,同样也可以 D、乙醇与足量的反应被氧化成乙酸,异丙醇被氧化成丙酸10. 根据下列实验操作和现象所得到的结论正确的是选项
实验操作和现象
结论
A
室温下,将BaSO4投入饱和Na2CO3溶液中充分反应,向过滤后所得固体中加入足量盐酸,固体部分溶解,有无色无味气体产生
B
向2.0 mL浓度均为0.1 mol/LNaCl和NaI的混合溶液中滴加2滴0.1 mol/L AgNO3溶液,振荡,沉淀呈黄色
C
向10 mL0.2 mol/LNaOH溶液中滴入2滴0.1 mol/LMgCl2溶液,产生白色沉淀后,再滴加2滴0.1 mol/L FeCl3溶液,有红褐色沉淀生成
D
在2 mL0.01 mol/LNa2S溶液中先滴入几滴0.01 mol/L ZnSO4溶液,有白色沉淀生成,再滴入0.01 mol/L CuSO4溶液,又出现黑色沉淀
A、A B、B C、C D、D11. 20世纪初,德国化学家哈伯首次用锇作催化剂在、550℃的条件下以和为原料合成了: 。2021年11月,我国报道了新的合成氨催化剂设计策略,该技术可实现温和条件下的氨催化合成。一种电化学气敏传感器可以检测生产中氨气的含量,其工作原理如图所示。下列说法正确的是 A、溶液中向电极a移动 B、电极a的电极反应式为 C、在传感器工作一定时间后中电极b周围溶液pH减小 D、当电极b消耗标准状况下时,理论上电极a检测到12. 游泳池水普遍存在尿素超标现象,一种电化学除游泳池中尿素的实验装置如下图所示,其中钌钛用作析氯电极,不参与电解。除尿素的反应为: , 下列说法正确的是( )
A、溶液中向电极a移动 B、电极a的电极反应式为 C、在传感器工作一定时间后中电极b周围溶液pH减小 D、当电极b消耗标准状况下时,理论上电极a检测到12. 游泳池水普遍存在尿素超标现象,一种电化学除游泳池中尿素的实验装置如下图所示,其中钌钛用作析氯电极,不参与电解。除尿素的反应为: , 下列说法正确的是( ) A、电解过程中不锈钢电极会缓慢发生腐蚀 B、电解过程中钌钛电极上发生反应为 C、电解过程中不锈钢电极附近 增大 D、电解过程中每逸出 , 电路中至少通过 电子13. 化学小组研究金属的电化学腐蚀,实验如下:
A、电解过程中不锈钢电极会缓慢发生腐蚀 B、电解过程中钌钛电极上发生反应为 C、电解过程中不锈钢电极附近 增大 D、电解过程中每逸出 , 电路中至少通过 电子13. 化学小组研究金属的电化学腐蚀,实验如下:序号
实验Ⅰ
实验Ⅱ
实验


现象
铁钉周边出现____色
锌片周边未见明显变化
铁钉周边出现蓝色
铜片周边略显红色
下列说法错误的是
A、实验Ⅰ中铁钉周边出现红色 B、实验I中负极的电极反应式: C、实验Ⅱ中正极的电极反应式: D、对比实验I、Ⅱ可知,生活中镀锌铁板比镀铜铁板在镀层破损后更耐腐蚀14. 硫及其化合物之间的转化在生产中有着重要作用。接触法制硫酸中,制取的反应为 。反应在有、无催化剂条件下的能量变化如图所示。下列说法正确的是 A、催化时,该反应的速率取决于步骤① B、使用作催化剂同时降低了正、逆反应的活化能 C、其他条件相同,增大 , 的转化率下降 D、15. 常温下,用溶液滴定溶液所得滴定曲线如图。下列说法正确的是
A、催化时,该反应的速率取决于步骤① B、使用作催化剂同时降低了正、逆反应的活化能 C、其他条件相同,增大 , 的转化率下降 D、15. 常温下,用溶液滴定溶液所得滴定曲线如图。下列说法正确的是 A、该滴定实验中,选择甲基橙作指示剂的滴定误差小 B、点①所示溶液中: C、点②所示溶液中: D、点③所示溶液中:16. 催化加氢合成甲醇是重要的碳捕获利用与封存技术。催化加氢主要反应有:
A、该滴定实验中,选择甲基橙作指示剂的滴定误差小 B、点①所示溶液中: C、点②所示溶液中: D、点③所示溶液中:16. 催化加氢合成甲醇是重要的碳捕获利用与封存技术。催化加氢主要反应有:反应I.
反应II.
压强分别为、时,将的混合气体置于密闭容器中反应,不同温度下体系中的平衡转化率和、CO的选择性如图所示。
(或CO)的选择性

下列说法正确的是
A、反应为吸热反应 B、曲线③、④表示CO的选择性,且 C、相同温度下,反应I、II的平衡常数 D、一定温度下,调整 , 可提高的平衡转化率二、非选择题
-
17. 将煤转化为水煤气是通过化学方法将煤转化为洁净燃料的方法之一。煤转化为水煤气的主要化学反应为:C+H2OCO+H2。 C(s)、CO(g)和H2(g)完全燃烧的热化学方程式分别为:
C(s)+O2(g)=CO2(g) △H1=-393.5 kJ·mol-1①
H2(g)+O2(g)=H2O(g) △H2=-242.0kJ·mol-1②
CO(g)+O2(g)=CO2(g) △H3=-283.0kJ·mol-1③
(1)、请你根据以上反应,写出C(s)与水蒸气反应生成CO和H2的热化学方程式:。(2)、比较反应热数据可知,1molCO(g)和1molH2(g)完全燃烧放出的热量之和比1mol C(s)完全燃烧放出的热量(填“多”或“少”)。甲同学据此认为:“煤炭燃烧时加少量水,可以使煤炭燃烧放出更多的热量。”乙同学根据盖斯定律作出了下列循环图:

请你写出△H1、△H2、△H3、△H4之间存在的关系式:。
乙同学据此认为:“将煤转化为水煤气再燃烧放出的热量,最多与直接燃烧煤放出的热量相同。”请分析:甲、乙两同学观点正确的是(填“甲”或“乙”)同学,另一同学出现不正确观点的原因是。
18. 探究化学反应的快慢和限度具有十分重要的意义。(1)、Ⅰ.某实验小组欲通过用酸性和(草酸)反应测定单位时间内生成的体积,探究影响反应速率的因素。设计的实验方案如下(溶液已酸化),实验装置如图甲所示:
实验序号
A溶液
B溶液
①
20 mL 0.01 mol·L 溶液
30 mL 0.01 mol·L 溶液
②
20 mL 0.01 mol·L 溶液
30 mL 0.01 mol·L 溶液
完成上述反应的离子方程式为: , 该实验是探究对反应速率的影响。
(2)、若实验①在2 min末收集了4.48 mL (标准状况下,则在2 min末mol/L(假设混合溶液的体积为50 mL,反应前后体积变化忽略不计)。(3)、小组同学发现反应速率变化如图乙,其中时间内速率变快的主要原因可能是①该反应是放热反应:②。 (4)、Ⅱ.溶液中存在平衡:(橙色)(黄色)。该溶液具有强氧化性。其还原产物在水溶液中呈绿色或蓝绿色。用溶液进行下列实验:
(4)、Ⅱ.溶液中存在平衡:(橙色)(黄色)。该溶液具有强氧化性。其还原产物在水溶液中呈绿色或蓝绿色。用溶液进行下列实验: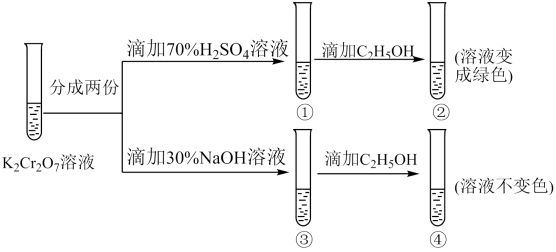
向溶液中加入30%NaOH溶液。溶液呈色:向溶液中逐滴加入溶液(已知为黄色沉淀),则平衡向着方向移动,溶液颜色变化为。
19. 铅酸蓄电池(如图)的电压稳定、使用方便、安全可靠、价格低廉而使用广泛。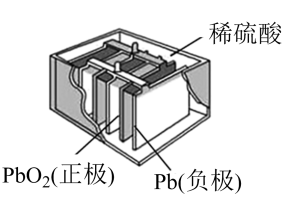 (1)、I.写出电池使用过程中的两个电极反应方程式:
(1)、I.写出电池使用过程中的两个电极反应方程式:负极;正极。
(2)、II.使用后的废旧铅酸蓄电池需要回收,废旧电池的铅膏中主要含有、、PbO和Pb,还有少量、以及Fe、Al的盐或氧化物等,通过如图流程回收铅。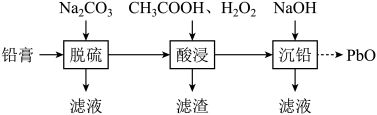
一些难溶电解质的溶度积常数如下表:
难溶电解质
一定条件下,一些金属氢氧化物沉淀时的pH如下表:
金属氢氧化物
开始沉淀的pH
2.3
6.8
3.5
7.2
完全沉淀的pH
3.2
8.3
4.6
9.1
回答下列问题:
在“脱硫”中转化反应的离子方程式为;饱和溶液中。
(3)、在“脱硫”中,加入不能使铅膏中完全转化,原因是。(4)、在“酸浸”中,除加入醋酸(),还要加入。①能被氧化的离子是;
②促进了金属Pb在醋酸中转化为 , 其化学方程式为。
③也能使转化为 , 的作用是。
(5)、“酸浸”后溶液的pH应控制在(填范围),滤渣的主要成分是(填化学式)。20. 电解食盐水可以制备烧碱、次氯酸钠消毒液等。(1)、【用途一】制备烧碱离子交换膜法电解饱和食盐水原理示意图如图1。

①气体a的电子式为:。
②结合电极反应式解释阴极区得到溶液的原因。
(2)、【用途二】制备次氯酸钠溶液采用无隔膜电解槽,电解3%~5%的溶液,可制备溶液。控制较低温度,适宜电压电解制备溶液原理示意图如图2。

已知:与次氯酸盐相比,次氯酸具有更强的氧化性。
电解食盐水制备溶液总反应的化学方程式为。
(3)、研究发现,电解制备溶液时,中性溶液为宜,若初始过高()或过低()都会降低的浓度。分析可能原因:①过高,阳极会发生放电,导致电解效率降低,电极反应为。
②过低,产生影响的可能原因:
假设过低时,导致溶解度 , 生成的减少。
假设过低时,浓度增大氧化 , 生成和。
I.查阅文献,假设b成立。相应反应的离子方程式为。
Ⅱ.若通过检测反应前后溶液酸性的变化证实假设b成立,实验操作和现象为:取溶液,。可供选择的试剂和仪器:a.稀硫酸| b.稀盐酸| c.石蕊溶液 d.计