浙江省宁波市海曙区2023-2024学年九年级上册科学10月月考试卷
试卷更新日期:2024-01-04 类型:月考试卷
一、选择题(本大题共15小题,第1-10题每小题4分,第11-15题每小题3分,共55分。请选出每小题中一个符合题意的选项,不选、错选、多选均不给分。
-
1. 对下列用品的有效成分、分类及其用途所对应的表述中,有错误的是( )
A
B
C
D
用品

食品添切剂
碳酸氢钠


氨水

熟石灰
有效成分
NaHCO3
CH3COOH
NH3。H2O
Ca(OH)2
有效成分分类
盐
氧化物
碱
碱
用途
用于面粉发酵
用作调味剂
用作化学肥料等
粉刷墙壁等
A、A B、B C、C D、D2. 在柠檬中插入两种不同的金属可以制得水果电池。相同条件下,水果电池的电压与两种金属的活动性差异大小有关。下列柠檬电池的两种金属,活动性差异最大的是( )A、 B、
B、 C、
C、 D、
D、 3. 下图是小科完成CO2的制取、收集和验满的主要操作过程,其中需要纠正的是( )A、
3. 下图是小科完成CO2的制取、收集和验满的主要操作过程,其中需要纠正的是( )A、 B、
B、 C、
C、 D、
D、 4. 下列各组物质能在同一溶液中大量共存的是( )A、NaCl、FeCl2、MgSO4、Cu(NO3)2 B、AgNO3、NaCl、Mg(NO3)2、KOH C、Ca(OH)2、NaNO3、Na2CO3、NH4Cl D、HCl、K2SO4、Na2CO3、NaNO35. 在实验室中制取下列气体,所用原理最合理的是( )A、用Na2CO3和稀盐酸反应制取CO2 B、用CaCO3和稀H2SO4反应制取CO2 C、用HgO加热分解制取O2 D、用H2O2和MnO2制取O26. 如图,为检查装置的气密性,将导管的末端伸入装有水的烧杯中。用双手紧贴试管外壁,若装置的气密性良好,此时烧杯内导管处的现象(画圈部分)是( )
4. 下列各组物质能在同一溶液中大量共存的是( )A、NaCl、FeCl2、MgSO4、Cu(NO3)2 B、AgNO3、NaCl、Mg(NO3)2、KOH C、Ca(OH)2、NaNO3、Na2CO3、NH4Cl D、HCl、K2SO4、Na2CO3、NaNO35. 在实验室中制取下列气体,所用原理最合理的是( )A、用Na2CO3和稀盐酸反应制取CO2 B、用CaCO3和稀H2SO4反应制取CO2 C、用HgO加热分解制取O2 D、用H2O2和MnO2制取O26. 如图,为检查装置的气密性,将导管的末端伸入装有水的烧杯中。用双手紧贴试管外壁,若装置的气密性良好,此时烧杯内导管处的现象(画圈部分)是( )
选项
A
B
C
D
现象
放大
图



 A、A B、B C、C D、D7. 逻辑推理是一种重要的科学思维方法,下列推理合理的是( )A、化合物是由不同种元素组成的,则由不同种元素组成的物质一定化合物 B、冰熔化成水质量不变,则只要变化过程中质量不变的一定符合质量守恒定律 C、中和反应一定生成盐和水,则有盐和水生成的反应一定是中和反应 D、氢气不纯遇明火可能会发生爆炸,则点燃氢气之前一定要检验纯度8. 一定条件下,甲、乙、丙、丁四种物质在密闭容器中反应,测得反应前后各物质的质量分数如图所示,下列说法正确的是( )
A、A B、B C、C D、D7. 逻辑推理是一种重要的科学思维方法,下列推理合理的是( )A、化合物是由不同种元素组成的,则由不同种元素组成的物质一定化合物 B、冰熔化成水质量不变,则只要变化过程中质量不变的一定符合质量守恒定律 C、中和反应一定生成盐和水,则有盐和水生成的反应一定是中和反应 D、氢气不纯遇明火可能会发生爆炸,则点燃氢气之前一定要检验纯度8. 一定条件下,甲、乙、丙、丁四种物质在密闭容器中反应,测得反应前后各物质的质量分数如图所示,下列说法正确的是( ) A、丁一定是该反应的催化剂 B、该反应的基本型是分解反应 C、参加反应的乙、丙的质量比为3:17 D、甲一定是化合物9. “绿色化学”又称环境无害化学的思想,是指化学反应的过程中充分利用参与反应每一个原料原子,即能保护环境又能循环使用原料。某化学家设计了下列化学反应步骤:
A、丁一定是该反应的催化剂 B、该反应的基本型是分解反应 C、参加反应的乙、丙的质量比为3:17 D、甲一定是化合物9. “绿色化学”又称环境无害化学的思想,是指化学反应的过程中充分利用参与反应每一个原料原子,即能保护环境又能循环使用原料。某化学家设计了下列化学反应步骤:①CaBr2+H2OCaO+2HBr
②2HBr+Hg=HgBr2+H2↑
③HgBr2+CaOHgO+CaBr2
④2HgO2Hg+O2↑。
该方案的主要目的是为了制备( )
A、HBr B、CaO C、H2 D、Hg10. 物质结构决定性质,性质决定用途。下列物质结构、性质和用途之间正确的是( )选项
结构
性质
用途
A
稀盐酸中含有氢离子
具有酸性
具有酸性检验溶液中是否含有银离子
B
稀盐酸中含有氯离子
具有酸性
具有酸性检验溶液中是否含有银离子
C
氢氧化钠溶液中含有钠离子
具有碱性
具有碱性吸收二氧化硫气体
D
氢氧化钠溶液中含有氢氧根离子
具有碱性
具有碱性吸收二氧化硫气体
A、A B、B C、C D、D11. 将苯(C6H6)和氧气置于一个完全密闭的容器中引燃,反应生成二氧化碳、水和X。已知反应前后各物质的质量如下:则下列有关说法正确的是( )物质
苯
氧气
二氧化碳
水
X
反应前的质量(g)
3.9
9.6
0
0
0
反应后的质量(g)
0
0
6.6
2.7
m
A、m等于4.0 B、X由碳、氧两种元素组成 C、X由碳、氢两种元素组成 D、生成物中二氧化碳和水的分子个数比为3:112. 已知某混合溶液由HCl、Na2CO3、H2SO4、MgCl2中的两种混合而成,向该混合溶液中加入Ba(OH)2溶液,产生沉淀与加入的Ba(OH)2溶液体积关系如图所示,下列选项正确的是( ) A、该混合液由HCl、H2SO4组成 B、该混合液由H2SO4、MgCl2组成 C、该混合液由HCl、MgCl2组成 D、该混合液由Na2CO3、MgCl2组成13. 除去下列物质中的少量杂质,所用试剂或和方法难以成功的是( )
A、该混合液由HCl、H2SO4组成 B、该混合液由H2SO4、MgCl2组成 C、该混合液由HCl、MgCl2组成 D、该混合液由Na2CO3、MgCl2组成13. 除去下列物质中的少量杂质,所用试剂或和方法难以成功的是( )选项
物质
杂质
试剂和方法
A
KCl
MnO2
加足量的水溶解并过滤、蒸发结晶
B
NaCl
CuCl2
加入适量的NaOH并过滤、蒸发结晶
C
Ag
Fe
加入过量稀硫酸并过滤、洗涤、干燥
D
CO2
CO
在充足的O2中点燃
A、A B、B C、C D、D14. 实验室用氯酸钾和二氧化猛制取氧气,加热一段时间后剩余固体混合物10g,继续加热至完全反应后固体变为9.04g,再将固体加水充分溶解、过滤、洗涤干燥得到1.59g黑色固体。则10g剩余固体混合物中氯元素的质量分数为( )A、7.1% B、17.75% C、35.5% D、42.6%15. 某锥形瓶内盛有盐酸和氯化铜的混合溶液100g,向其中加入溶质质量分数为10%的氢氧化钠溶液,锥形瓶内溶液质量m1与加入的氢氧化钠溶液质量m2的变化关系如图所示。下列说法错误的是( )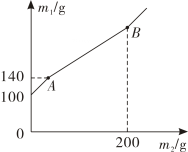 A、反应至A点时,所加NaOH溶液的质量为40g B、反应至A点时,溶液中的溶质有CuCl2和NaCl C、反应至B点时,锥形瓶内溶液的质量为280.4g D、反应至B点时,锥形瓶内溶液中NaCl的质量为23.4g
A、反应至A点时,所加NaOH溶液的质量为40g B、反应至A点时,溶液中的溶质有CuCl2和NaCl C、反应至B点时,锥形瓶内溶液的质量为280.4g D、反应至B点时,锥形瓶内溶液中NaCl的质量为23.4g二、填空题(本题共6小题,每空2分,共34分)
-
16. 物质的酸碱性与我们的生活密切相关。(1)、酸性是因为物质能电离出离子,可以使紫色石蕊试液变色。(2)、酸碱性强弱可用pH值表示,通常生理盐水呈中性,即pH7。(3)、当稀硫酸中加入过量的碳酸钾溶液是,所得溶液呈碱性,其溶质是。17. 以化合价为纵坐标,物质的类别为横坐标所绘制的图象叫价类图.如图为硫的价类图,请分析该图后填空:
 (1)、E点表示氧化物的物质化学式是;(2)、A点表示的物质类别是;(3)、写出由B点表示的氧化物与氢氧化钠溶液反应的化学方程式。18. 按下列要求,从①烧碱②盐酸③熟石灰④稀硫酸中选出选出适当的物质,填在相应的横线上(填化学式):(1)、能降低土壤酸性和用于配制农药波尔多液的是;(2)、既有强烈的腐蚀性和易溶于水的性质,又可作某些气体干燥剂的固体物质是;(3)、能除锈,高浓度时又可以作为干燥剂的重要无机化工原料的是。(4)、能杀菌有助于消化,是胃酸的组成成分之一,则它是。19. A、B、C为初中科学常见的三种无机化合物,它们之间有如图所示的转化关系(“→”表示某一种物质经一步反应可转化为另一种物质,部分反应物、生成物及反应条件乙略去)。请回
(1)、E点表示氧化物的物质化学式是;(2)、A点表示的物质类别是;(3)、写出由B点表示的氧化物与氢氧化钠溶液反应的化学方程式。18. 按下列要求,从①烧碱②盐酸③熟石灰④稀硫酸中选出选出适当的物质,填在相应的横线上(填化学式):(1)、能降低土壤酸性和用于配制农药波尔多液的是;(2)、既有强烈的腐蚀性和易溶于水的性质,又可作某些气体干燥剂的固体物质是;(3)、能除锈,高浓度时又可以作为干燥剂的重要无机化工原料的是。(4)、能杀菌有助于消化,是胃酸的组成成分之一,则它是。19. A、B、C为初中科学常见的三种无机化合物,它们之间有如图所示的转化关系(“→”表示某一种物质经一步反应可转化为另一种物质,部分反应物、生成物及反应条件乙略去)。请回 (1)、若C是气体,它能使带火星的木条复燃,A、B所属的物质类别和组成元素都相同,则A→B的化学反应方程式为。(2)、若A、B、C均为碱,且C为蓝色沉淀,写出A→B反应的化学方程式。20. “飞花令”是中国诗词的一种接龙游戏。科学兴趣小组模仿“飞花令”游戏规则,进行物质间转化的接龙比赛,其比赛规则是:从同一物质开始进行转化,接龙物质不能重复且必须含有指定元素,以转化路径越长且正确者为比赛胜者。某两场比赛的过程记录如下(“一”表示某一种物质经一步反应可转化为另一种物质)。(1)、指定元素:氧元素起始物质:H2SO4比赛胜者:乙同学甲同学:H2SO4→CO2
(1)、若C是气体,它能使带火星的木条复燃,A、B所属的物质类别和组成元素都相同,则A→B的化学反应方程式为。(2)、若A、B、C均为碱,且C为蓝色沉淀,写出A→B反应的化学方程式。20. “飞花令”是中国诗词的一种接龙游戏。科学兴趣小组模仿“飞花令”游戏规则,进行物质间转化的接龙比赛,其比赛规则是:从同一物质开始进行转化,接龙物质不能重复且必须含有指定元素,以转化路径越长且正确者为比赛胜者。某两场比赛的过程记录如下(“一”表示某一种物质经一步反应可转化为另一种物质)。(1)、指定元素:氧元素起始物质:H2SO4比赛胜者:乙同学甲同学:H2SO4→CO2乙同学:H2SO4→CO2→

乙同学在方框中应填物质的化学式是(写一种即可);
(2)、指定元素:钙元素起始物质:CaO比赛胜者:丁同学丙同学:CaO→Ca(OH)2→Mg(OH)2下列能使丁同学获胜的方案有(填字母)。
A.CaO→Ca(NO3)2→Ca(OH)2→CaCO3
B.CaO→CaCl2→Ca(NO3)2→CaCO3
C.CaO→CaCl2→CaCO3→Ca(NO3)2→CaSO4
D.CaO→Ca(OH)2→CaCO3→CaCl2→Ca(NO3)2
21. 有一包白色固体,可能由 BaCl2、NaOH、Na2CO3、Na2SO4 中的一种或几种组成。为确定其成分,实验小组进行实验。实验过程中所加试剂均足量,实验过程及现象如图所示。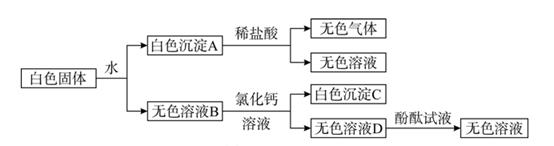 (1)、白色沉淀 A 与稀盐酸反应的化学反应方程式为。(2)、这包白色固体是由(填化学式)组成的。
(1)、白色沉淀 A 与稀盐酸反应的化学反应方程式为。(2)、这包白色固体是由(填化学式)组成的。三、实验探究题(本大题共4小题,每空3分,共36分)
-
22. 化学是一门以实验为基础的学科,请用以下实验装置图回答问题:
 (1)、若实验室利用锌粒和稀硫酸制取H2 , 应选用(填字母)作为的发生装置,反应的化学方程式为。(2)、若实验室利用大理石和稀盐酸制取CO2 , 则选用上述合适的装置并连接,连接顺序为(填字母)。23. 某兴趣小组做了如下实验:
(1)、若实验室利用锌粒和稀硫酸制取H2 , 应选用(填字母)作为的发生装置,反应的化学方程式为。(2)、若实验室利用大理石和稀盐酸制取CO2 , 则选用上述合适的装置并连接,连接顺序为(填字母)。23. 某兴趣小组做了如下实验:
①在止水夹K1、K2处于关闭状态时,将针筒A中溶液挤入试管B中,接着打开止水夹K1 , 发现D中的部分溶液被吸入试管B中。充分反应后,试管B留下的溶液也显红色;
②再打开止水夹K2 , 风哨振动鸣叫,C中的部分溶液被吸入B和D中,反应后B、D中溶液都变为无色。
(1)、步骤①中,充分反应后,试管B里的CO2最终转化为(填化学式)和水。(2)、解释步骤②中“风哨振动鸣叫”的原因。。(3)、实验开始时C、D中两种溶液中溶质质量分数大小关为:a%b%(选填“>”“=”或“<”)。24. 一种制备氢氧化镁的生产流程如图所示,MgCl2 和 NaOH 按恰好完全反应的比例加料。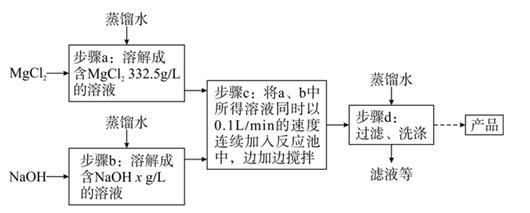 (1)、写出步骤 c 中发生反应的化学方程式:。(2)、x=。(3)、过滤得到的粗产品还要经过洗涤,洗涤时主要除去的杂质是。25. 小丽和小科在做“金属与酸反应”的实验时,他们分别将镁条投入盛有稀盐酸的试管中,小丽加入少量镁条,而小科加入了足量镁条。一段时间后,小科的试管底部“意外”地出现了灰白色固体。为探究该固体是什么物质,他们开展了如下探究:
(1)、写出步骤 c 中发生反应的化学方程式:。(2)、x=。(3)、过滤得到的粗产品还要经过洗涤,洗涤时主要除去的杂质是。25. 小丽和小科在做“金属与酸反应”的实验时,他们分别将镁条投入盛有稀盐酸的试管中,小丽加入少量镁条,而小科加入了足量镁条。一段时间后,小科的试管底部“意外”地出现了灰白色固体。为探究该固体是什么物质,他们开展了如下探究:【提出问题】足量镁和稀盐酸反应生成的灰白色固体是什么?
【查阅资料】氢氧化镁和碱式氯化镁[Mg(OH)Cl]都难溶于水,但都能与稀硝酸反应,后者能生成Mg(NO3)2和HCl。
【建立假设】假设1:未溶解完的氯化镁;假设2:氢氧化镁;假设3:碱式氯化镁;……
【进行实验】将灰白色固体过滤、充分洗涤后进行如下实验:
序号
实验操作
实验现象
实验结论
实验一
取灰白色固体于试管中,加入足量蒸馏水,充分振荡
固体不溶解
假设1
实验二
取灰白色固体于试管中,加入足量稀硝酸,充分振荡
固体溶解
假设2不成立
往上述溶液中滴加硝酸银溶液
【评价交流】小丽认为该灰白色固体一定是碱式氯化镁。小科认为上述探究还不足以说明该固体就是碱式氯化镁,其理由是。
【继续探究】……
四、解答题(本大题共7小题,26、28、29、30题6分,27题5分,31、32题8分,共45分)
-
26. 据报道,我国科学家发现治疗新冠的新药——中药千金藤素,获得国家发明专利授权。千金藤素来自千金藤,其化学式为C37H38N2O6 , 白色固体,难溶于水,易氧化,需密封避光低温保存。
 (1)、根据上述信息,写出千金藤素的一条物理性质:。(2)、千金藤素中各元素质量分数如图甲所示,其中表示碳元素的是。(填序号)(3)、千金藤素分子中,碳、氢、氮、氧元素的原子个数比为。27. 小明在化学晚会上观看了“瓶吞鸡蛋”的魔术(如下图1),看到鸡蛋被吞进瓶内。小明思考:瓶能吞蛋,能不能吐蛋呢?他进行了如下图2的实验,他加入的试剂p为稀盐酸,结果鸡蛋吐了出来。请利用所学知识回答下列问题
(1)、根据上述信息,写出千金藤素的一条物理性质:。(2)、千金藤素中各元素质量分数如图甲所示,其中表示碳元素的是。(填序号)(3)、千金藤素分子中,碳、氢、氮、氧元素的原子个数比为。27. 小明在化学晚会上观看了“瓶吞鸡蛋”的魔术(如下图1),看到鸡蛋被吞进瓶内。小明思考:瓶能吞蛋,能不能吐蛋呢?他进行了如下图2的实验,他加入的试剂p为稀盐酸,结果鸡蛋吐了出来。请利用所学知识回答下列问题 (1)、图1中的注射器相当于。(填“分液漏斗”或“长颈漏斗”)(2)、解释图2鸡蛋被吐出来的原因。28. 氢氧化钠和盐酸能发生反应,下面我们从不同角度来分析这一反应。
(1)、图1中的注射器相当于。(填“分液漏斗”或“长颈漏斗”)(2)、解释图2鸡蛋被吐出来的原因。28. 氢氧化钠和盐酸能发生反应,下面我们从不同角度来分析这一反应。
⑴宏观分析:如图1所示,将天平调平,取下锥形瓶,挤压胶头滴管,再将锥形瓶放回托盘。观察到反应后天平(填“是”或“否”)平衡,得出化学反应前后物质质量不变。
⑵微观分析:图2表示反应前后锥形瓶内溶液中存在的离子,其中的“
 ”表示。(填离子符号)
”表示。(填离子符号)⑶建立模型:NaOH+HCl=NaCl+H2O
⑷定量分析:反应过程中消耗的氢氧化钠和生成的氯化钠的质量比是。
29. 实验室常用一定质量分数的过氧化氢溶液制取氧气。某同学实验前称得一定质量分数的过氧化氢溶液42.5克,加入1克MnO2 , 完全反应后称得剩余物质的质量总和为41.9克。计算:(1)、反应后MnO2的质量。(2)、反应中放出氧气的质量。(3)、实验中加入的过氧化氢溶液的质量分数。30. 复方碳酸氢钠片是一种常用的抗酸剂药物,口服后能迅速和胃酸反应,用于缓解胃酸过多引起的胃痛等症状。复方碳酸氢钠片的主要成分是碳酸氢钠(假定其它成分都为氯化钠),碳酸氢钠与盐酸反应的化学方程式为:NaHCO3+HCl=NaCl+H2O+CO2↑
某科学兴趣小组为了测定药片中碳酸氢钠的含量做了以下实验:先将复方碳酸氢钠片制成粉末,取10克粉末分多次放入盛有100克稀盐酸的烧杯中充分反应。测出加入的粉末质量和反应后的溶液质量,两者质量关系如图所示。
 (1)、实验后,兴趣小组又往烧杯中加入少量粉末,观察到 , 说明上述实验结束时稀盐酸过量。(2)、计算复方碳酸氢钠片中碳酸氢钠的含量。(3)、计算10克粉末与稀盐酸反应后所得氯化钠溶液的溶质质量分数。(计算结果精确到0.1%)31. 某科学兴趣小组同学取8.5g铁,放到含少量硫酸的硫酸铜溶液中,完全反应后,最终得到9.2g固体。为测定所得固体中各成分的含量,同学们将62.5g稀盐酸分五次加入到该固体中,得到数据如下表:
(1)、实验后,兴趣小组又往烧杯中加入少量粉末,观察到 , 说明上述实验结束时稀盐酸过量。(2)、计算复方碳酸氢钠片中碳酸氢钠的含量。(3)、计算10克粉末与稀盐酸反应后所得氯化钠溶液的溶质质量分数。(计算结果精确到0.1%)31. 某科学兴趣小组同学取8.5g铁,放到含少量硫酸的硫酸铜溶液中,完全反应后,最终得到9.2g固体。为测定所得固体中各成分的含量,同学们将62.5g稀盐酸分五次加入到该固体中,得到数据如下表:次数
1
2
3
4
5
加入盐酸溶液质量/g
12.5
12.5
12.5
12.5
12.5
剩余固体质量/g
8.5
7.8
a
6.4
6.4
(铁与硫酸铜反应化学方程式Fe+CuSO4=FeSO4+Cu)
请分析计算:
(1)、表中a的值是。(2)、9.2g固体中铜的质量是g。(3)、稀盐酸的溶质质量分数是多少?(4)、与硫酸铜反应的铁的质量是多少?32. 向25gBa(OH)2溶液中先后滴加质量分数为8%的CuSO4溶液和质量分数为9.8%的H2SO4溶液,滴加过程中加入溶液的质量与产生沉淀的质量关系如图所示。 (1)、a点对应溶液pH7。(填“>”、“=”或“<)(2)、生成Cu(OH)2沉淀的质量是g(3)、原Ba(OH)2溶液溶质的质量分数为多少?(4)、取c点对应的溶液滴加NaOH溶液时观察到的现象是。
(1)、a点对应溶液pH7。(填“>”、“=”或“<)(2)、生成Cu(OH)2沉淀的质量是g(3)、原Ba(OH)2溶液溶质的质量分数为多少?(4)、取c点对应的溶液滴加NaOH溶液时观察到的现象是。