广东省江门市鹤山市重点中学2023-2024学年高二上学期第二阶段考试化学试题
试卷更新日期:2024-01-04 类型:期中考试
一、选择题(本题共16小题,第1~10题每小题2分;第11~16题每小题4分,共44分。在每小题给出的四个选项中,只有一项是符合题目要求的。)
-
1. 能量与科学、技术、社会、环境关系密切。下列应用中能量转化关系不正确的是( )
A
B
C
D

天然气燃气炉

太阳能电池

水电站

电解精炼铜
化学能→热能
太阳能→电能
化学能→电能
电能→化学能
A、A B、B C、C D、D2. 下列化学反应属于吸热反应的是( )A、工业合成氨 B、二氧化硫的催化氧化 C、Ba(OH)2·8H2O(s)与NH4Cl(s)的反应 D、汽油的燃烧3. 依据下列热化学方程式得出的结论中,正确的是( )A、已知2H2(g)+O2(g)=2H2O(g) △H=-483.6kJ/mol,则氢气的燃烧热△H为-241.8kJ/mol B、已知C(石墨,s)=C(金刚石,s) △H>0,则金刚石比石墨稳定 C、已知NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) △H=-57.4kJ/mol,则含20.0gNaOH的稀溶液与稀盐酸完全中和,放出28.7kJ的热量 D、已知2C(s)+2O2(g)=2CO2(g) △H1;2C(s)+O2(g)=2CO(g) △H2;则△H1>△H24. 下列有关说法不正确的是( )A、Na与H2O的反应是熵增的放热反应,该反应能自发进行 B、某吸热反应能自发进行,因此该反应一定是熵增反应 C、通常情况下,一个放热且熵增的反应也有可能非自发进行 D、反应NH3(g)+HCl(g)=NH4Cl(s)在室温下可自发进行,则该反应的ΔH<05. 已知过氧化氢分解生成氢气和氧气是放热反应。科研人员采用新型复合光催化剂,利用太阳光高效分解水的过程如下图所示,下列说法正确的是( )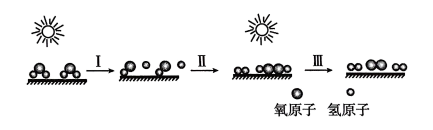 A、化学反应过程中催化剂并没有参加化学反应,但能大幅度提高反应速率 B、过程I的发生需要放出热量 C、过程Ⅲ中断裂旧键吸收的能量小于形成新键放出的能量 D、该过程涉及到极性键和非极性键的断裂和形成6. 影响化学反应速率的因素有多方面。下列说法不正确的是( )A、增大体系压强不一定能加快反应速率 B、增大浓度能增加反应体系中活化分子的百分数 C、催化剂能改变反应的活化能 D、升高温度能增加反应物分子之间的有效碰撞次数7. 下列叙述正确的是( )A、100 ℃纯水的pH=6,所以水在100 ℃时呈酸性 B、pH=3的盐酸溶液,稀释至10倍后pH>4 C、0.2 mol·L-1的醋酸,与等体积水混合后pH=1 D、常温时,pH=3的盐酸与pH=11的氢氧化钠等体积混合后pH=78. 有关电化学的相关知识中,下列叙述正确的是( )A、金属腐蚀就是金属失去电子被还原的过程 B、电解精炼铜时,阳极泥中常含有金属金、银、锌等 C、用惰性电极电解某溶液时,发现两极分别只有H2和O2生成,则电解一段时间后,该溶液的浓度可能不变 D、铜板上的铁铆钉处在潮湿的空气中直接发生反应:Fe−3e−=Fe3+ , 继而形成铁锈9. 元素A的各级电离能数据如下:
A、化学反应过程中催化剂并没有参加化学反应,但能大幅度提高反应速率 B、过程I的发生需要放出热量 C、过程Ⅲ中断裂旧键吸收的能量小于形成新键放出的能量 D、该过程涉及到极性键和非极性键的断裂和形成6. 影响化学反应速率的因素有多方面。下列说法不正确的是( )A、增大体系压强不一定能加快反应速率 B、增大浓度能增加反应体系中活化分子的百分数 C、催化剂能改变反应的活化能 D、升高温度能增加反应物分子之间的有效碰撞次数7. 下列叙述正确的是( )A、100 ℃纯水的pH=6,所以水在100 ℃时呈酸性 B、pH=3的盐酸溶液,稀释至10倍后pH>4 C、0.2 mol·L-1的醋酸,与等体积水混合后pH=1 D、常温时,pH=3的盐酸与pH=11的氢氧化钠等体积混合后pH=78. 有关电化学的相关知识中,下列叙述正确的是( )A、金属腐蚀就是金属失去电子被还原的过程 B、电解精炼铜时,阳极泥中常含有金属金、银、锌等 C、用惰性电极电解某溶液时,发现两极分别只有H2和O2生成,则电解一段时间后,该溶液的浓度可能不变 D、铜板上的铁铆钉处在潮湿的空气中直接发生反应:Fe−3e−=Fe3+ , 继而形成铁锈9. 元素A的各级电离能数据如下:I1
I2
I3
I4
I5
I6
I/(kJ·mol−1)
568
1517
9745
10978
13931
17978
则元素A常见价态是( )
A、+1 B、+2 C、+3 D、+410. 常温下,某溶液中由水电离出的c(OH-)=1×10-5mol/L,则该溶液中的溶质是( )A、CH3COONa B、NaOH C、NH3·H2O D、KI11. 室温下,向10 mL 0.1 mol/L醋酸溶液中加水稀释后,下列说法正确的是( )A、溶液中粒子的数目减小 B、再加入CH3COONa固体能促进醋酸的电离 C、醋酸的电离程度增大,c(H+)亦增大 D、溶液中不变12. 常温下,下列溶液中的微粒浓度关系正确的是( )A、新制氯水中加入固体NaOH:c(Na+) = c(Cl-) + c(ClO-) + c(OH) B、pH = 8.3的NaHCO3溶液:c(Na+) > c(HCO3-) > c(CO32-) > c(H2CO3) C、pH = 11的氨水与pH = 3的盐酸等体积混合:c(Cl-) = c(NH4+) > c(OH) = c(H+) D、0.2mol/LCH3COOH溶液与0.1mol/LNaOH溶液等体积混合:2c(H+) – 2c(OH-) = c(CH3COO-) – c(CH3COOH)13. 将0.15mol/L的盐酸滴入盛有15mL稀氨水和3滴甲基橙的锥形瓶中测定其浓度,如图所示。下列有关说法正确的是( )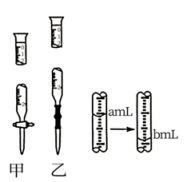 A、稀盐酸应注入滴管乙 B、终点现象为溶液红色褪去,且半分钟内不再复原 C、滴定前盛盐酸的滴定管尖端有气泡,滴定后气泡消失,所测氨水浓度偏低 D、由图中数据得出稀氨水浓度为0.01(b-a)mol/L14. 下列实验操作及现象、对应结论均正确的是( )
A、稀盐酸应注入滴管乙 B、终点现象为溶液红色褪去,且半分钟内不再复原 C、滴定前盛盐酸的滴定管尖端有气泡,滴定后气泡消失,所测氨水浓度偏低 D、由图中数据得出稀氨水浓度为0.01(b-a)mol/L14. 下列实验操作及现象、对应结论均正确的是( )选项
实验操作及现象
结论
A
向AgCl固体滴加饱和Na2CrO4溶液,有砖红色沉淀生成
Ksp(Ag2CrO4)<Ksp(AgCl)
B
向含酚酞的Na2CO3溶液中加入BaCl2固体,溶液红色变浅
Na2CO3溶液中存在水解平衡
C
用pH试纸分别测定同等条件下NaClO溶液和CH3COONa
溶液的pH,前者pH值较大
Ka(CH3COOH)> Ka(HClO)
D
向一定浓度的Na2S2O3溶液中滴入稀盐酸,溶液变浑浊
盐酸将Na2S2O3还原为S单质
A、A B、B C、C D、D15. 我国十大科技突破-海水直接电解制H2 , 其工作原理如图(防水透气膜只允许水分子通过)。下列说法不正确的是( )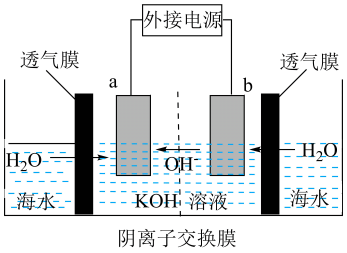 A、b为电解池的阴极 B、a的电极反应式为4OH--4e-=O2↑+2H2O C、去除透气膜,a极发生的电极反应不变 D、电解池工作时,海水侧的离子浓度理论上逐渐增大16. 2molA与2 mol B混合于2 L的密闭容器中,发生如下反应:2A(g)+3B(g)2C(g)+zD(g)若2 s后,A的转化率为50%,测得v(D)=0.25 mol·L-1·s-1 , 下列推断正确的是( )A、V(C)=v(D)=0.25 mol·L-1·s-1 B、z=3 C、B的转化率为25% D、C的体积分数为20%
A、b为电解池的阴极 B、a的电极反应式为4OH--4e-=O2↑+2H2O C、去除透气膜,a极发生的电极反应不变 D、电解池工作时,海水侧的离子浓度理论上逐渐增大16. 2molA与2 mol B混合于2 L的密闭容器中,发生如下反应:2A(g)+3B(g)2C(g)+zD(g)若2 s后,A的转化率为50%,测得v(D)=0.25 mol·L-1·s-1 , 下列推断正确的是( )A、V(C)=v(D)=0.25 mol·L-1·s-1 B、z=3 C、B的转化率为25% D、C的体积分数为20%二、非选择题(共4个大题,56分)
-
17. 已知碘的四氯化碳溶液能与K2C2O4溶液发生反应:I2+K2C2O4=2KI+2CO2↑,甲、乙两个实验小组欲探究影响化学反应速率的因素,设计实验方案如下:(1)、甲组:通过测定单位时间内生成CO2气体的体积来比较化学反应速率的大小,实验装置如图1所示。
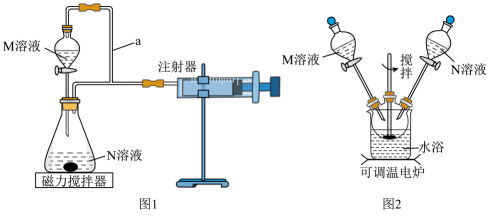
实验Ⅰ.在光亮处将M溶液一次性放入锥形瓶中并不断搅拌,然后关闭活塞。
实验Ⅱ.用黑纸袋包住锥形瓶后再将M溶液一次性放入锥形瓶中并不断搅拌,然后关闭活塞。
两次实验所用M溶液与N溶液相同。
①检查图1装置气密性的方法为。
②盛装M溶液的仪器名称为 , a的作用是。
③该实验探究的是对化学反应速率的影响。
④在反应停止前,相同时间内注射器中所得CO2的体积较多的是(填“实验Ⅰ”或“实验Ⅱ”)。
(2)、乙组:通过测定溶液褪色所用时间来比较化学反应速率的大小,实验装置如图2所示。实验时将M溶液和N溶液同时加入三颈烧瓶中,并不断搅拌,M、N的成分以及水浴温度如下表:
序号
M溶液
N溶液
水浴温度
A
含0.01mol碘的四氯化碳溶液20mL
20mL0.4 mol·L-1的K2C2O4溶液
40℃
B
含0.01mol碘的四氯化碳溶液20mL
20mL0.8 mol·L-1
 K2C2O4溶液
K2C2O4溶液40℃
C
含0.01mol碘的四氯化碳溶液20mL
20mL0.8 mol·L-1的K2C2O4溶液
50℃
①该实验探究的是对化学反应速率的影响。
②该组同学始终没有观察到实验A的溶液褪色,其原因是。
18. 氮及其化合物在生活及工业生产中有着重要应用。请回答以下问题:(1)、如图是N2(g)、H2(g)与NH3(g)之间转化的能量关系图,则: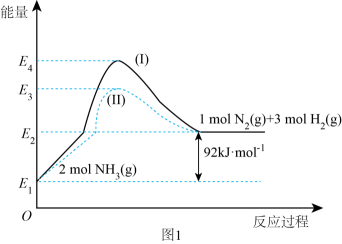
①N2(g)与H2(g)反应生成NH3(g)的热化学方程式为。
②过程(Ⅰ)和过程(Ⅱ)的反应热(填“相同”或“不同”)。
③某温度下,在1 L恒温恒容容器中充入1molN2和3 mol H2进行上述反应,10 min达到平衡,此时容器内压强变为原来的7/8。
a.该温度下的平衡常数为。(只列计算式)
b.N2的平衡转化率为。
(2)、用NH3可以消除氮氧化物的污染,已知:反应Ⅰ:4NH3(g)+3O2(g)2N2(g)+6H2O(g) ΔH1=a kJ·mol-1 平衡常数为K1
反应Ⅱ:N2(g)+O2(g)2NO(g) ΔH2=b kJ·mol-1 平衡常数为K2
反应Ⅲ:4NH3(g)+6NO(g)5N2(g)+6H2O(g) ΔH3=c kJ·mol-1 平衡常数为K3
则反应Ⅱ中的b=(用含a、c的代数式表示),K3=(用K1和K2表示)。
(3)、在恒容的密闭器中,充入一定量的NH3和NO进行上述反应Ⅲ。下列叙述中,不能作为判断反应Ⅲ已经达到平衡状态的标志的是(填序号).a.N2的浓度不再改变
b.断裂6 mol N—H键的同时,有6 mol H—O键形成
c.容器中压强不再变化
d.混合气体的密度保持不变
19. 磷酸锌常用作氯化橡胶合成高分子材料的阻燃剂。工业上利用烧渣灰(主要含ZnO,还含少量FeO、Al2O3、CuO及SiO2)为原料制取磷酸锌的工艺流程如图所示: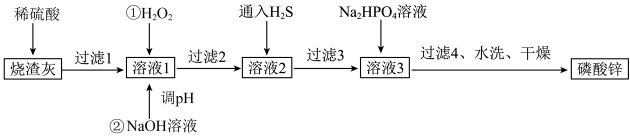
已知:①[Zn3(PO4)2]在水中几乎不溶,其在水中的溶解度随温度的升高而降低;
②“溶液1”中几种金属离子开始沉淀与沉淀完全的pH如表所示:
金属离子
Al3+
Fe3+
Cu2+
Zn2+
开始沉淀的pH
3.0
2.2
5.4
6.5
完全沉淀的pH
5.0
3.6
6.7
8.5
(1)、烧渣灰加入稀硫酸时,请写出ZnO与稀硫酸反应的离子方程式。(2)、加入H2O2的作用。(3)、经过滤2得到滤渣的主要成分是Fe(OH)3和Al(OH)3 , 则用NaOH溶液调节pH的范围是。(4)、加入Na2HPO4溶液发生反应的离子方程式为。(5)、洗涤磷酸锌沉淀时应选用(填“冷水”或“热水”),确认磷酸锌洗涤干净的操作是。(6)、通入H2S是为了除铜离子,25℃时,当通入H2S达到饱和时测得溶液的pH=1,c(H2S)=0.1 mol·L-1 , 此时溶液中c(Cu2+)=6.3×10-15mol·L-1 , 则CuS的溶度积Ksp=(已知:25℃时,H2S的电离平衡常数Ka1=1×10-7 mol∙L-1 , Ka2=1×10-15 mol∙L-1)。20. 单质硅是制造太阳能电池板的主要原料,制备电池板时还需添加硼、氮、钛,钴、钙等多种化学元素。请回答下列问题:(1)、基态硅原子的电子排布式为。(2)、下列钴原子的价层电子轨道表示式中,不符合洪特规则的是____(填选项字母)。A、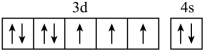 B、
B、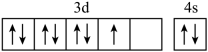 C、
C、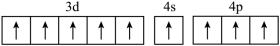 D、
D、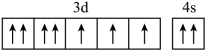 (3)、碳、氮、氧三种元素的第一电离能由大到小的顺序为。(用元素符号表示),原因为。(4)、Ti位于元素周期表区;基态钛原子中,最外层电子的电子云轮廓图为。(5)、CaCl2在火焰上灼烧时火焰的颜色为砖红色,试从原子光谱角度解释部分金属元素在火焰上灼烧呈现不同颜色的原因:。
(3)、碳、氮、氧三种元素的第一电离能由大到小的顺序为。(用元素符号表示),原因为。(4)、Ti位于元素周期表区;基态钛原子中,最外层电子的电子云轮廓图为。(5)、CaCl2在火焰上灼烧时火焰的颜色为砖红色,试从原子光谱角度解释部分金属元素在火焰上灼烧呈现不同颜色的原因:。