广东省佛山市南海区2023-2024学年高二上学期12月第二次段考化学试题
试卷更新日期:2024-01-04 类型:月考试卷
一、单选题(1-10题,每小题2分,11-16题,每小题4分,共44分)
-
1. 化学与社会、科学、技术、环境密切相关,下列说法错误的是( )A、医用硝酸铵速冷冰袋是利用硝酸铵溶于水吸热的性质 B、夏天面粉的发酵速率与冬天面粉的发酵速率相同 C、合理利用太阳能、风能和氢能等能源有利于实现“低碳经济” D、铁触媒的使用有利于提高合成氨的生产效率2. 下列各组物质中,都是弱电解质的是( )A、盐酸、、 B、HClO、、 C、NaOH、、 D、、、3. 已知:X(g)+2Y(g) 3Z(g) △H= - akJ·mol-1 (a>0),下列说法不正确的是( )A、0.1molX和0.2molY充分反应生成Z的物质的量一定小于0.3mol B、达到化学平衡状态时,X、Y、Z的浓度不再发生变化 C、密闭容器中,恒温,缩小体积,X的转化率不变 D、升高反应温度,逆反应速率增大,正反应速率减小4. 室温下,对于1L 0.1mol·L-1醋酸溶液,下列判断正确的是( )A、该溶液中CH3COO- 的粒子数为6.02×1022 B、适当升高溶液温度,溶液中导电粒子数目减小 C、滴加NaOH溶液过程中,n(CH3COO-)与n(CH3COOH)之和始终为0.1 mol D、若该醋酸溶液的电离度为1%,则该醋酸溶液的电离平衡常数为10-45. 铅蓄电池的两极分别为Pb、PbO2 , 电解质溶液为H2SO4溶液,工作时的电池反应为:
Pb+ PbO2+2H2SO4 =2PbSO4+2H2O,下列结论正确的是( )
A、Pb为正极,被氧化 B、电池工作时,电解质溶液的pH不断减小 C、向PbO2极移动 D、电池工作时,电解质溶液的pH不断增大6. 常温下,下列各组离子在指定溶液中因完全双水解而不能大量共存的是( )A、pH=1的溶液中:Fe2+、、、Na+ B、H+、NH4+、CH3COO-、 C、由水电离的c(H+)=1×10-14 mol/L的溶液中:Ca2+、K+、Cl-、 D、K+、Al3+、、AlO2-7. 化学是以实验为基础的科学。下列实验操作或做法正确且能达到目的的是( )选项
操作或做法
目的
A
向两只盛有2mL5%双氧水的试管中,分别滴加5滴饱和溶液和5滴饱和溶液,观察实验现象
探究催化剂对反应速率的影响
B
取5mL0.1mol/LKI溶液于试管中,加入溶液,充分反应后滴入5滴15%KSCN溶液,观察实验现象
探究KI与反应是可逆反应
C
用玻璃棒蘸取NaClO溶液点到干燥的pH试纸中间
测NaClO溶液的pH值
D
在50mL酸式滴定管中装入盐酸,调整初始读数为30.00mL后,将剩余盐酸放入锥形瓶
取20.00mL盐酸
A、A B、B C、C D、D8. 已知下列3个热化学方程式(K为平衡常数):①
②
③
则ΔH3和K3的表达式分别为( )
A、 , B、 , C、 , D、 ,9. 广义的水解观认为:无论是盐的水解还是非盐的水解,其最终结果是反应中各物质和水分别离解成两部分,然后两两重新组合成新的物质。根据上述观点,下列说法不正确的是( )A、BaO2的水解产物是Ba(OH)2和H2O2 B、PCl3的水解产物是HClO和H3PO4 C、Al4C3的水解产物是Al(OH)3和CH4 D、CH3COCl的水解产物是两种酸10. 常温下0.1 mol·L-1 ①CH3COOH、②NaOH、③CH3COONa,下列叙述正确的是( )A、①中c(CH3COOH)>c(CH3COO-)>c(H+)>c(OH-) B、①②等体积混合后,醋酸根离子浓度小于③的二分之一 C、①③等体积混合以后,溶液呈酸性,则c(Na+)>c(CH3COO-)>c(H+) D、①②等体积混合以后,水的电离程度比①③等体积混合后水的电离程度小11. 某温度下向含AgCl固体的AgCl饱和溶液中加少量稀盐酸,下列说法正确的是( )
A、AgCl的溶解度、Ksp均减小 B、AgCl的溶解度、Ksp均不变 C、AgCl的溶解度减小、Ksp不变 D、AgCl的溶解度不变、Ksp减小12. 在密闭容器中进行反应:X(g)+3Y(g) ⇌2Z(g),有关下列图像的说法错误的是( )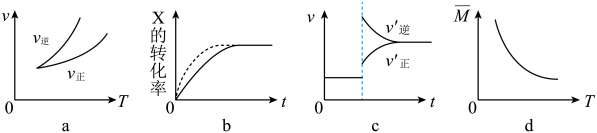 A、依据图a可判断正反应为放热反应 B、在图b中,虚线可表示使用了催化剂 C、若正反应的△H>0,图c可表示升高温度正逆化学反应v-t图 D、由图d中混合气体的平均相对分子质量随温度的变化情况,可知正反应ΔH<013. 部分弱酸的电离平衡常数如下表:
A、依据图a可判断正反应为放热反应 B、在图b中,虚线可表示使用了催化剂 C、若正反应的△H>0,图c可表示升高温度正逆化学反应v-t图 D、由图d中混合气体的平均相对分子质量随温度的变化情况,可知正反应ΔH<013. 部分弱酸的电离平衡常数如下表:弱酸
HCOOH
HCN
H2CO3
电离平衡常数(25℃)
Ka1=1.77×10-4
Ka1=4.9×10-10
Ka1=4.3×10-7 ; Ka2=5.6×10-11
下列选项错误的是( )
A、向NaCN溶液中通入少量CO2气体:CN-+H2O+CO2=HCN+HCO B、相同浓度的HCN和NaHCO3的导电能力:HCN>NaHCO3 C、中和等体积、等pH的HCOOH和HCN消耗NaOH的量,前者小于后者 D、等pH的HCOOH和HCN稀释相同的倍数后,pH前者大于后者14. 下列关于中和滴定的说法正确的是( )A、用标准浓度HCl溶液滴定弱碱MOH溶液来测定其浓度,选择酚酞为指示剂 B、除去碱式滴定管胶管内气泡的方法是将尖嘴垂直向下,挤压胶管内的玻璃球将气泡排出 C、滴定接近终点时,滴定管的尖嘴可以接触锥形瓶内壁 D、用稀NaOH滴定盐酸,用酚酞作指示剂,当锥形瓶中溶液由红色变无色时立即停止滴定15. 实验测得0.5 mol·L-1CH3COONa溶液、0.5 mol·L-1CuSO4溶液以及H2O的pH随温度变化的曲线如图所示。下列说法正确的是( )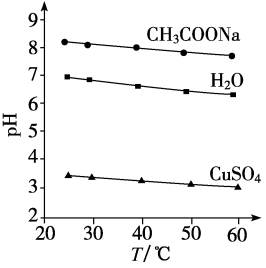 A、随温度升高,纯水中c(H+)>c(OH-) B、随温度升高,CH3COONa溶液的pH降低,是因为CH3COO-水解平衡向逆反应方向移动 C、随温度升高,CH3COONa溶液的c(OH-)减小 D、随温度升高,CuSO4溶液的pH减小是水的电离平衡和水解平衡向正反应方向移动的结果16. 采用真空封管法制备磷化硼纳米颗粒,在发展非金属催化剂实现CO2电催化还原制备甲醇(CH3OH)方向取得重要进展,该反应历程如图所示。下列说法错误的是( )
A、随温度升高,纯水中c(H+)>c(OH-) B、随温度升高,CH3COONa溶液的pH降低,是因为CH3COO-水解平衡向逆反应方向移动 C、随温度升高,CH3COONa溶液的c(OH-)减小 D、随温度升高,CuSO4溶液的pH减小是水的电离平衡和水解平衡向正反应方向移动的结果16. 采用真空封管法制备磷化硼纳米颗粒,在发展非金属催化剂实现CO2电催化还原制备甲醇(CH3OH)方向取得重要进展,该反应历程如图所示。下列说法错误的是( )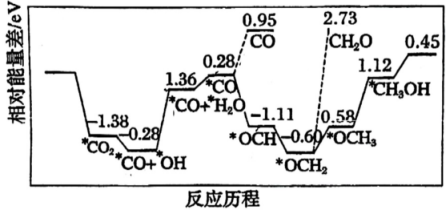 A、总反应焓变 B、上述合成甲醇的反应速率较慢,要使反应速率加快,主要降低*CO+*OH→*CO+*H2O的能量
A、总反应焓变 B、上述合成甲醇的反应速率较慢,要使反应速率加快,主要降低*CO+*OH→*CO+*H2O的能量变化。
C、该催化剂可有效提高反应物的平衡转化率 D、容易得到的副产物有CO和CH2O,其中相对较多的副产物为CO二、非选择题(共4题,56分)
-
17. 学习小组在实验室中利用下图所示装置制备SO2并进行相关性质的探究。
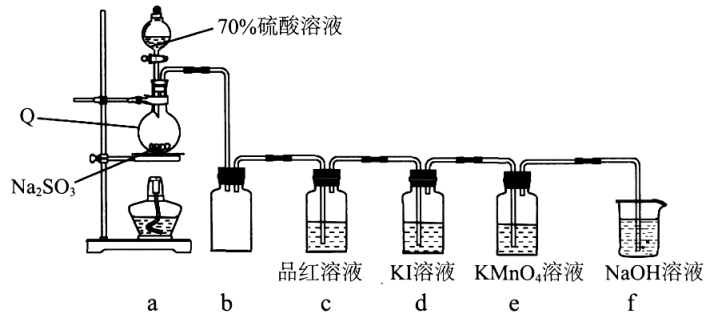
回答下列问题:
(1)、装置a中反应的化学方程式为。(2)、实验开始后,发现装置d中的溶液迅速变黄,继续通入SO2 , 装置d中出现乳黄色浑浊。该小组同学查阅资料得知,存在可逆反应:SO2+4I-+4H+S↓+2I2+2H2O.探究I:探究浓度对上述可逆反应的影响
有同学认为除SO2的浓度外,其他离子的浓度对该可逆反应也有影响。完成实验设计进行验证(SO2体积已折算为标准状况下体积)。
限选试剂:0.1 mol·L-1KI溶液、1.0mol·L-1KI溶液、2.0mol·L-1KI溶液、蒸馏水、浓硝酸、浓盐酸
影响因素
编号
操作
现象
c(I—)
i
取50mL①于锥形瓶中,向其中通入20mL SO2
溶液变为浅黄色
ii
取50mL 1.0mol·L-1 KI溶液于锥形瓶中,向其中通入20mL SO2
溶液迅速变黄
c(H+)
iii
取50mL 1.0mol·L-1 KI溶液和5mL ②于锥形瓶中,向其中通入20mL SO2
溶液迅速变黄
iV
取50mL 1.0mol·L-1 KI溶液和5mL 浓盐酸于锥形瓶中,向其中通入20mL SO2
溶液迅速变黄,且出现乳黄色浑浊
(3)、探究II:探究SO2在KI溶液体系中的反应产物有同学提出上述可逆反应生成的I2可与SO2发生反应:SO2+I2+2H2O=SO42-+2I-+4H+.为进一步探究体系中的产物,完成下列实验方案。
方案
操作
预期现象
结论
i
取适量装置d中浊液,向其中滴加几滴③溶液(填试剂名称),振荡
无明显变化
浊液中无I2
ii
将装置d中浊液进行分离
得淡黄色固体和澄清溶液
取适量分离后的澄清溶液于试管中,④ .
白色沉淀
⑤
⑥综上可知,SO2在KI溶液中发生了歧化反应,其反应的离子方程式为。
18. 磁选后的炼铁高钛炉渣,主要成分有、、、MgO、CaO以及少量的 , 为节约和充分利用资源,通过如下工艺流程回收钛、铝、镁等。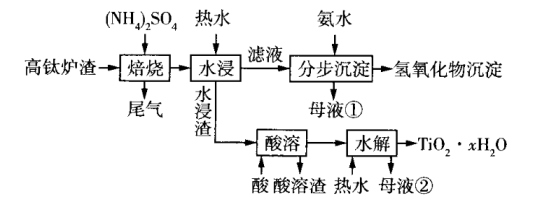
该工艺条件下,有关金属离子开始沉淀和沉淀完全的pH如表所示。
金属离子
开始沉淀的pH
2.2
3.5
9.5
12.4
沉淀完全的pH
3.2
4.7
11.1
13.8
回答下列问题:
(1)、“焙烧”中,几乎不发生反应,、MgO、CaO、转化为相应的硫酸盐,写出转化为的化学方程式。(2)、“水浸”后“滤液”的pH约为2.0,在“分步沉淀”时用氨水逐步调节pH至11.6,依次析出的金属离子是。(3)、“母液①”中浓度为。(4)、“水浸渣”在160℃“酸溶”,最适合的酸是(写名称)。“酸溶渣”的成分是、。(5)、“酸溶”后,将溶液适当稀释并加热,水解析出沉淀,该反应的离子方程式是。(6)、将“母液①”和“母液②”混合,吸收尾气,经处理得 , 循环利用。19.(1)、某有机物R能与Fe2+形成橙红色的离子[FeR3]2+ , 该离子可被HNO3氧化成淡蓝色的离子[FeR3]3+ , 完成反应的离子方程式:NO3- + 2[FeR3]2+ + 3H+ + 2[FeR3]3+ + H2O(2)、某研究小组对(1)中的反应进行了研究。
用浓度分别为2.0 mol·L-1、2.5 mol·L-1、3.0 mol·L-1的HNO3溶液进行了三组实验,得到c([FeR3]2+)随时间t的变化曲线如图。
①图中对应c(HNO3) = 3.0 mol·L-1时的变化曲线为(填代号III、II、I)。
②c(HNO3) = 3.0 mol·L-1时,在0~1min内,[FeR3]3+的平均消耗速率= mol/(L·min)。
③下列有关说法中,正确的有。
A.平衡后加水稀释,增大
B.[FeR3]2+的平衡转化率:αIII>αII>αI
C.三组实验中,反应速率都随反应进程一直减小
D.体系由橙红色转变为淡蓝色所需时间:tIII>tII>tI
(3)、由R产生的物质L可用于分离稀土,溶液中某稀土离子(用M表示)与L存在平衡:i).M(aq)+L (aq) ML(aq) K1
ii).ML(aq)+L(aq) ML2(aq) K2
研究组配制了M与L起始浓度比c0(M)/c0(L)不同的系列溶液,反应平衡后测定L的含量,测得起始浓度比c0(M)/c0(L)分别为0、a、b时,各成分L的含量S如下表(各成分含L的总量S计为1).

【注】:“<0.01”表示未检测到。
①c0(M)/c0(L)=a时, x=。
②c0(M)/c0(L)=b时,平衡浓度比c平(ML2)/c平(ML)=
 (4)、研究组研究了(3)中M与L反应体系,当C0(L)=1.0×10-5mol·L-1时,测得平衡时各物种L含量C平/C0(L)随C0(M)/C0(L)的变化曲线如图10,C0(M)/C0(L)=0.51时,计算①M的平衡转化率(结果仅保留两位有效数字),②(3)中反应i)的K1.20. 某兴趣小组做如下探究实验:
(4)、研究组研究了(3)中M与L反应体系,当C0(L)=1.0×10-5mol·L-1时,测得平衡时各物种L含量C平/C0(L)随C0(M)/C0(L)的变化曲线如图10,C0(M)/C0(L)=0.51时,计算①M的平衡转化率(结果仅保留两位有效数字),②(3)中反应i)的K1.20. 某兴趣小组做如下探究实验: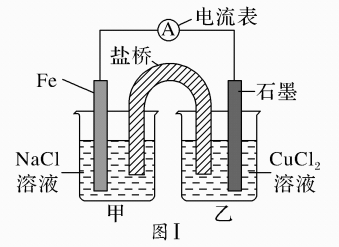
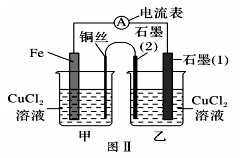 (1)、图Ⅰ为依据氧化还原反应设计的原电池装置,Fe极作原电池的(填“正、负”)极,该原电池反应的离子方程式为。(2)、如图Ⅰ,其他条件不变,若将NaCl溶液、CuCl2溶液分别换为FeCl2、NH4Cl溶液,石墨电极上发生(填“氧化、还原”)反应,写出电极反应方程式。(3)、如图Ⅱ,其他条件不变,将图Ⅰ中NaCl溶液换成CuCl2溶液、盐桥换成弯铜导线与石墨相连成n形,以下对甲、乙装置的判断正确是____(填代号)。A、甲装置作原电池,乙装置不作原电池 B、乙装置作原电池,甲装置不作原电池 C、甲、乙装置都作原电池 D、甲、乙装置都不作原电池(4)、有同学认为常温下将图II甲装置的CuCl2溶液换成浓硝酸,测得电流表A中有电流通过,说明甲装置发生了原电池反应,该原电池的负极是(填化学式),并根据金属的性质解释另一电极作正极的原因
(1)、图Ⅰ为依据氧化还原反应设计的原电池装置,Fe极作原电池的(填“正、负”)极,该原电池反应的离子方程式为。(2)、如图Ⅰ,其他条件不变,若将NaCl溶液、CuCl2溶液分别换为FeCl2、NH4Cl溶液,石墨电极上发生(填“氧化、还原”)反应,写出电极反应方程式。(3)、如图Ⅱ,其他条件不变,将图Ⅰ中NaCl溶液换成CuCl2溶液、盐桥换成弯铜导线与石墨相连成n形,以下对甲、乙装置的判断正确是____(填代号)。A、甲装置作原电池,乙装置不作原电池 B、乙装置作原电池,甲装置不作原电池 C、甲、乙装置都作原电池 D、甲、乙装置都不作原电池(4)、有同学认为常温下将图II甲装置的CuCl2溶液换成浓硝酸,测得电流表A中有电流通过,说明甲装置发生了原电池反应,该原电池的负极是(填化学式),并根据金属的性质解释另一电极作正极的原因