广东省江门市第一中学2023-2024学年高二上学期11月第二次段考化学(选考)试题
试卷更新日期:2024-01-04 类型:月考试卷
一、单项选择题:本题共16小题,共44分。第1~10小题,每小题2分;第11~16小题,每小题4分。每小题只有一个选项符合题意。
-
1. 下列措施对增大反应速率有明显效果的是( )A、Na与水反应时,增加水的用量 B、Al与稀硫酸反应制取时,改用浓硫酸 C、Zn与稀硫酸反应制取时,将锌片改为锌粉 D、溶液与溶液反应时,增大压强2. 向一个密闭容器中充入2mol 和1mol , 在一定条件下使其发生反应生成。达到平衡时,下列说法中正确的是( )A、、和的物质的量浓度之比为2∶1∶2 B、完全转化为 C、正反应速率和逆反应速率都为零 D、单位时间内消耗2a mol , 同时消耗2a mol3. 在一定温度下的容积不变的密闭容器中发生反应:。下列不能说明反应达到平衡状态的是( )A、气体的压强不再变化 B、的体积分数不再变化 C、混合物的密度不再变化 D、各物质的浓度不再变化4. 如右图所示,曲线a表示放热反应:进行过程中X的转化率随时间变化的关系。若要改变起始条件,使反应过程按曲线b进行,可采取的措施是( )
 A、升高温度 B、增大Y的投入量 C、加催化剂 D、减小压强5. 一定条件下,将(NO)和()按物质的邀之比2∶1充入反应容器,发生反应:。其他条件相间时,分别测得NO的平衡转化率在不同压强(、)下随温度变化的曲线如右图所示。下列说法正确的是( )
A、升高温度 B、增大Y的投入量 C、加催化剂 D、减小压强5. 一定条件下,将(NO)和()按物质的邀之比2∶1充入反应容器,发生反应:。其他条件相间时,分别测得NO的平衡转化率在不同压强(、)下随温度变化的曲线如右图所示。下列说法正确的是( )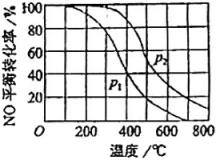 A、 B、该反应的 C、400℃、条件下,的平衡转化率为20% D、400℃时,该反应的化学平衡常数的数值为10/96. 在相同温度时,100mL 0.01mol/L氨水与10mL 0.1mol/L氨水相比较,下列数值中,前者大于后者的是( )A、溶液中的物质的量 B、的电离常数 C、中和时所需HCl的物质的量 D、溶液中的物质的量7. 为了除去溶液中的 , 可在加热并搅拌的条件下加入一种试剂,过滤后,再向滤液中加热适量盐酸,这种试剂是( )A、 B、NaOH C、 D、8. 下列说法中正确的是( )A、在100℃时,pH约为6的纯水呈酸性 B、在常温下,将mol/L盐酸溶液稀释100倍,所得溶液的pH为8 C、在常温下,当水电离出的为mol/L时,此溶液的pH可能为2或12 D、当pH=1的氢氧化钠溶液和氨水各1mL分别稀释100倍,所得氨水的pH略小9. 灰锡结构松散,不能用于制造器皿,而白锡结构坚固,可以制造器皿。已知在0℃、100kPa条件下白锡转化为灰锡的反应焓变和熵变分别为 , 。现把白锡制成的器皿放在0℃、100kPa的室内存放,请判断它会不会变成灰锡而不能再继续使用( )A、会变成灰锡 B、不会变成灰锡 C、不能确定 D、升高温度才会变成灰锡10. 德国化学家哈伯因发明用氮气和氢气合成氨的方法而获得1918年诺贝尔化学奖。下列所示是哈伯法的流程图,其中为提高原料转化率而采联的措施是( )
A、 B、该反应的 C、400℃、条件下,的平衡转化率为20% D、400℃时,该反应的化学平衡常数的数值为10/96. 在相同温度时,100mL 0.01mol/L氨水与10mL 0.1mol/L氨水相比较,下列数值中,前者大于后者的是( )A、溶液中的物质的量 B、的电离常数 C、中和时所需HCl的物质的量 D、溶液中的物质的量7. 为了除去溶液中的 , 可在加热并搅拌的条件下加入一种试剂,过滤后,再向滤液中加热适量盐酸,这种试剂是( )A、 B、NaOH C、 D、8. 下列说法中正确的是( )A、在100℃时,pH约为6的纯水呈酸性 B、在常温下,将mol/L盐酸溶液稀释100倍,所得溶液的pH为8 C、在常温下,当水电离出的为mol/L时,此溶液的pH可能为2或12 D、当pH=1的氢氧化钠溶液和氨水各1mL分别稀释100倍,所得氨水的pH略小9. 灰锡结构松散,不能用于制造器皿,而白锡结构坚固,可以制造器皿。已知在0℃、100kPa条件下白锡转化为灰锡的反应焓变和熵变分别为 , 。现把白锡制成的器皿放在0℃、100kPa的室内存放,请判断它会不会变成灰锡而不能再继续使用( )A、会变成灰锡 B、不会变成灰锡 C、不能确定 D、升高温度才会变成灰锡10. 德国化学家哈伯因发明用氮气和氢气合成氨的方法而获得1918年诺贝尔化学奖。下列所示是哈伯法的流程图,其中为提高原料转化率而采联的措施是( ) A、①②③ B、②④⑤ C、①③⑤ D、②③④11. 由表格中的电离常数(25℃)判断可以发生的反应是( )
A、①②③ B、②④⑤ C、①③⑤ D、②③④11. 由表格中的电离常数(25℃)判断可以发生的反应是( )化学式
电离常数
HClO
A、 B、 C、 D、12. 如图表示水中和的关系,下列判断错误的是( ) A、两条曲线间任意点均有 B、M区域内任意点均有 C、图中 D、XZ线上任意点呈中性13. 向浓度为0.1 溶液中加入少量固体,下列各量减小的是( )A、 B、 C、 D、14. 关于反应 , 达到平衡后,下列说法不正确的是( )A、升高温度,氯水中的减小 B、氯水中加入少量醋酸钠固体,上述平衡正向移动,增大 C、取氯水稀释,增大 D、取两份氯水,分别滴加溶液和淀粉溶液,若前者有白色沉淀,后者溶液变蓝色,可以证明上述反应存在限度15. 常温下,向20mL 0.01 溶液中逐滴加入0.01的NaOH溶液,滴入NaOH溶液的体积与溶液pH的变化关系如图所示。下列说法正确的是( )
A、两条曲线间任意点均有 B、M区域内任意点均有 C、图中 D、XZ线上任意点呈中性13. 向浓度为0.1 溶液中加入少量固体,下列各量减小的是( )A、 B、 C、 D、14. 关于反应 , 达到平衡后,下列说法不正确的是( )A、升高温度,氯水中的减小 B、氯水中加入少量醋酸钠固体,上述平衡正向移动,增大 C、取氯水稀释,增大 D、取两份氯水,分别滴加溶液和淀粉溶液,若前者有白色沉淀,后者溶液变蓝色,可以证明上述反应存在限度15. 常温下,向20mL 0.01 溶液中逐滴加入0.01的NaOH溶液,滴入NaOH溶液的体积与溶液pH的变化关系如图所示。下列说法正确的是( )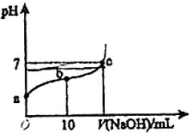 A、a点的pH=2 B、可以选甲基橙指示滴定终点 C、反应过程中,的值不断增大 D、c点时,16. 在常温下,有关下列4种溶液的叙述中错误的是( )
A、a点的pH=2 B、可以选甲基橙指示滴定终点 C、反应过程中,的值不断增大 D、c点时,16. 在常温下,有关下列4种溶液的叙述中错误的是( )编号
①
②
③
④
溶液
氨水
NaOH溶液
氢氟酸
盐酸
pH
11
11
3
3
A、在溶液①、②中分别加入适量的氯化铵晶体后,两种溶液的pH均减小 B、分别加水稀释10倍,四种溶液的pH:①>②>④>③ C、将a L溶液④与b L溶液②混合后,若所得溶液的pH=4,则a∶b=11∶9 D、将溶液①、④等体积混合,所得溶液中:二、非选择题(56分〉
-
17. 物质在水中存在电离平衡、水解平衡。请根据所学知识回答:
①0.1 溶液
②0.1 混合溶液
(1)、盐碱地(含较多、NaCl)不利于植物生长,盐碱地呈碱性的主要原因:(用离子方程式说明);(2)、溶液①中微粒的电荷守恒关系式是;离子浓度大小关系。(3)、溶液②中微粒的物料守恒关系式是。(4)、溶液的pH<7,则溶液中(5)、①把溶液蒸干、灼烧,最后得到的主要固体是。②配制溶液时需向溶液中加少量的(填化学式)以抑制水解。
(6)、泡沫灭火器有效成分为与 , 泡沫灭火使用时发生反应(用离子方程式表示)。(7)、25℃时,有pH=4的盐酸和pH=4的溶液中由水电离出的之比为。18. 某学习小组设计研究醋酸的性质。(1)、研究稀释过程导电能力变化。
冰醋酸稀释过程,溶液导电能力变化如图所示,则a、b、c三点对应溶液中,醋酸电离程度由大到小的顺序是(填字母)。用湿润的pH试纸测定b点pH,结果(填“偏大”、“偏小”或“准确”)。
(2)、研究稀释过程pH变化。25℃时,用pH计测定不同浓度醋酸溶液的pH,结果如下:
序号
①
②
③
④
⑤
醋酸浓度(mol/L)
0.0010
0.01000
0.0200
0.1000
0.2000
pH
3.88
3.38
3.23
2.88
2.83
根据表中数据,稀释醋酸溶液,电离平衡(填“正”或“逆”)向移动;结合表中数据得出判断理由是
(3)、对比强、弱酸的性质。构建模型可帮助理解问题。盐酸和醋酸的“冰山”理解模型如下图,回答问题:

①模型1表示的是(填序号)。
A.等浓度的盐酸和醋酸 B.等pH的盐酸和醋酸溶液
②等体积,pH均为1的盐酸和醋酸溶液,中和NaOH的能力比较:盐酸 . 醋酸(填“>”、“<”或“=”)。
③模型2表示的两种溶液中分别加水,醋酸溶液中 , (填“增大”、“减小”或“不变”)
④过量镁粉分别与2mL 2mol/L盐酸、2mL 2mol/L醋酸溶液反应,测得铁粉与盐酸反应生成气体体积随时间变化如图,在图中画出镁粉与醋酸溶液反应的图像。
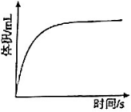 19. 滴定实验是化学学科中重要的定量实验。(1)、Ⅰ.酸碱中和滴定——已知某NaOH试样中含有NaCl杂质,为测定试样中NaOH的质量分数,进行如下步骤实验:
19. 滴定实验是化学学科中重要的定量实验。(1)、Ⅰ.酸碱中和滴定——已知某NaOH试样中含有NaCl杂质,为测定试样中NaOH的质量分数,进行如下步骤实验:①称量1.00g样品溶于水,配成250mL溶液;
②准确量取25.00mL所配溶液于锥形瓶中;
③滴加几滴甲基橙指示剂;
④用0.10mol/L的标准盐酸滴定三次,每次消耗盐酸的体积记录如下:
该酸碱中和滴定(题干中②③④步)所需仪器有____(填字母)。滴定序号
待测体积(mL)
消耗盐酸标准的体积(mL)
滴定前
滴定后
1
25.00
0.50
20.60
2
25.00
6.00
26.00
3
25.00
1.10
21.00
A、酸式滴定管(50mL) B、碱式滴定管(50mL) C、量筒(10mL) D、铁架台 E、滴定管夹 F、玻璃棒(2)、排去碱式滴定管中气泡的方法应采用操作。
甲 乙 丙
(3)、滴定达到终点的现象是。(4)、试样中NaOH的质量分数为。(5)、若出现下列情况,测定结果偏高的是。a.滴定前用蒸馏水冲洗锥形瓶
b.酸式滴定管滴至终点时,俯视读数
c.酸式滴定管用蒸馏水洗后,未用标准液润洗
d.酸式滴定管尖嘴部分有气泡,滴定后消失
(6)、Ⅱ.氧化还原滴定——取草酸( , 弱酸)溶液置于锥形瓶中,加入适量稀硫酸,用浓度为0.1的高锰酸钾溶液滴定。
发生反应的离子方程式为。(7)、滴定时,溶液应装在滴定管中(填“酸式”或“碱式”)。20. 氮是地球上含量丰富的一种元素,氮及其化合物是科学研究的重点内容。回答下列问题:
(1)、Ⅰ.已知NO和经反应Ⅰ和反应Ⅱ转化为 , 其能量变化如图所示:

Ⅰ. , 平衡常数;
Ⅱ.____ , 平衡常数;
写出第Ⅱ步反应的化学方程式:。(2)、反应的(填“>”或“<”)0,平衡常数K=(用含、的代数式表示)。下列措施既能提高该反应的平衡转化率,又能加快生成的反应速率的是(填字母)。a.升高温度 b.缩小容器体积 c.加入催化剂
(3)、由实验测得反应Ⅱ的~的关系如图所示,当x点升高到某一温度时,反应重新达到平衡,则变为相应的点为(填字母)。 (4)、Ⅱ.在0.5L的密闭容器中,一定量的氮气和氢气进行如下化学反应: , 其化学平衡常数K与温度T的关系如下表:
(4)、Ⅱ.在0.5L的密闭容器中,一定量的氮气和氢气进行如下化学反应: , 其化学平衡常数K与温度T的关系如下表:T/℃
200
300
400
K
0.5
请回答下列问题:
试比较、的大小,(填“>”、“=”或“<”)。
(5)、400℃时,反应的平衡常数K=。当测得、、的浓度分别为3、2、1时,则该反应的(填“>”、“=”或“<”)。(6)、下图为一定温度下,和以1∶3进行反应,平衡时,的体积分数随压强的变化示意图
①随压强增大,的体积分数增大的原因是。
②比较b点和a点:平衡常数 (填“>”、“=”或“<”,下同),的浓度。
③计算b点的平衡常数(用分压表示的平衡常数,结果保留2位有效数字)