广东省深圳市罗湖区2023-2024学年高二上学期12月阶段性考试化学试题
试卷更新日期:2024-01-02 类型:月考试卷
一、单选题(每题只有一个正确答案,前10题每题2分,后6题每题4分,共16题,满分44分.)
-
1. 化学与生产、生活息息相关.下列做法正确的是( )A、铵态氮肥和草木灰可以混合施用 B、废水中的、等离子可用处理 C、次氯酸钠溶液呈碱性,可用作胃酸中和剂 D、明矾溶于水形成胶体,可用于杀菌2. 醋酸在水溶液中存在下列电离平衡: , 下列说法不正确的是( )A、加入醋酸钠晶体后,溶液的增大 B、加入碳酸钠,平衡向右移动 C、升高温度,增大 D、加水稀释,溶液中和均减少3. 下列不能表明是弱电解质的是( )A、的溶液 B、溶液能与纯碱反应 C、室温下溶液呈碱性 D、常温下同浓度溶液的导电性比盐酸弱4. 在一定温度下,当固体在水溶液中达到平衡: , 要使固体减少而不变,可采取的措施是( )A、加固体 B、加盐酸 C、加少量水 D、加固体5. 配制一定物质的量浓度的NaOH溶液并用来滴定白醋样品,下列图示操作不能达到实验目的的是
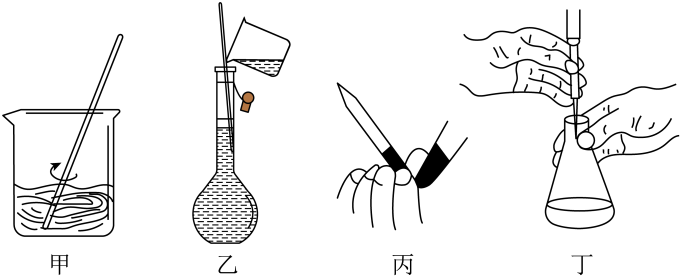 A、操作甲:用玻璃棒搅拌以加速NaOH固体溶解 B、操作乙:配制NaOH溶液时向容量瓶中加水至刻度线 C、操作丙:弯曲并挤压胶管中玻璃珠以排除滴定管尖端气泡 D、操作丁:滴定时滴入液体和摇动锥形瓶同时进行6. 下列关于离子方程式书写正确的是( )A、用溶液检测: B、溶于水后发生微弱水解: C、用饱和溶液处理水垢: D、溶液中的电离:7. 下列说法中正确的是( )A、的溶液一定呈酸性 B、将盐酸稀释至 , 所得溶液的为9 C、在常温下,当水电离出的为 , 时,此溶液的可能为1或13 D、将的盐酸与醋酸各分别稀释至 , 所得醋酸的略大8. 下列各图所示装置能达到实验目的的是( )
A、操作甲:用玻璃棒搅拌以加速NaOH固体溶解 B、操作乙:配制NaOH溶液时向容量瓶中加水至刻度线 C、操作丙:弯曲并挤压胶管中玻璃珠以排除滴定管尖端气泡 D、操作丁:滴定时滴入液体和摇动锥形瓶同时进行6. 下列关于离子方程式书写正确的是( )A、用溶液检测: B、溶于水后发生微弱水解: C、用饱和溶液处理水垢: D、溶液中的电离:7. 下列说法中正确的是( )A、的溶液一定呈酸性 B、将盐酸稀释至 , 所得溶液的为9 C、在常温下,当水电离出的为 , 时,此溶液的可能为1或13 D、将的盐酸与醋酸各分别稀释至 , 所得醋酸的略大8. 下列各图所示装置能达到实验目的的是( )A
B
C
D
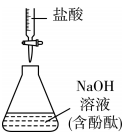
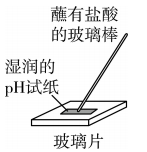
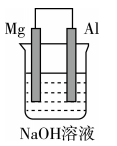

用已知浓度的盐酸测定溶液浓度
用pH试纸测定盐酸的pH
比较Mg和Al的金属性强弱
蒸干溶液制取无水
A、A B、B C、C D、D9. 下列关于盐类水解的应用,说法不正确的是( )A、除去溶液中的可加入后过滤 B、水溶液蒸发结晶能得到固体 C、工业上可利用水解制备 D、配制溶液时,先将固体溶于较浓的盐酸中10. 常温下,下列各组离子在指定条件下可能大量共存的是( )A、含有的溶液中:、、、 B、与反应能放出的溶液中:、、、 C、含有的溶液中:、、、 D、使甲基橙变红的溶液中:、、、11. 由下列实验及现象不能推出相应结论的是( )选项
实验操作
实验现象
解释或结论
A
向溶液中加入的溶液
有无色气体生成
酸性:
B
含和的浊液中通入气体
生成黑色沉淀
溶解度:
C
向均盛有溶液的两支试管中分别滴入和溶液1mL
前者产生气泡的速率更快
催化效果:
D
向浓度均为的和混合溶液中滴加少量溶液
先出现黄色沉淀
A、A B、B C、C D、D12. 、、分别表示酸的电离常数、水的离子积常数、溶度积常数,下列判断正确的是( )A、室温下 , 说明的电离度一定比的大 B、室温下向的醋酸溶液中加入水稀释后,溶液中不变 C、25℃时,均为4的盐酸和溶液中不相等 D、两种难溶电解质做比较时,越小的电解质,其溶解度一定越小13. 下列说法中正确的是( )A、的溶液中: B、浓度均为的①②③④ , 由小到大的顺序:④<③<①<② C、向、的混合饱和溶液中加入少量 , 溶液中减小 D、溶液中离子浓度大小顺序为14. 常温下, , 常温下在水中的沉淀溶解平衡曲线如图所示.下列说法正确的是( )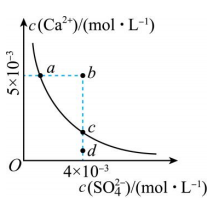 A、加入可使溶液由a点变到b点 B、b点将有沉淀生成,平衡后溶液中一定等于 C、d点溶液通过蒸发可以变到c点 D、a点对应的等于c点对应的15. 甲烷燃料电池的工作原理如图,下列说法正确的是( )
A、加入可使溶液由a点变到b点 B、b点将有沉淀生成,平衡后溶液中一定等于 C、d点溶液通过蒸发可以变到c点 D、a点对应的等于c点对应的15. 甲烷燃料电池的工作原理如图,下列说法正确的是( )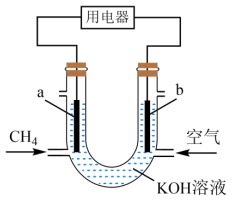 A、a极为正极 B、从b极经溶液流向a极 C、工作一段时间后,b极附近的pH会增大 D、a极的电极反应为16. 常温下,用溶液滴定(二元弱酸)溶液所得滴定曲线如图(混合溶液的体积可看成混合前溶液的体积之和).下列说法正确的是( )
A、a极为正极 B、从b极经溶液流向a极 C、工作一段时间后,b极附近的pH会增大 D、a极的电极反应为16. 常温下,用溶液滴定(二元弱酸)溶液所得滴定曲线如图(混合溶液的体积可看成混合前溶液的体积之和).下列说法正确的是( )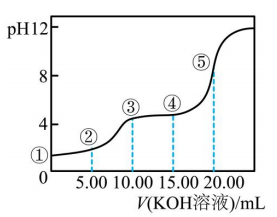 A、点①所示溶液中: B、点②所示溶液中: C、点③所示溶液中: D、点④所示溶液中:
A、点①所示溶液中: B、点②所示溶液中: C、点③所示溶液中: D、点④所示溶液中:二、填空题(14分)
-
17. 电化学手段对于研究物质性质以及工业生产中都有重要价值.(1)、Ⅰ.结合所学知识,按要求回答问题.
按要求写出电极反应式①碱性锌锰电池的总反应为 ,
写出正极反应式.
(2)、Ⅱ.载人航天工程对科学研究及太空资源开发具有重要意义,其发展水平是衡量一个国家综合国力的重要指标.中国正在逐步建立自己的载人空间站“天宫”,神舟十三号载人飞船在北京时间10月16日0时23分点火发射,又一次正式踏上飞向浩挱星辰的征途.
氢氧燃料电池(构造示意图如图)单位质量输出电能较高,反应生成的水可作为航天员的饮用水,氧气可以作为备用氧源供给航天员呼吸.由此判断X极为电池的极,向(填“正”或“负”)极作定向移动,Y极的电极反应式为. (3)、在宇宙飞船或潜艇中,还可利用氢氧燃料电池所产生的水作为饮用水,今欲得常温下1.8L水,则电池内电子转移的物质的量约为mol(4)、“神舟”飞船的电源系统共有3种,分别是太阳能电池帆板、镉镍蓄电池和应急电池.飞船在光照区运行时,太阳能电池帆板将能转化为电能,除供给飞船使用外,多余部分用镉镍蓄电池储存起来.其工作原理为: , 当飞船运行到地影区时,镉镍蓄电池开始为飞船供电,此时负极附近溶液的碱性(填“增大”“减小”或“不变”).
(3)、在宇宙飞船或潜艇中,还可利用氢氧燃料电池所产生的水作为饮用水,今欲得常温下1.8L水,则电池内电子转移的物质的量约为mol(4)、“神舟”飞船的电源系统共有3种,分别是太阳能电池帆板、镉镍蓄电池和应急电池.飞船在光照区运行时,太阳能电池帆板将能转化为电能,除供给飞船使用外,多余部分用镉镍蓄电池储存起来.其工作原理为: , 当飞船运行到地影区时,镉镍蓄电池开始为飞船供电,此时负极附近溶液的碱性(填“增大”“减小”或“不变”).三、实验探究题(14分)
-
18. 草酸是一种易溶于水的二元有机弱酸,常用作还原剂、沉淀剂等,可与酸性溶液发生反应:.(1)、探究外界条件对反应速率的影响.
实验编号
所加试剂及用量/mL
条件
溶液颜色褪至无色所需时间/min
溶液
溶液
稀
水
温度℃
1
12.0
2.0
3.0
3.0
20
2
6.0
2.0
3.0
20
3
2.0
3.0
9.0
30
①完成此实验设计,其中: , .
②对比实验1、2可探究对反应速率的影响.
(2)、某兴趣小组用草酸及草酸盐的性质测定硬水中钙离子的浓度.
根据消耗酸性标准溶液的体积即可测定硬水样品中的浓度.
①实验过程提及的下列仪器,在使用之前一定要润洗的是(填字母).
A.容量瓶 B.烧杯 C.锥形瓶 D.滴定管
②滴定过程中(填“需要”或“不需要”)另加指示剂,如何判断滴定终点.
③本实验滴定管起点和终点的液面位置如图所示,则滴定过程中消耗的标准溶液为.该硬水样品中的浓度为.

④下列不当操作会使测得的硬水样品的浓度偏高的是(填字母)
A.滴定管未用标准溶液润洗 B.草酸钙沉淀洗涤不充分
C.滴定前仰视读数并记录数据 D.盛放草酸溶液的锥形瓶没有干燥
四、工业流程题(14分)
-
19. 碱式碳酸铜可用作有机催化剂.工业上以辉铜矿(主要成分为 , 含及少量)为原料制备碱式碳酸铜,工业流程如下:
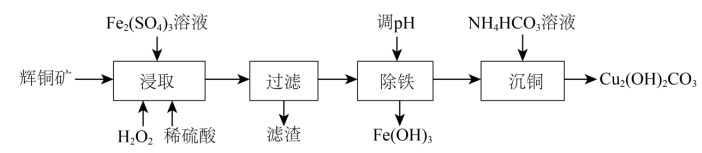 (1)、滤渣可能含S、(填化学式).(2)、①“浸取”时能提高辉铜矿浸取率的措施有(填2条).
(1)、滤渣可能含S、(填化学式).(2)、①“浸取”时能提高辉铜矿浸取率的措施有(填2条).②某小组测得浸取率随浓度及温度影响的变化曲线如下:

图一 图二
由图一可知适宜的浓度范围为;由图一中的a点分析,浸取时也起到了氧化辉铜矿的作用,该反应的离子方程式为;
图二中高于85℃时浸取率下降的原因是.
(3)、“除铁”步骤调可加入试剂(填选项字母);a.氨气 b. c. d.
(4)、常温下,“过滤”后的滤液中 , 则“除铁”步骤调应小于[常温下,].五、原理综合题(14分)
-
20. 的回收与利用是科学家研究的热点课题.工业上有一种用生产甲醇燃料的方法:.将和充入的恒温刚性密闭容器中,测得的氢气物质的量随时间变化如图所示(实线).
 (1)、下列说法能表明该反应已经达到平衡状态的是____(填序号).A、 B、混合气体的平均相对分子质量不变 C、保持不变 D、压强保持不变(2)、a点正反应速率(填“>”、“<”或“=”)b点逆反应速率,前内.用表示的平均反应速率为.(保留两位有效数字)(3)、平衡时的转化率为 , 该条件下反应的平衡常数.(4)、若温度不变达到平衡后往容器中分别充入 , 各 , 请问(填“>”、“<”或“=”).(5)、仅改变某一实验条件再进行实验,测得的物质的量随时间变化如图中虚线所示,对应的实验条件改变的是.
(1)、下列说法能表明该反应已经达到平衡状态的是____(填序号).A、 B、混合气体的平均相对分子质量不变 C、保持不变 D、压强保持不变(2)、a点正反应速率(填“>”、“<”或“=”)b点逆反应速率,前内.用表示的平均反应速率为.(保留两位有效数字)(3)、平衡时的转化率为 , 该条件下反应的平衡常数.(4)、若温度不变达到平衡后往容器中分别充入 , 各 , 请问(填“>”、“<”或“=”).(5)、仅改变某一实验条件再进行实验,测得的物质的量随时间变化如图中虚线所示,对应的实验条件改变的是.
-
-
-