浙江省安吉县2023-2024学年高一上学期12月统一检测化学试题
试卷更新日期:2024-01-02 类型:月考试卷
一、选择题(本大题共25小题,每小题2分,共50分)
-
1. 下列物质属于酸性氧化物的是( )A、CO2 B、Na2O2 C、NO D、Fe2O32. 下列仪器与名称对应且书写正确的是( )A、三脚架
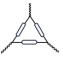 B、坩埚
B、坩埚 C、长颈漏斗
C、长颈漏斗 D、圆底烧瓶
D、圆底烧瓶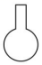 3. 下列物质能导电且属于电解质的是( )A、NaCl固体 B、石墨 C、KNO3溶液 D、熔融的MgCl24. 下列反应属于氧化还原反应的是( )A、 B、 C、 D、5. 下列物质在水溶液中的电离方程式不正确的是( )A、 B、 C、 D、6. 微纳米材料研究所研发的纳米量级碳酸钙直径约为30 nm,下列有关说法正确的是( )A、纳米量级碳酸钙是一种胶体 B、若将纳米量级碳酸钙均匀分散到蒸馏水中,不能透过滤纸 C、若将纳米量级碳酸钙加入稀盐酸中,不会有二氧化碳产生 D、若将纳米量级碳酸钙均匀分散到蒸馏水中,会产生丁达尔效应7. 34号元素硒(Se)是人体必需的微量元素,其最外层有6个电子。下列有关说法不正确的是( )A、Se元素位于元素周期表第四周期第ⅥA族 B、H2Se的还原性比H2O的还原性强 C、和互为同位素 D、原子中质子数为34,中子数为788. 下列关于钠及其化合物的性质及用途的说法不正确的是( )A、相同温度时,在水中的溶解性:NaHCO3<Na2CO3 B、向碳酸钠中加入少量水后,碳酸钠会结块变为晶体,并伴随有吸热现象 C、过氧化钠可在呼吸面具中作为氧气的来源 D、存有金属钠的现场发生火灾时,不能用水来灭火9. 下列物质或试剂加到紫色石蕊溶液中,不能使其褪色的是( )A、新制氯水 B、久置氯水 C、过氧化钠 D、漂白粉10. 用下列装置进行实验,能达到实验目的的是( )
3. 下列物质能导电且属于电解质的是( )A、NaCl固体 B、石墨 C、KNO3溶液 D、熔融的MgCl24. 下列反应属于氧化还原反应的是( )A、 B、 C、 D、5. 下列物质在水溶液中的电离方程式不正确的是( )A、 B、 C、 D、6. 微纳米材料研究所研发的纳米量级碳酸钙直径约为30 nm,下列有关说法正确的是( )A、纳米量级碳酸钙是一种胶体 B、若将纳米量级碳酸钙均匀分散到蒸馏水中,不能透过滤纸 C、若将纳米量级碳酸钙加入稀盐酸中,不会有二氧化碳产生 D、若将纳米量级碳酸钙均匀分散到蒸馏水中,会产生丁达尔效应7. 34号元素硒(Se)是人体必需的微量元素,其最外层有6个电子。下列有关说法不正确的是( )A、Se元素位于元素周期表第四周期第ⅥA族 B、H2Se的还原性比H2O的还原性强 C、和互为同位素 D、原子中质子数为34,中子数为788. 下列关于钠及其化合物的性质及用途的说法不正确的是( )A、相同温度时,在水中的溶解性:NaHCO3<Na2CO3 B、向碳酸钠中加入少量水后,碳酸钠会结块变为晶体,并伴随有吸热现象 C、过氧化钠可在呼吸面具中作为氧气的来源 D、存有金属钠的现场发生火灾时,不能用水来灭火9. 下列物质或试剂加到紫色石蕊溶液中,不能使其褪色的是( )A、新制氯水 B、久置氯水 C、过氧化钠 D、漂白粉10. 用下列装置进行实验,能达到实验目的的是( )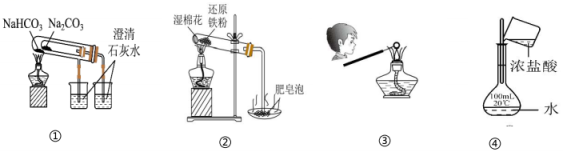 A、用图①比较Na2CO3和NaHCO3的稳定性 B、用图②装置进行铁与水蒸气的反应,点燃肥皂泡检验氢气 C、用图③装置乙检验草木灰中含有 D、用图④浓盐酸配制一定物质的量浓度的稀盐酸11. 工业废水中含有重铬酸根离子(),有毒,必须处理达标后才能排放。工业上常用绿矾()做处理剂,反应的原理为:。下列关于该反应的说法中,正确的是( )A、氧化剂是 B、每处理1 mol , 需要消耗 56 g C、氧化性强弱: D、每处理0.1 mol , 转移电子数为12. 表示阿伏加德罗常数的值,下列说法正确的是( )A、3.36 L NH3气体中含氮原子个数为 B、与NaOH反应时,每消耗1 mol Cl2转移电子数目为 C、48 g由O2和O3组成的混合气体中含有的原子数为 D、常温常压下,1 mol/L的NaCl溶液中含有个13. 下列溶液中浓度与50 mL 1.5 mol/L Na2SO4溶液中浓度相等的是( )A、75 mL 1 mol/L的FeSO4溶液 B、25 mL 3 mol/L K2SO4溶液 C、150 mL 0.5 mol/L的溶液 D、150 mL 0.5 mol/L的H2SO4溶液14. 下列各组离子在对应条件下能大量共存的是( )A、在pH=1的溶液中:、、、 B、无色澄清溶液:、、、 C、遇酚酞变红的溶液:、、、 D、遇石蕊变红的溶液:、、、15. 下列离子方程式中,正确的是( )A、用氯化铁溶液腐蚀覆铜板: B、氯气溶于水发生反应: C、向氯化铝溶液中滴加氨水: D、向硫酸氢钠溶液中加入至硫酸根离子恰好沉淀完全:16. 周期表中同族元素的原子结构相似,在性质上具有相似性和递变性。下列说法不正确的是( )A、钠燃烧生成Na2O2 , 锂燃烧也能生成Li2O2 B、钠与水能反应生成NaOH和H2 , 钾也能与水反应生成KOH和H2 C、氯气能与铁反应生成FeCl3 , 溴单质也能与铁反应生成FeBr3 D、氯气与冷的NaOH稀溶液反应生成NaCl和NaClO,溴单质与冷的NaOH稀溶液也反应生成NaBr和NaBrO17. 向一定体积的M溶液中逐滴加入N溶液,测得混合溶液的导电能力随时间变化的曲线如图示,则M、N可能是下列哪种组合( )
A、用图①比较Na2CO3和NaHCO3的稳定性 B、用图②装置进行铁与水蒸气的反应,点燃肥皂泡检验氢气 C、用图③装置乙检验草木灰中含有 D、用图④浓盐酸配制一定物质的量浓度的稀盐酸11. 工业废水中含有重铬酸根离子(),有毒,必须处理达标后才能排放。工业上常用绿矾()做处理剂,反应的原理为:。下列关于该反应的说法中,正确的是( )A、氧化剂是 B、每处理1 mol , 需要消耗 56 g C、氧化性强弱: D、每处理0.1 mol , 转移电子数为12. 表示阿伏加德罗常数的值,下列说法正确的是( )A、3.36 L NH3气体中含氮原子个数为 B、与NaOH反应时,每消耗1 mol Cl2转移电子数目为 C、48 g由O2和O3组成的混合气体中含有的原子数为 D、常温常压下,1 mol/L的NaCl溶液中含有个13. 下列溶液中浓度与50 mL 1.5 mol/L Na2SO4溶液中浓度相等的是( )A、75 mL 1 mol/L的FeSO4溶液 B、25 mL 3 mol/L K2SO4溶液 C、150 mL 0.5 mol/L的溶液 D、150 mL 0.5 mol/L的H2SO4溶液14. 下列各组离子在对应条件下能大量共存的是( )A、在pH=1的溶液中:、、、 B、无色澄清溶液:、、、 C、遇酚酞变红的溶液:、、、 D、遇石蕊变红的溶液:、、、15. 下列离子方程式中,正确的是( )A、用氯化铁溶液腐蚀覆铜板: B、氯气溶于水发生反应: C、向氯化铝溶液中滴加氨水: D、向硫酸氢钠溶液中加入至硫酸根离子恰好沉淀完全:16. 周期表中同族元素的原子结构相似,在性质上具有相似性和递变性。下列说法不正确的是( )A、钠燃烧生成Na2O2 , 锂燃烧也能生成Li2O2 B、钠与水能反应生成NaOH和H2 , 钾也能与水反应生成KOH和H2 C、氯气能与铁反应生成FeCl3 , 溴单质也能与铁反应生成FeBr3 D、氯气与冷的NaOH稀溶液反应生成NaCl和NaClO,溴单质与冷的NaOH稀溶液也反应生成NaBr和NaBrO17. 向一定体积的M溶液中逐滴加入N溶液,测得混合溶液的导电能力随时间变化的曲线如图示,则M、N可能是下列哪种组合( ) A、HCl、NaOH B、H2SO4、 C、AgNO3、NaCl D、BaCl2、Na2CO318. 同温同压下,下列关于相同质量的NH3和H2S说法正确的是( )A、体积之比为1∶2 B、密度之比为1∶2 C、物质的量之比为1∶2 D、原子个数之比为3∶819. 使用容量瓶配制溶液时,下列操作会使所配溶液浓度偏高的是( )A、用天平称量固体时,砝码放在了左盘,药品放在了右盘 B、转移溶液前容量瓶内有少量蒸馏水 C、定容时,俯视容量瓶的刻度线 D、定容后摇匀,发现液面降低,又补加少量水,重新达到刻度线20. 自来水是自然界中的淡水经过絮凝、沉淀、过滤、消毒等工艺处理后得到的。高铁酸钾(K2FeO4 , 极易溶于水)是常见的水处理剂,其原理如图所示。下列说法正确的是( )
A、HCl、NaOH B、H2SO4、 C、AgNO3、NaCl D、BaCl2、Na2CO318. 同温同压下,下列关于相同质量的NH3和H2S说法正确的是( )A、体积之比为1∶2 B、密度之比为1∶2 C、物质的量之比为1∶2 D、原子个数之比为3∶819. 使用容量瓶配制溶液时,下列操作会使所配溶液浓度偏高的是( )A、用天平称量固体时,砝码放在了左盘,药品放在了右盘 B、转移溶液前容量瓶内有少量蒸馏水 C、定容时,俯视容量瓶的刻度线 D、定容后摇匀,发现液面降低,又补加少量水,重新达到刻度线20. 自来水是自然界中的淡水经过絮凝、沉淀、过滤、消毒等工艺处理后得到的。高铁酸钾(K2FeO4 , 极易溶于水)是常见的水处理剂,其原理如图所示。下列说法正确的是( )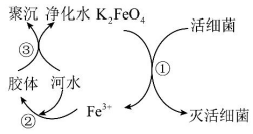 A、K2FeO4的摩尔质量为198 B、K2FeO4具有强氧化性 C、此过程中Fe元素被氧化 D、该处理剂能净水的原因是生成了沉淀21. 下列各组物质之间通过一步反应不能实现如图所示转化关系的是( )
A、K2FeO4的摩尔质量为198 B、K2FeO4具有强氧化性 C、此过程中Fe元素被氧化 D、该处理剂能净水的原因是生成了沉淀21. 下列各组物质之间通过一步反应不能实现如图所示转化关系的是( )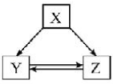
选项
X
Y
Z
A
C
CO
CO2
B
Fe
FeCl2
FeCl3
C
Na2O2
NaOH
Na2CO3
D
Al2O3
Al(OH)3
AlCl3
A、A B、B C、C D、D22. 将新制氯水置于三颈瓶内,将pH传感器、氯离子传感器、氧气传感器分别插入三颈瓶中(如左下图),用强光照射氯水,进行实验并采集数据,获得相关变化曲线(如右下图)。若能够证明氯水中HClO在光照下发生了分解反应,则右下图中纵坐标不可以表示的物理量是( ) A、氯离子的浓度 B、氧气的体积分数 C、氢离子的浓度 D、氯气分子的浓度23. X、Y、Z、W均为短周期元素,它们在元素周期表中的相对位置如图所示。若Z原子的最外层电子数是最内层电子数的3倍,下列说法正确的是( )
A、氯离子的浓度 B、氧气的体积分数 C、氢离子的浓度 D、氯气分子的浓度23. X、Y、Z、W均为短周期元素,它们在元素周期表中的相对位置如图所示。若Z原子的最外层电子数是最内层电子数的3倍,下列说法正确的是( )X
Y
Z
W
A、简单气态氢化物的稳定性:X>Y B、原子半径:X<Z<W C、Z的氧化物对应的水化物是强酸 D、W的单质具有强氧化性24. 在不同温度、浓度的条件下,Cl2与NaOH溶液的反应,可以生成NaClO或NaClO3。现将氯气缓缓通入冷NaOH溶液,测得、物质的量n(mol)与反应时间t(min)的关系曲线如图。下列说法不正确的是( ) A、之前发生的反应: B、a点时溶液中 C、 , 离子的物质的量下降的原因可能是发生反应: D、整个过程,参加反应所需NaOH与氯气的物质的量之比为2∶125. 下列实验方案设计、现象和结论都正确的是( )
A、之前发生的反应: B、a点时溶液中 C、 , 离子的物质的量下降的原因可能是发生反应: D、整个过程,参加反应所需NaOH与氯气的物质的量之比为2∶125. 下列实验方案设计、现象和结论都正确的是( )选项
方案设计
现象
结论
A
向Na2CO3溶液中滴加酚酞溶液
溶液颜色变为红色
Na2CO3属于碱
B
向FeCl3和CuCl2的混合溶液中加少量铁粉
反应结束后无固体剩余
的氧化性强于
C
向FeSO4溶液中依次加入氯水、KSCN溶液
溶液变红色
该FeSO4溶液已变质
D
向某溶液中滴加盐酸,将产生的气体通入澄清石灰水中
澄清石灰水变浑浊
溶液中含有
A、A B、B C、C D、D二、填空题(共3小题,30分)
-
26. 完成下列小题(1)、侯氏制碱法所制的“碱”的化学式为。(2)、向碳酸钠溶液中通入CO2的离子方程式为:。(3)、工业制漂白粉的化学方程式为:。27. 利用铁元素价类二维图可多角度研究含铁物质的性质及其转化关系,完成下列问题。
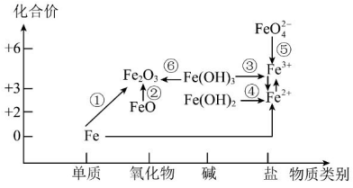 (1)、下列物质中的铁元素只有还原性的是____(填字母)。A、Fe B、FeSO4 C、FeCl3 D、Fe2O3(2)、4.8克Fe2O3中Fe元素的物质的量为mol。(3)、下列有关说法正确的是____。A、纯净的铁是银白色的 B、FeO不稳定,在空气中受热能迅速被氧化成Fe2O3 C、FeO、Fe2O3均属于碱性氧化物 D、除去FeCl2溶液中混有的少量CuCl2杂质,可以向混合液中加入NaOH(4)、是一种白色固体,实验室制时会显红褐色,原因是(用化学方程式表示)。(5)、设计实验证明某待测溶液中存在:。(6)、酸性高锰酸钾溶液具有强氧化性,将它滴入FeSO4溶液中时,溶液变为棕黄色。请补充并配平下列离子方程式:28. 已知短周期元素W、X、Y、Z、M、Q和R在周期表中的相对位置如下所示。
(1)、下列物质中的铁元素只有还原性的是____(填字母)。A、Fe B、FeSO4 C、FeCl3 D、Fe2O3(2)、4.8克Fe2O3中Fe元素的物质的量为mol。(3)、下列有关说法正确的是____。A、纯净的铁是银白色的 B、FeO不稳定,在空气中受热能迅速被氧化成Fe2O3 C、FeO、Fe2O3均属于碱性氧化物 D、除去FeCl2溶液中混有的少量CuCl2杂质,可以向混合液中加入NaOH(4)、是一种白色固体,实验室制时会显红褐色,原因是(用化学方程式表示)。(5)、设计实验证明某待测溶液中存在:。(6)、酸性高锰酸钾溶液具有强氧化性,将它滴入FeSO4溶液中时,溶液变为棕黄色。请补充并配平下列离子方程式:28. 已知短周期元素W、X、Y、Z、M、Q和R在周期表中的相对位置如下所示。W
Z
M
X
Y
Q
R
请填写下列空白:
(1)、元素Q在周期表中的位置为 , Z的原子结构示意图为。(2)、下列说法不正确的是____。A、常温时,X单质能与水发生剧烈反应 B、气态氢化物的稳定性:Z<M C、Y的最高价氧化物对应水化物是强碱 D、R的单质具有漂白性(3)、X、Z、M元素的原子半径由小到大的顺序为(用元素符号表示)。(4)、Z、M分别与W形成含10个电子分子的化学式是、。(5)、写出Y的氧化物与X的最高价氧化物对应水化物反应的化学方程式。三、实验题(14分)
-
29. 氯酸锶[]白色结晶粉末,主要用于制造红色烟火。下图为实验室制取氯酸锶的实验装置图,请回答下列问题:
 (1)、仪器b的名称是。(2)、A中发生反应的离子方程式为。(3)、装置B中所装试剂名称为: , 其作用是。(4)、装置C中发生反应的化学方程式为:。(5)、装置D中反应一段时间后,可观察到装置D中红色逐渐褪去,某实验小组的同学对红色突然褪去的原因进行猜想,请补充猜想并回答问题:
(1)、仪器b的名称是。(2)、A中发生反应的离子方程式为。(3)、装置B中所装试剂名称为: , 其作用是。(4)、装置C中发生反应的化学方程式为:。(5)、装置D中反应一段时间后,可观察到装置D中红色逐渐褪去,某实验小组的同学对红色突然褪去的原因进行猜想,请补充猜想并回答问题:猜想一:氯水中的酸或氯分子与NaOH发生反应,将NaOH消耗所致;
猜想二:。
假如猜想一成立,请设计实验证明该猜想红色褪去的原因:。
四、计算题(6分)
-
30. NaHCO3不稳定,受热易分解,现有2.96 g未完全分解的碳酸氢钠样品,欲测定其分解率,将其完全溶于水制成溶液,然后向此溶液中缓慢滴加稀盐酸,并不断搅拌。溶液中有关离子的物质的量随盐酸加入的变化如图所示,则
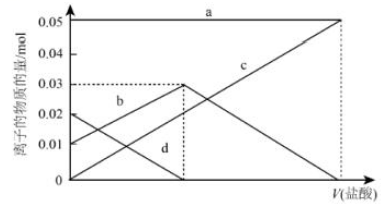 (1)、NaHCO3受热分解的方程式为。(2)、a、d对应的离子分别是、(填离子符号)。(3)、原NaHCO3的分解率为。
(1)、NaHCO3受热分解的方程式为。(2)、a、d对应的离子分别是、(填离子符号)。(3)、原NaHCO3的分解率为。
-