江苏省苏州市高新区2023-2024学年九年级上学期化学期中阳光调研试卷
试卷更新日期:2024-01-02 类型:期中考试
一、单项选择题(包括20题,每题2分,共40分.每题只有一个选项符合题意)
-
1. 杭州亚运会秉承了绿色办亚运的理念。下列做法不符合绿色亚运理念的是( )A、植树种草,增加绿地面积 B、垃圾分类投放,并露天焚烧 C、工厂废气处理达标后排放 D、鼓励乘坐公交车或骑自行车出行2. 苏州拥有众多非物质文化遗产项目。下列过程涉及化学变化的是( )A、雕刻木版年画 B、手捏雕绣花边 C、烧制御窑金砖 D、缂织蚕丝书画3. 下列常见的物质由原子构成的是( )A、水 B、金刚石 C、氯化钠 D、二氧化硫4. 分类是一种行之有效,简单易行的科学方法。从组成角度,KClO3不属于( )A、纯净物 B、化合物 C、含氧化合物 D、氧化物5. 下列仪器对应的名称正确的是( )A、
 B、
B、 C、
C、 D、
D、 6. 下列有关化学用语表示正确的是( )A、铝元素:AL B、水分子:H2O C、2个氢原子:H2 D、碳酸钠:NaCO37. 下列物质的性质与用途具有对应关系的是( )A、金刚石具有光学特性,可用于切割玻璃 B、镁有银白色光泽,可用作制烟花 C、干冰易升华吸热,可用作制冷剂 D、碳酸氢铵受热易分解,可用作氮肥8. 天津大学研制出一种新型催化剂Ag/In2O3。In2O3中In的化合价为( )A、+3 B、0 C、+6 D、+29. 阅读下列材料,回答第9~11题:过氧化氢易溶于水,其水溶液俗称双氧水,对金属有一定腐蚀性。通常情况下,双氧水会缓慢分解成水和氧气,光照条件或二氧化锰等物质会加快其分解速率。在实验室中,常用双氧水中加二氧化锰催化剂的方法来制取氧气。
6. 下列有关化学用语表示正确的是( )A、铝元素:AL B、水分子:H2O C、2个氢原子:H2 D、碳酸钠:NaCO37. 下列物质的性质与用途具有对应关系的是( )A、金刚石具有光学特性,可用于切割玻璃 B、镁有银白色光泽,可用作制烟花 C、干冰易升华吸热,可用作制冷剂 D、碳酸氢铵受热易分解,可用作氮肥8. 天津大学研制出一种新型催化剂Ag/In2O3。In2O3中In的化合价为( )A、+3 B、0 C、+6 D、+29. 阅读下列材料,回答第9~11题:过氧化氢易溶于水,其水溶液俗称双氧水,对金属有一定腐蚀性。通常情况下,双氧水会缓慢分解成水和氧气,光照条件或二氧化锰等物质会加快其分解速率。在实验室中,常用双氧水中加二氧化锰催化剂的方法来制取氧气。下列容器中,最适合盛放双氧水的是( )
A、棕色广口瓶 B、无色细口瓶 C、棕色细口瓶 D、金属容器10. 在双氧水制取氧气实验中,一定不需用到的仪器是( )A、酒精灯 B、水槽 C、集气瓶 D、锥形瓶11. 下列有关催化剂的叙述正确的是( )A、加入二氧化锰不能使双氧水分解出来的氧气总量增加 B、二氧化锰是所有反应的催化剂 C、催化剂能改变化学反应速率,所有反应都需要催化剂 D、要使双氧水分解放出氧气,必须要加入二氧化锰,否则反应就不能发生12. 下列有关硬水性质实验的操作正确的是( )A、吸取水样 B、滴肥皂水
B、滴肥皂水 C、振荡
C、振荡 D、加热水样
D、加热水样 13. 由太湖水生产自来水的部分处理过程如下。有关说法不正确的是( )
13. 由太湖水生产自来水的部分处理过程如下。有关说法不正确的是( ) A、用细沙“过滤”可滤除水中的细小颗粒 B、活性炭“吸附”可除去水中的色素和异味 C、上述处理过程应包含“蒸馏” D、经过处理获得的自来水仍是混合物14. 《杭州亚运会药品指南》明确了亚运会期间运动员的用药清单。阿司匹林(C9H8O4)具有解热、镇痛和抗炎的功效,属于安全用药。下列关于阿司匹林的说法正确的是( )A、阿司匹林中含21种元素 B、阿司匹林由碳原子、氢原子和氧原子构成 C、H、O原子个数比为1:8 D、相对分子质量为18015. 在“做实验”中“学化学”是化学学习的主要方法。下列做法正确的是( )A、为了现象明显,取用的试剂越多越好 B、为了获得感性认识,可以触摸药品或品尝药品的味道 C、为了安全,给试管里的液体加热时,试管口不能朝着自己或别人 D、为了方便,熄灭酒精灯时,直接用嘴巴吹灭16. 鉴别下列各组物质,所选用的试剂或方法不正确的是( )A、空气和二氧化碳:紫色石蕊试液 B、酒精和白醋:闻气味 C、水和浓氮水:酚酞试液 D、氧化铜和四氧化三铁:看颜色17. “碳海绵”是已知最轻的固体材料,密度仅0.16mg·cm-3。其主要成分是石墨烯和碳纳米管等两种碳单质,是一种良好的绝缘材料。下列关于“碳海绵”性质的推测不正确的是( )A、碳海绵能浮在水面上 B、碳海绵是一种新型的化合物 C、碳海绵不易导电 D、碳海绵燃烧会产生二氧化碳18. 科学家利用“N-掺杂石墨烯量子点”作催化剂,将二氧化碳转化为乙醇,其微观示意图如下图所示。下列说法正确的是( )
A、用细沙“过滤”可滤除水中的细小颗粒 B、活性炭“吸附”可除去水中的色素和异味 C、上述处理过程应包含“蒸馏” D、经过处理获得的自来水仍是混合物14. 《杭州亚运会药品指南》明确了亚运会期间运动员的用药清单。阿司匹林(C9H8O4)具有解热、镇痛和抗炎的功效,属于安全用药。下列关于阿司匹林的说法正确的是( )A、阿司匹林中含21种元素 B、阿司匹林由碳原子、氢原子和氧原子构成 C、H、O原子个数比为1:8 D、相对分子质量为18015. 在“做实验”中“学化学”是化学学习的主要方法。下列做法正确的是( )A、为了现象明显,取用的试剂越多越好 B、为了获得感性认识,可以触摸药品或品尝药品的味道 C、为了安全,给试管里的液体加热时,试管口不能朝着自己或别人 D、为了方便,熄灭酒精灯时,直接用嘴巴吹灭16. 鉴别下列各组物质,所选用的试剂或方法不正确的是( )A、空气和二氧化碳:紫色石蕊试液 B、酒精和白醋:闻气味 C、水和浓氮水:酚酞试液 D、氧化铜和四氧化三铁:看颜色17. “碳海绵”是已知最轻的固体材料,密度仅0.16mg·cm-3。其主要成分是石墨烯和碳纳米管等两种碳单质,是一种良好的绝缘材料。下列关于“碳海绵”性质的推测不正确的是( )A、碳海绵能浮在水面上 B、碳海绵是一种新型的化合物 C、碳海绵不易导电 D、碳海绵燃烧会产生二氧化碳18. 科学家利用“N-掺杂石墨烯量子点”作催化剂,将二氧化碳转化为乙醇,其微观示意图如下图所示。下列说法正确的是( )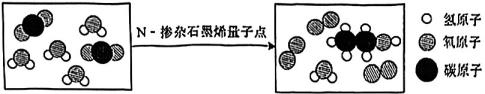 A、生成物有3种 B、反应前后分子的数目不发生改变 C、有单质生成 D、反应前后“N-掺杂石墨烯量子点”质量发生改变19. 比较、推理是化学学习常用的方法,下列推理不合理的是( )
A、生成物有3种 B、反应前后分子的数目不发生改变 C、有单质生成 D、反应前后“N-掺杂石墨烯量子点”质量发生改变19. 比较、推理是化学学习常用的方法,下列推理不合理的是( )序号
实验事实
影响化学反应的因素
A
镁能与白醋反应,铜不能与白醋反应
反应物的种类
B
碳在常温下不与氧气发生反应,点燃时能与氧气反应
温度
C
双氧水在常温下缓慢分解,加入二氧化锰后迅速分解
有、无催化剂
D
铜片在空气中很难燃烧,铜粉在氧气中易燃烧
反应物的接触面积
A、A B、B C、C D、D20. 某兴趣小组用如图-1的装置探究氧气的性质。用隔板插入细沙分成两部分,将氧气倒入倾倒室,一段时间后提起隔板,测得倾倒室内氧气浓度变化情况如图-2所示。下列与实验相关的说法不正确的是( ) A、空气中氧气的浓度大约为20% B、MN段曲线快速上升,说明氧气的密度比空气大 C、实验中“提起隔板”操作对应的时间点约在第25s D、NP段蜡烛燃烧越来越微弱,最后在P点熄灭
A、空气中氧气的浓度大约为20% B、MN段曲线快速上升,说明氧气的密度比空气大 C、实验中“提起隔板”操作对应的时间点约在第25s D、NP段蜡烛燃烧越来越微弱,最后在P点熄灭二、非选择题(共60分)
-
21. 中华文化博大精深,茶道、中医等处处皆蕴含着古代劳动人民的智慧。(1)、茶韵悠长
唐代陆羽煎茶“清汤绿叶,味鲜醇,香扑鼻”。《茶经》中记载“风能兴火,火能熟水。”“漉水囊……其格以生铜铸之”。
①“香扑鼻”,说明分子在。
②“火能熟水”说明燃烧(填“吸收”或“放出”)热量。
③“漉水囊”可将茶叶与茶水分离,类似于基本实验中的操作。
(2)、妙手回春炉甘石始载于《外丹本草》,主要成分为碳酸锌(ZnCO3)和碱式碳酸锌[Zn2(OH)2CO3],炮制后主要成分为氧化锌(ZnO),可作为外用药使用。

①锌元素属于人体必需的(填“常量”或“微量”)元素。锌元素信息如图所示,下列说法不正确的是(填字母)。
a.锌原子的质量为65.38g
b.锌的原子序数为30c.锌原子核外有四层电子
d.锌原子在反应中易失去电子②氧化锌、碳酸锌、碱式碳酸锌都有一定的抑菌活性,药效高低与锌元素的含量相关,含量越高,抑菌活性效果越好。相同质量的三种物质,抑菌效果最好的是。
③碱式碳酸锌的化学性质与碱式碳酸铜相似,加热后分解为三种氧化物,反应的符号表达式为。
22. 下图是实验室常用制备气体和验证气体性质的装置。 (1)、高锰酸钾受热分解制取氧气的符号表达式为 , 为了防止加热时高锰酸钾随气流进入导管,应在装置A的处放一团蓬松的棉花。(2)、稀盐酸和碳酸钙粉末反应产生二氧化碳的符号表达式为。实验中发现反应速率过快,可以选用装置B作发生装置,分液漏斗的作用是。将装置B与C连接,观察到乙处燃着的火柴先熄灭,此实验说明二氧化碳具有的性质:不可燃,不助燃,。(3)、装置D模拟氢氧焰实验:
(1)、高锰酸钾受热分解制取氧气的符号表达式为 , 为了防止加热时高锰酸钾随气流进入导管,应在装置A的处放一团蓬松的棉花。(2)、稀盐酸和碳酸钙粉末反应产生二氧化碳的符号表达式为。实验中发现反应速率过快,可以选用装置B作发生装置,分液漏斗的作用是。将装置B与C连接,观察到乙处燃着的火柴先熄灭,此实验说明二氧化碳具有的性质:不可燃,不助燃,。(3)、装置D模拟氢氧焰实验:①关闭止水夹K,通入氢气并点燃。为保证安全,点燃氢气之前应先。将铁丝网放在火焰上灼烧,铁丝网只发红,不熔断。
②打开止水夹K,通入氧气,火焰更明亮,铁丝熔断,则燃烧的剧烈程度与氧气有关。
23. 二氧化碳的捕集、储存和利用是实现“碳中和”的重要途径。(1)、工业上排放大量二氧化碳,大气中的二氧化碳过多会造成(填字母)a.臭氧层空洞 b.全球气温上升 c.雾霾天气
(2)、自然界的绿色植物实现二氧化碳到葡萄糖的转化过程称为 , 海洋中的海水也能吸收二氧化碳生成碳酸。两个反应的反应物相同,但得到的产物不同,原因是。(3)、二氧化碳的捕集:①物理吸附:可以利用固态吸附剂来分离回收二氧化碳,吸附剂可能具有(填“疏松多孔”或“坚实致密”)的结构。
②化学吸收:CaO可以通过如图所示的流程进行二氧化碳的捕集与释放,反应I的符号表达式为。
 (4)、二氧化碳的储存:
(4)、二氧化碳的储存:2023年6月1日,我国首个海上二氧化碳封存示范工程项目成功投入使用。其原理是将油井开采产生的油气混合物注入高碳分离器,再将分离出的二氧化碳通入压缩机加压和干燥,使其变成介于气态和液态之间的超临界状态。
①从微观角度分析,二氧化碳被压缩过程中变化的是。
②下列对超临界二氧化碳的理解正确的是(填字母)。
a.超临界二氧化碳与二氧化碳的组成元素不同
b.超临界二氧化碳容易燃烧
c.超临界二氧化碳存在于特定的条件下,条件改变,状态改变
(5)、二氧化碳的利用:二氧化碳和氨气可以生产尿素[CO(NH2)2],其主要流程如下:

①“分离”:分离液态空气的过程是(“物理”或“化学”)变化。
②“合成氨”:合成氮气的符号表达式为 , 属于反应(填基本反应类型)。③ “合成尿素”:利用氨气与二氧化碳反应合成尿素和水。已知二氧化碳和尿素中的碳元素质量相等,则理论上,产生6t尿素可以消耗二氧化碳t。
24. 竹与梅、兰、菊并称“花中四君子”,因其“挺拔修长、外直中通”,常被看作高雅之士的象征。“外直中通”的竹节内的气体是什么?某兴趣小组的同学对此开展了探究。 (1)、I.收集竹内气体
(1)、I.收集竹内气体
将装满水的矿泉水瓶倒置于水槽中,将打孔后的竹节置于水中,按照图A所示方法收集竹节内的气体。预先在瓶内装满水的目的是。(2)、Ⅱ.检验气体成分
步骤①:将燃着的木条伸入集满气体的矿泉水瓶,木条持续燃烧一段时间,说明气体中含氧气。步骤②:请设计实验验证图B矿泉水瓶内的气体中含有二氧化碳(操作、现象和结论)。
(3)、Ⅲ.测定氧气含量
步骤①:将集满气体的矿泉水瓶连接导管构成图C所示装置。若要将瓶内的气体排入集气瓶中,则水从(选填“a”或“b”)导管注入。步骤②:将步骤① 中的集满竹内气体的集气瓶组装成如图D所示装置,用电热棒引燃白磷,瓶内充满白烟,白磷熄灭后冷却至室温,测得实验数据如下表:
实验前的体积
实验后的体积
集气瓶内体积
量筒内蒸馏水
量筒内剩余蒸馏水
450mL
90mL
45.5mL
白磷(P4)与红磷的燃烧产物相同,白磷燃烧的符号表达式为 , 结合表内数据,计算竹内气体中氧气的体积分数为(结果保留到0.1%)。
(4)、集气瓶里预先装进的水,在实验中所起到的作用有(填字母)。a.加快集气瓶冷却
b.导管末端形成液封,防气体逸出
c.缓冲集气瓶内气压的骤然升高
25. 杭州亚运会开幕式的主火炬以零碳甲醇(CH3OH)作为燃料,成为开幕式上的一大亮点,惊艳国内外。(1)、I.甲醇的制备醇易溶于水,熔点-97.8℃,沸点64.7℃.零碳甲醇是指从工业尾气中捕集的二氧化碳和氢气反应制成的甲醇,甲醇燃烧排放的二氧化碳还可以再生成甲醇,实现碳循环。
甲醇中碳、氢元素的质量比为。(2)、加热条件下,二氧化碳与氢气经催化剂作用生成甲醇,微观过程如图所示。
①从微观角度分析,反应前后,(填“分子”或“原子”)的种类不变,该反应的符号表达式为。
②加热反应后的混合液体可将甲醇与水分离。该过程中,先转化为气态的是。
(3)、研究人员使用两种催化剂,探究了影响二氧化碳与氢气制备甲醇反应效果的因素。反应效果可用甲醇的选择性衡量,数值越大反应效果越好,结果如图所示。
由上图可知,影响二氧化碳与氢气制备甲醇反应效果的因素有催化剂的种类、、。上述因素中对反应效果影响最大的是。
(4)、Ⅱ.甲醇的应用
甲醇电池是一种利用甲醇作为燃料的化学电池。电池工作时,甲醇与氧气反应产生水和二氧化碳,该过程中的能量转化形式为。26. 水是生命之源,是“永远值得探究的物质”,人类从未停止过对水的研究。1785年,拉瓦锡将水蒸气通过红热的铁制枪管,水蒸汽转化为氢气,同时生成四氧化三铁,实验示意图如题图-1所示。1800年,尼克尔森利用电解法进行水的分解实验。
 (1)、拉瓦锡“枪管实验”涉及的反应符号表达式为 , 通过该实验,可得出有关水的结论是(填字母)。
(1)、拉瓦锡“枪管实验”涉及的反应符号表达式为 , 通过该实验,可得出有关水的结论是(填字母)。a.水由氢、氧两种元素组成 b.水可以分解产生氢气和氧气
(2)、某兴趣小组也对电解水实验进行了相关探究。查阅资料:
1.水的导电能力很弱,加入少量NaOH、Ca(OH)2、NaCl等物质可增强水的导电性.
2.氯气(Cl2)是黄绿色、有刺激性气味的有毒气体。
为研究电解水时增强水的导电能力的方法,分别向水中加入少量NaOH、Ca(OH)2、 NaCl,搅拌至充分溶解,利用如图2所示装置分别进行了电解水实验,实验结果如下:

①第二组实验中,管a电极附近的溶液变浑浊,原因可能是。
②结合第三组实验现象分析,要探究水的组成,能否在水中加入NaCl来增强导电性,请作出判断并说明理由。
(3)、为研究影响电解水反应速率的因素,利用12V直流电源进行了相关实验探究,数据如下:编号
温度
NaOH溶液浓度
b管气体体积
a管气体体积
电解时间
A
20℃
2%
20mL
9.8mL
54.0s
B
20℃
5%
20mL
9.8mL
36.2s
C
30℃
2%
20mL
9.9mL
X
D
30℃
5%
20mL
9.9mL
35.4s
①比较实验A和B,可得到的结论是。
②分析四组实验数据,实验C的电解时间“X”可能是(填字母)。
a.32.4 b.35.2 c.50.2 d.55.6
③查阅资料发现,当其他条件不变时,增大直流电的电压也能加快电解水的反应速率。在D实验的基础上,若要证明电压增大能加快电解水的反应速率,请利用如图所示的电源设计实验方案:。
