江西省赣州市十八县(市、区)二十三校2023-2024学年高三上学期期中考试化学试题
试卷更新日期:2023-12-26 类型:期中考试
一、选择题:本题共14小题,每小题3分,共42分。在每小题给出的四个选项中,只有一项是符合题目要求的。
-
1. 文物蕴含着丰富的文化知识。下列文物的主要材料为硅酸盐的是( )




A.春秋箕形方孔脊铜炭铲
B.西晋青瓷羊形四系壶
C.宋双鱼纹银盘
D.《写生花鸟草虫图册》
A、A B、B C、C D、D2. 下列化学用语正确的是( )A、苯酚分子的球棍模型为 B、丙烯与溴的加成产物的结构简式为
C、胆矾的化学式为
D、的电子式为
B、丙烯与溴的加成产物的结构简式为
C、胆矾的化学式为
D、的电子式为 3. 下列物质的性质和用途相对应的是( )
3. 下列物质的性质和用途相对应的是( )选项
性质
用途
A
MgO的熔点高
可用作耐高温材料
B
具有强氧化性
可用作供氧剂
C
浓具有吸水性
可用作食品干燥剂
D
易溶于水
可用作洗涤剂
A、A B、B C、C D、D4. 下列叙述正确的是( )A、酸性氧化物均能与水反应生成酸 B、氧化还原反应均可设计成原电池 C、可通过化合反应制取 D、石油的分馏、裂化、裂解均是化学变化5. 下列各组物质的鉴别方法错误的是( )选项
物质
鉴别方法
A
CO(g)和
分别通入澄清石灰水
B
和
分别取少许试剂加入金属钠
C
和
分别取少许试剂加入溶液
D
和
分别取少许固体加入盐酸中
A、A B、B C、C D、D6. 和CO是污染性气体,可在表面转化为无害气体,有关化学反应的物质变化过程如图1所示,总反应的能量变化过程如图2所示,下列说法正确的是( ) A、总反应的 B、降低了总反应的焓变 C、总反应中氧化剂和还原剂的物质的量之比为2:1 D、、均为非极性分子7. 铜元素的价类二维图如图,下列有关说法正确的是( )
A、总反应的 B、降低了总反应的焓变 C、总反应中氧化剂和还原剂的物质的量之比为2:1 D、、均为非极性分子7. 铜元素的价类二维图如图,下列有关说法正确的是( ) A、a可直接转化为e B、b转化为c一定需要另加还原剂 C、新制的e可用于检验葡萄糖中的醛基 D、直接加热f溶液一定可得到f固体8. 某课题组发现物质M(结构如图所示)具有良好的导电性能。已知连有四个不同原子或基团的碳原子称为手性碳原子,下列有关M的说法错误的是( )
A、a可直接转化为e B、b转化为c一定需要另加还原剂 C、新制的e可用于检验葡萄糖中的醛基 D、直接加热f溶液一定可得到f固体8. 某课题组发现物质M(结构如图所示)具有良好的导电性能。已知连有四个不同原子或基团的碳原子称为手性碳原子,下列有关M的说法错误的是( ) A、含有氨基 B、所有原子可能共平面 C、能发生加成反应 D、无手性碳原子9. 某小组设计的制备并验证氨气性质的实验装置图如下,其中合理的是( )A、制备少量
A、含有氨基 B、所有原子可能共平面 C、能发生加成反应 D、无手性碳原子9. 某小组设计的制备并验证氨气性质的实验装置图如下,其中合理的是( )A、制备少量 B、收集
B、收集 C、证明易溶于水
C、证明易溶于水 D、吸收
D、吸收  10. 某矿石的主要成分由原子序数依次增大的前20号主族元素X、Y、Z、W组成。已知:X、Y、Z、W的原子序数之和为52,Y元素形成的单质在黑暗处遇氢气会发生爆炸,Z元素原子内层电子数是最外层电子数的2倍,W元素原子最外层电子数和最内层电子数相等。下列叙述正确的是( )A、原子半径:W>Z>Y>X B、中含有非极性共价键 C、Z元素最高价氧化物对应的水化物为强酸 D、最简单氢化物的沸点:X>Y>Z11. 下列离子方程式能解释对应的实验事实的是( )A、KI溶液滴入酸性溶液中: B、向溴化亚铁溶液中通入足量氯气: C、将过量通入NaClO溶液中: D、用稀硝酸洗涤做过银镜反应的试管:12. 铟(In)是制造半导体、电光源等的重要材料。工业上从冶金废料中提取的粗铟中含有锌杂质。以溶液为电解质溶液,用电解法精炼铟的装置如图1所示。
10. 某矿石的主要成分由原子序数依次增大的前20号主族元素X、Y、Z、W组成。已知:X、Y、Z、W的原子序数之和为52,Y元素形成的单质在黑暗处遇氢气会发生爆炸,Z元素原子内层电子数是最外层电子数的2倍,W元素原子最外层电子数和最内层电子数相等。下列叙述正确的是( )A、原子半径:W>Z>Y>X B、中含有非极性共价键 C、Z元素最高价氧化物对应的水化物为强酸 D、最简单氢化物的沸点:X>Y>Z11. 下列离子方程式能解释对应的实验事实的是( )A、KI溶液滴入酸性溶液中: B、向溴化亚铁溶液中通入足量氯气: C、将过量通入NaClO溶液中: D、用稀硝酸洗涤做过银镜反应的试管:12. 铟(In)是制造半导体、电光源等的重要材料。工业上从冶金废料中提取的粗铟中含有锌杂质。以溶液为电解质溶液,用电解法精炼铟的装置如图1所示。已知:①铟和铝位于同主族,性质与铝相似。
②在金属活动性顺序表中,铟排在锌之后;锌、铟的相对原子质量分别为65、115。
③超钠电池放电时电池反应为。(电解质溶液中溶剂为有机溶剂)

下列叙述正确的是( )
A、M极为阴极 B、超钠电池放电时,a极的电极反应式为 C、精炼铟一段时间后,M极净减的质量等于纯铟极净增的质量 D、精炼过程中,用图2可表示电解质溶液中与时间的变化关系13. 下列有关说法正确的是( )A、将铜粉加入溶液,铜粉溶解,说明一定条件下铜比铁活泼 B、向某溶液中滴加KSCN溶液,溶液显红色,则该溶液中不含 C、将某气体通入酸性高锰酸钾溶液,溶液褪色,则该气体中一定含有乙烯 D、溶液中存在关系14. 在电池、玻璃、有机合成等工业生产中应用广泛。利用粗(含有MnO和杂质)制取纯的流程如图。
下列说法错误的是( )
A、酸浸过程中有复分解反应发生 B、操作X用到的玻璃仪器为玻璃棒、漏斗、烧杯 C、氧化过程中每生成1mol , 转移的电子数为 D、与热的NaOH溶液反应的离子方程式为二、非选择题:共4小题,共58分。
-
15. 硫化镉(CdS)是一种新型半导体材料,一种以镉铜渣(主要成分是Cd、Cu,还含少量Fe等)为原料合成CdS的路线(部分条件和产物省略)如下:
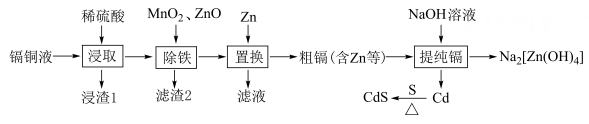
回答下列问题:
(1)、提高“浸取”速率时宜采取的措施主要有____(填标号)。A、粉碎镉铜渣 B、增大压强 C、适当降温 D、适当增大硫酸浓度(2)、“浸渣1”的主要成分是(填化学式)。(3)、“除铁”中加入的作用是。(4)、对“滤液”进行蒸发浓缩、、过滤、洗涤、干燥,得到。(5)、“提纯镉”时加入NaOH溶液除锌反应的离子方程式为。(6)、制备硫化镉时,在氩气氛围中进行,这样操作的目的是。(7)、CdS晶胞的结构如图所示。其晶胞参数为anm,以晶胞参数建立坐标系,1号原子的坐标为 , 3号原子的坐标为 , 设为阿伏加德罗常数的值。
①硫离子的配位数为。
②2号原子的坐标为。
③该晶体的密度为。
16. 某小组设计实验探究的性质,装置如图所示。
观察到的实验现象如下:
装置标号
A
B
C
D
E
现象
溶液不褪色
溶液变无色
?
产生白色沉淀
产生黄色浑浊
已知:NO能被酸性氧化成 , 与碱石灰不反应。
回答下列问题:
(1)、实验室制宜选择下列试剂中的____(填标号)。A、粉末和浓硝酸D.粉末和10%盐酸 B、粉末和70%浓硫酸 C、粉末和30%稀硝酸(2)、依据实验现象判断在(填化学式)存在下表现漂白性,预测C中现象是。(3)、D中产生的白色沉淀是(填化学式),D中发生反应的离子方程式为。(4)、E中现象表明具有的性质是(填标号)。a.漂白性 b.酸性 c.氧化性 d.还原性
(5)、为了证明的漂白性是暂时性的,请设计一个补充实验:。(6)、为处理上述实验尾气,下列装置中可供选择的是(填标号)。 17. 尿素是一种重要的氮肥,也是一种化工原料。合成尿素能回收利用二氧化碳,实现碳的固定。(1)、合成尿素分图示的两步进行:
17. 尿素是一种重要的氮肥,也是一种化工原料。合成尿素能回收利用二氧化碳,实现碳的固定。(1)、合成尿素分图示的两步进行:
2NH3(g)+CO2(g)= (s)+H2O(l),则ΔH=kJ/mol(2)、某课题组使用氢氧化铟纳米晶电催化剂直接由和高选择性地合成。
①上述和转化中,被还原的物质是(填化学式)。
②上述转化中,控速步骤是(填标号)。
A.
B.
C.
D.
(3)、在恒温恒容密闭容器中投入1mol 和2mol 合成尿素,原理是。下列情况表明该反应达到平衡状态的是____(填标号)。A、气体密度不随时间变化 B、体积分数不随时间变化 C、气体总压强不随时间变化 D、、的转化率之比不随时间变化(4)、在恒容密闭容器中发生反应: , 测得的平衡转化率与起始投料比[ , 分别为1:1、2:1、3:1]、温度关系如图所示。
①在相同投料比下,升高温度,的平衡转化率降低的主要原因是。
②曲线a代表的投料比为。
③若下,从反应开始至达到M点历时5min,测得M点对应的总压强为140kPa,则0~5min内,分压的平均变化率为 , M点对应条件下的平衡常数为(列出计算式即可)。-
18. 萘氧啶具有抗肿瘤作用,它的一种合成路线如图所示。
已知:①
②

请根据所学知识回答下列问题:
(1)、C中含氧官能团有(填名称),M的名称是。(2)、萘氧啶的分子式为 , E的结构简式为。(3)、B→C的化学方程式为。E→F的反应类型是。(4)、在B的芳香族同分异构体中,既能发生水解反应又能发生银镜反应的结构有种(不包括立体异构体),其中,在核磁共振氢谱上峰面积比为1:1:2:6的结构简式可能为(任写一种)。(5)、以甲苯和 为原料合成
为原料合成 , 设计合成路线(无机试剂
, 设计合成路线(无机试剂任选)。