广西百色市德保县2023-2024学年高二上学期11月期中考试化学试题
试卷更新日期:2023-12-26 类型:期中考试
一、本题共14小题,每小题3分,共42分。在每小题给出的四个选项中,只有一项是符合题目要求的。
-
1. 我国在探索太空、开发深海、建设高铁、5G技术等方面取得举世瞩目的成就,这些成就与化学有着密切联系。下列说法正确的是( )A、航天服壳体使用的铝合金材料熔点比纯铝高 B、打印机墨粉中常加有Fe3O4 , 这是利用了其颜色和磁性特点,可用CuO替代Fe3O4 C、华为5G手机芯片的主要成分是二氧化硅 D、中国天眼FAST用到的高性能碳化硅是一种新型的无机非金属材料2. 下列热化学方程式书写正确的是( )A、2SO2+O2 2SO3 ΔH=-196.6 kJ·mol-1 B、H2(g)+O2(g)=H2O(l) ΔH=-285.8 kJ·mol-1 C、2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ D、C(s)+O2(g)=CO2(g) ΔH=+393.5 kJ·mol-13. 已知反应: 。图中a、b曲线表示在一定条件下,D的体积分数随时间的变化情况。若使曲线a变为曲线b,可采取的措施是( )
 A、增大反应容器的体积 B、减小B的浓度 C、升高温度 D、缩小反应容器的体积4. 对于反应2SO2(g)+O2(g)2SO3(g),下列说法正确的是( )A、反应的ΔS>0 B、反应的平衡常数可表示为K= C、增大体系的压强能提高SO2的反应速率和转化率 D、使用催化剂能改变反应路径,提高反应的活化能5. 用NA表示阿伏加德罗常数的值,下列说法正确的是( )A、0.2mol/LNa2SO4溶液中含有Na⁺和总物质的量为0.6mol B、标准状况下,22.4L乙醇所含分子数为NA C、65gZn与足量H2SO4完全反应生成的H2所含原子数目为2NA D、11.2L氢气在足量的O2中完全燃烧,生成的水分子数为0.5NA6. 反应A+B―→C(ΔH<0)分两步进行:①A+B―→X(ΔH>0),②X―→C(ΔH<0)。下列示意图中,能正确表示总反应过程中能量变化的是( )A、
A、增大反应容器的体积 B、减小B的浓度 C、升高温度 D、缩小反应容器的体积4. 对于反应2SO2(g)+O2(g)2SO3(g),下列说法正确的是( )A、反应的ΔS>0 B、反应的平衡常数可表示为K= C、增大体系的压强能提高SO2的反应速率和转化率 D、使用催化剂能改变反应路径,提高反应的活化能5. 用NA表示阿伏加德罗常数的值,下列说法正确的是( )A、0.2mol/LNa2SO4溶液中含有Na⁺和总物质的量为0.6mol B、标准状况下,22.4L乙醇所含分子数为NA C、65gZn与足量H2SO4完全反应生成的H2所含原子数目为2NA D、11.2L氢气在足量的O2中完全燃烧,生成的水分子数为0.5NA6. 反应A+B―→C(ΔH<0)分两步进行:①A+B―→X(ΔH>0),②X―→C(ΔH<0)。下列示意图中,能正确表示总反应过程中能量变化的是( )A、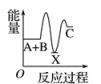 B、
B、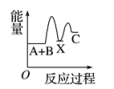 C、
C、 D、
D、 7. 对于反应N2O4(g)2NO2(g)ΔH>0,要使该反应的平衡常数值增大,可以采取的措施有( )A、增大N2O4的浓度 B、增大NO2的浓度 C、升高体系的温度 D、减小压强8. 短周期主族元素、、、的原子序数依次递增。、、位于同一周期,的族序数是其周期序数的2倍,和形成的某些化合物可导致酸雨,常温常压下的单质是一种黄绿色气体。下 列说法正确的是( )A、离子半径: B、简单氢化物的沸点: C、最高价氧化物的水化物的酸性: D、化合物可用作自来水消毒剂9. 将浓度为0.05mol/L的HClO的溶液加水不断稀释,下列各量始终保持增大的是( )A、 B、c(HClO) C、 D、10. 利用如图所示装置可以将温室气体CO2转化为燃料气体CO,下列说法正确的是( )
7. 对于反应N2O4(g)2NO2(g)ΔH>0,要使该反应的平衡常数值增大,可以采取的措施有( )A、增大N2O4的浓度 B、增大NO2的浓度 C、升高体系的温度 D、减小压强8. 短周期主族元素、、、的原子序数依次递增。、、位于同一周期,的族序数是其周期序数的2倍,和形成的某些化合物可导致酸雨,常温常压下的单质是一种黄绿色气体。下 列说法正确的是( )A、离子半径: B、简单氢化物的沸点: C、最高价氧化物的水化物的酸性: D、化合物可用作自来水消毒剂9. 将浓度为0.05mol/L的HClO的溶液加水不断稀释,下列各量始终保持增大的是( )A、 B、c(HClO) C、 D、10. 利用如图所示装置可以将温室气体CO2转化为燃料气体CO,下列说法正确的是( ) A、该过程中包括太阳能、化学能、电能间的转化 B、电极a上发生还原反应 C、该装置工作时,H+从b极区向a极区移动 D、该装置中每生成1molCO,同时生成1molO211. 对反应A+3B⇌2C来说,下列反应速率中最快的是( )A、υ(B)=0.9 mol/(L•min) B、υ(B)=0.6 mol/(L•min) C、υ(C)=0.5 mol/(L•min) D、υ(A)=0.5 mol/(L•min)12. 二氧化碳催化加氢制甲醇的反应为3H2(g)+CO(g)⇌ H2O(g)+CH3OH(g) ∆H<0。下列说法正确的是( )A、增大压强,平衡正向进行,该反应的平衡常数K增大 B、升高温度可使该反应的正反应速率增大,逆反应速率减小 C、温度越低越有利于该反应的进行,从而提高甲醇的生产效率 D、使用高效催化剂,可降低反应的活化能,增大活化分子百分数13. 工业合成氨的反应为: kJ·mol , 用○、●分别表示H原子、N原子,
A、该过程中包括太阳能、化学能、电能间的转化 B、电极a上发生还原反应 C、该装置工作时,H+从b极区向a极区移动 D、该装置中每生成1molCO,同时生成1molO211. 对反应A+3B⇌2C来说,下列反应速率中最快的是( )A、υ(B)=0.9 mol/(L•min) B、υ(B)=0.6 mol/(L•min) C、υ(C)=0.5 mol/(L•min) D、υ(A)=0.5 mol/(L•min)12. 二氧化碳催化加氢制甲醇的反应为3H2(g)+CO(g)⇌ H2O(g)+CH3OH(g) ∆H<0。下列说法正确的是( )A、增大压强,平衡正向进行,该反应的平衡常数K增大 B、升高温度可使该反应的正反应速率增大,逆反应速率减小 C、温度越低越有利于该反应的进行,从而提高甲醇的生产效率 D、使用高效催化剂,可降低反应的活化能,增大活化分子百分数13. 工业合成氨的反应为: kJ·mol , 用○、●分别表示H原子、N原子, 表示催化剂,反应微观历程如下图所示,下列说法中错误的是( )
表示催化剂,反应微观历程如下图所示,下列说法中错误的是( )
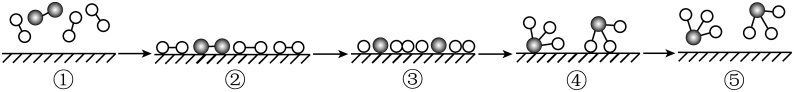 A、过程②→③吸收能量,过程③→④放出能量 B、使用新型催化剂可使与在较低温度和压强下合成 C、合成氨反应达平衡时,反应速率关系: D、合成氨工业中采用循环操作的主要目的是提高与的利用率14. 关于合成氨反应 , 下列说法不正确的是( )A、使用高效催化剂能减小反应活化能 B、为了提高原料利用率,和循环使用 C、工业合成氨温度为700K是因为升高温度有利于提高的平衡转化率 D、恒温恒容下,若体系的总压强不再改变,说明该反应已达平衡状态15. 下列各组关于强电解质、弱电解质、非电解质的归类,完全正确的是( )
A、过程②→③吸收能量,过程③→④放出能量 B、使用新型催化剂可使与在较低温度和压强下合成 C、合成氨反应达平衡时,反应速率关系: D、合成氨工业中采用循环操作的主要目的是提高与的利用率14. 关于合成氨反应 , 下列说法不正确的是( )A、使用高效催化剂能减小反应活化能 B、为了提高原料利用率,和循环使用 C、工业合成氨温度为700K是因为升高温度有利于提高的平衡转化率 D、恒温恒容下,若体系的总压强不再改变,说明该反应已达平衡状态15. 下列各组关于强电解质、弱电解质、非电解质的归类,完全正确的是( )A
B
C
D
强电解质
Fe
NaCl
CaCO3
HNO3
弱电解质
CH3COOH
NH3
H3PO4
Fe(OH)3
非电解质
C12H22O11(蔗糖)
BaSO4
C2H5OH
H2O
A、A B、B C、C D、D16. 已知25℃时,关于0.1mol/L醋酸溶液 , 下列说法正确的是( )A、升高温度,醋酸的电离程度增大,增大 B、向该溶液中通入HCl气体,平衡逆向移动,减小 C、该温度下1mol/L的醋酸溶液 D、加水稀释后,溶液中增大二、非选择题 (4个大题,共52 分)
-
17. 生产生活中的化学反应都伴随着能量的变化,请根据有关知识回答下列问题:(1)、冷敷袋在日常生活中有降温、保鲜和镇痛等用途。制作冷敷袋可以利用(填“放热”或“吸热”)的化学变化或物理变化。(2)、“即热饭盒”给人们生活带来方便,它可利用下面____(填字母)反应释放的热量加热食物。A、生石灰和水 B、浓硫酸和水 C、纯碱和水 D、食盐和白醋(3)、研究含碳、氮的物质间转化的热效应,在日常生活与工业生产中均有很重要的意义。(1)已知:H2O(l)= H2O(g) △H= +44.0kJ·mol-1 , 甲烷完全燃烧与不完全燃烧的热效应如下图所示。

①写出表示甲烷燃烧热的热化学方程式:。
②CO的燃烧热△H=kJ·mol-1。
(4)、以NH3、CO2为原料生产尿素[CONH2)2]的反应历程与能量变化示意图如下。
①第一步反应的热化学方程式为。
②第二步反应的△H0(填“>”、“<”或“=”)。
③从图象分析决定生产尿素的总反应的反应速率的步骤是第步反应。
18. 一碳化学是以分子中只含一个碳原子的化合物为原料生产化工产品的方法。合成气(和的混合气体)是一碳化学的重要原料,焦炭与水蒸气在恒容密闭容器中会发生如下三个反应:I:
II:
III:
(1)、当反应I达到平衡后,下列措施可提高正反应速率的是____(填标号)。A、加入焦炭 B、通入CO C、升高温度 D、分离出氢气(2)、若在恒温恒容容器中仅发生反应II,则下列能说明反应达到平衡状态的是____。A、容器内气体的压强不变 B、容器内气体的总质量不变 C、容器内气体的平均相对分子质量不变 D、单位时间内,每有2 mol 键断裂,同时有1 mol 键断裂(3)、向容积为的密闭容器中加入活性炭(足量)和 , 发生反应 , 和的物质的量变化如下表所示。条件
保持温度为/℃
时间
0
5min
10min
15min
20min
25min
30min
物质的量
2.0
1.4
1.0
0.70
0.50
0.40
0.40
物质的量
0
0.3
0.50
0.65
0.75
0.80
0.80
①内,以表示的该反应速率 , 最终达平衡时的转化率 , 该温度℃下的平衡常数。
②保持温度℃不变,向该密闭容器中加入该四种反应混合物各 , 该时刻,正、逆反应速率的大小关系为:(填“>”“<”或“=”)。
(4)、已知4CO(g) +2NO2(g)4CO2(g)+N2 (g) ΔH1 = -1200kJ•mol-1 ,该反应在(填“高温”、“低温”或“任何温度”)下能自发进行。19. 探究化学反应的快慢和限度具有十分重要的意义。(1)、Ⅰ.某实验小组欲通过用酸性和(草酸)反应测定单位时间内生成的体积,探究影响反应速率的因素。设计的实验方案如下(溶液已酸化),实验装置如图甲所示:

完成上述反应的离子方程式为: , 该实验是探究对反应速率的影响。实验序号
A溶液
B溶液
①
20 mL 0.01 mol·L 溶液
30 mL 0.01 mol·L 溶液
②
20 mL 0.01 mol·L 溶液
30 mL 0.01 mol·L 溶液
(2)、若实验①在2 min末收集了4.48 mL (标准状况下,则在2 min末mol/L(假设混合溶液的体积为50 mL,反应前后体积变化忽略不计)。(3)、小组同学发现反应速率变化如图乙,其中时间内速率变快的主要原因可能是①生成的可作为反应的催化剂;②。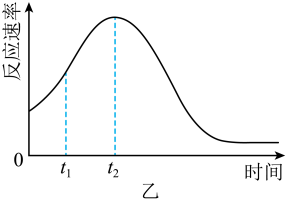 (4)、
(4)、Ⅱ.溶液中存在平衡:(橙色)(黄色)。该溶液具有强氧化性。其还原产物在水溶液中呈绿色或蓝绿色。用溶液进行下列实验:

向溶液中加入30%NaOH溶液。溶液呈色:向溶液中逐滴加入溶液(已知为黄色沉淀),则平衡向着方向移动,溶液颜色变化为。20. 在一定温度下,对冰醋酸加水稀释的过程中,溶液的导电能力I随加入水的体积V变化的曲线如图所示。请回答下列问题: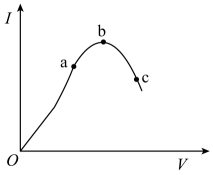 (1)、在一定温度下,向上述醋酸溶液中,加入加水稀释,按要求填空。
(1)、在一定温度下,向上述醋酸溶液中,加入加水稀释,按要求填空。①电离平衡将(填“向电离方向”、“向生成醋酸分子方向”或“不”)移动;
②醋酸的平衡常数Ka将(填“增大”、“减小”或“不变”)
(2)、a、b、c三点对应的溶液中,c(H+)最小为。(3)、a、b、c三点对应的溶液中,CH3COOH的电离程度最大的是。(4)、若使c点对应的溶液中的c(CH3COO-)增大,则下列措施中,可行的是____(填字母,下同)。A、加热 B、加入NaOH稀溶液 C、加入K2CO3固体 D、加水(5)、部分弱酸的电离平衡常数如下表:弱酸
电离平衡常数
(25℃)
①依据表格中三种酸的电离常数,判断三种酸酸性强弱的顺序为。
②向NaCN溶液中通入CO2气体,反应的化学方程式为。