四川省成都重点学校2023-2024学年高三上学期期中理综化学试题
试卷更新日期:2023-12-26 类型:期中考试
一、选择题:本题共13小题,每小题6分,共78分。在每小题给出的四个选项中,只有一项是符合题目要求的。
-
1. 化学与人类社会密切相关,下列应用和操作涉及氧化还原反应原理的是( )A、用浸泡过高锰酸钾的硅土保鲜水果 B、用热的纯碱去油污 C、用二氧化硅制作光纤 D、高压钠灯广泛用于道路照明2. 下列有关方程式正确的是( )A、硫化钠水溶液呈碱性:S2-+2H2OH2S+2OH- B、将碳酸氢钠溶于苯甲酸:HCO+C6H5COOH=C6H5COO-+CO2↑+H2O C、用稀硝酸洗去试管内壁的银:2Ag+2HNO3=2AgNO3+H2↑ D、铅蓄电池放电时负极反应:Pb–2e-=Pb2+3. 利用图示装置进行实验,反应进行一段时间,装置Ⅱ中实验现象正确的是( )

选项
①
②
③
装置Ⅱ中实验现象
A
浓氨水
氧化钙
硫酸铝溶液
先产生白色沉淀,后沉淀溶解得到澄清溶液
B
稀硫酸
CuS
新制氯水
产生乳黄色沉淀
C
浓硫酸
Cu
石蕊溶液
先变红,后褪色
D
稀硫酸
碳酸钠
饱和碳酸钠溶液
产生白色沉淀
A、A B、B C、C D、D4. 已知A、B、C、D为原子序数依次增大的短周期主族元素,B、C、D为同周期元素且与A均不同族,B、D原子的最外层电子数之和等于A的最外层电子数的2倍,B的氧化物是一种耐火材料,D的多种化合物是生活中常见的漂白剂。下列有关说法不正确的是( )A、C的氧化物的水化物的酸性可能强于碳酸 B、简单离子半径的大小顺序为D>A>B C、A与C可能形成共价化合物C3A4 D、电解B与D形成的化合物的水溶液可以制取单质B5. 我国科学家研制了Cu2P2O7催化剂建构Zn—CO2二次电池,实现了电还原CO2合成多碳产品(如乙酸,乙醇等),装置如图所示。双极膜中水电离出的H+和OH-在电场作用下可以分别向两极迁移。下列说法不正确的是( ) A、放电时,双极膜中H+向Cu2P2O7极迁移 B、电势:Cu2P2O7极高于Zn极 C、当外电路通过2mol电子时,理论上双极膜中水减少18g D、充电时,阳极上的电极反应式为C2H5OH-12e-+3H2O=2CO2↑+12H+6. 研究表明木豆素对学习记忆障碍有一定的改善作用,木豆素的结构如图所示,下列有关木豆素的说法错误的是( )
A、放电时,双极膜中H+向Cu2P2O7极迁移 B、电势:Cu2P2O7极高于Zn极 C、当外电路通过2mol电子时,理论上双极膜中水减少18g D、充电时,阳极上的电极反应式为C2H5OH-12e-+3H2O=2CO2↑+12H+6. 研究表明木豆素对学习记忆障碍有一定的改善作用,木豆素的结构如图所示,下列有关木豆素的说法错误的是( )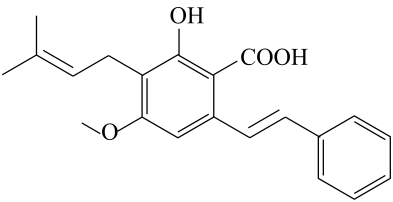 A、分子中含3种官能团 B、苯环上的一氯代物有4种 C、分子中所有碳原子可能共面 D、一定条件下能生成高分子化合物7. 分析化学中“滴定分数”的定义为:所加滴定剂与被滴定组分的物质的量之比。常温下以0.10mol·L-1的HCl溶液滴定同浓度某一元碱MOH溶液并绘制滴定曲线如图所示。下列说法不正确的是( )
A、分子中含3种官能团 B、苯环上的一氯代物有4种 C、分子中所有碳原子可能共面 D、一定条件下能生成高分子化合物7. 分析化学中“滴定分数”的定义为:所加滴定剂与被滴定组分的物质的量之比。常温下以0.10mol·L-1的HCl溶液滴定同浓度某一元碱MOH溶液并绘制滴定曲线如图所示。下列说法不正确的是( ) A、该酸碱中和滴定过程应该选用甲基橙做指示剂 B、从x点到z点的整个过程中,y点的水的电离程度最大 C、x点处的溶液中满足:c(MOH)+c(OH-)<c(M+)+c(H+) D、根据y点坐标可以算得Kb(MOH)=9×10-7
A、该酸碱中和滴定过程应该选用甲基橙做指示剂 B、从x点到z点的整个过程中,y点的水的电离程度最大 C、x点处的溶液中满足:c(MOH)+c(OH-)<c(M+)+c(H+) D、根据y点坐标可以算得Kb(MOH)=9×10-7二、非选择题(本卷包括必考题和选考题两部分。第22—32题为必考题,每个试题考生都必须作答。第33-38题为选考题,考生根据要求作答)
-
8. 亚氯酸钠是一种高效氧化剂、漂白剂,主要用于棉纺、亚麻、纸浆漂白;食品消毒:水处理;杀菌灭藻和鱼药制造。某校化学实验探究小组设计如下实验制备亚氯酸钠()晶体。
[查阅资料]
①
②极易溶于水而不与水反应,几乎不发生水解,沸点11℃。
③饱和溶液在低于38℃时析出 , 高于38℃时析出 , 高于60℃时分解成和NaCl。
 (1)、盛装浓硫酸的仪器名称是。C的作用是。(2)、B中使用浓硫酸而不用稀硫酸的原因是。(3)、气体与装置D中混合溶液反应生成 , 生成的离子方程式为。(4)、反应后,经以下步骤可从装置D的溶液获得晶体:55℃蒸发结晶→趁热过滤→38~60℃热水洗涤→低于60℃干燥,得到成品。如果干燥温度过高可能导致产品中混有的杂质是。(5)、实验需使B中 , 如过量,则滴加过量硫酸后使混有气体。装置D中可能产生 , 检验装置D中是否含有
(1)、盛装浓硫酸的仪器名称是。C的作用是。(2)、B中使用浓硫酸而不用稀硫酸的原因是。(3)、气体与装置D中混合溶液反应生成 , 生成的离子方程式为。(4)、反应后,经以下步骤可从装置D的溶液获得晶体:55℃蒸发结晶→趁热过滤→38~60℃热水洗涤→低于60℃干燥,得到成品。如果干燥温度过高可能导致产品中混有的杂质是。(5)、实验需使B中 , 如过量,则滴加过量硫酸后使混有气体。装置D中可能产生 , 检验装置D中是否含有 方法是:取少量D中反应后的溶液于试管中, , 证明溶液中存在。 (6)、测定样品中的纯度。测定时进行如下实验:
方法是:取少量D中反应后的溶液于试管中, , 证明溶液中存在。 (6)、测定样品中的纯度。测定时进行如下实验:准确称取mg的样品,加入适量蒸馏水和过量的KI晶体,在酸性条件下发生反应: , 将所得混合液稀释成100mL待测溶液。取25.00mL待测溶液,加入淀粉溶液作指示剂,用标准液滴定至终点,测的标准溶液体积的平均值为VmL(已知)
①确认滴定终点的现象是。
②所称取的样品中的质量分数为(用含c、V的代数式表示)。
9. 赤泥含有Sc2O3(氧化钪)、Al2O3、Fe2O3、SiO2等,以赤泥为原料提取钪(Sc)、氧化钪(Sc2O3)的流程如下:
已知:①P2O4为磷酸酯萃取剂;②Sc3+易水解;③Ksp[Sc(OH)3]=8.00×10-31。
请回答下列问题:
(1)、滤渣主要成分是(填化学式)。(2)、“酸浸”时温度过高,酸浸速率反而减慢,其原因是。(3)、“回流过滤”中SOCl2作用有将Sc(OH)3转化成ScCl3、作溶剂和。(4)、“热还原”的化学方程式为。(5)、利用ScCl3制备Sc2O3的方法是ScCl3溶于水,加入草酸产生草酸钪沉淀,过滤洗涤灼烧(空气中)草酸钪得到Sc2O3。灼烧草酸钪的副产物主要是。(填化学式)。(6)、P2O4萃取浸出液,其浓度、料液温度对萃取率的影响如下所示,萃取时P2O4最佳浓度及料液温度分别为 , 。若“洗涤”操作于实验室中进行,所需玻璃仪器有。试验编号
P2O4浓度/%
分相情况
钪萃取率/%
铁萃取率/%
1-1
1
分相快
90.76
15.82
1-2
2
分相容易
91.53
19.23
1-3
3
分相容易
92.98
13.56
1-4
4
有第三相
90.69
30.12
1-5
5
轻微乳化
91.74
39.79
 (7)、已知:c(Sc3+)≤1.0×10-5mol·L-1时表明完全沉淀,萃取剂混合液的pH为6时是否完全沉淀?(填“已完全沉淀”或“未完全沉淀”),通过计算作出判断:。10. CO2与氢气在固载金属催化剂上可发生以下反应:
(7)、已知:c(Sc3+)≤1.0×10-5mol·L-1时表明完全沉淀,萃取剂混合液的pH为6时是否完全沉淀?(填“已完全沉淀”或“未完全沉淀”),通过计算作出判断:。10. CO2与氢气在固载金属催化剂上可发生以下反应:反应i. CO2(g)+H2(g) HCOOH(g) ΔH1
反应ii. CO2(g)+H2(g) H2O(g)+CO(g) ΔH2>0
反应iii.……
可能的反应机理如下(M为催化剂);
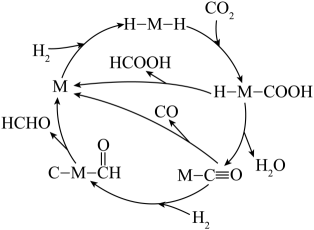
回答下列问题:
(1)、反应iii的化学方程式为。(2)、已知下列几种物质的标准摩尔生成焓(在101kPa时,由最稳定单质合成1mol指定产物时所放出的热量):物质
CO2(g)
H2(g)
HCOOH(g)
标准摩尔生成焓/kJ·mol-1
-393.51
0
-362.3
依据以上信息,ΔH1=。
(3)、在一定压强下,按n(H2):n(CO2)=1:1 投料,发生反应i和反应ii (忽略反应iii), 反应相同时间,CO2的转化率及HCOOH选择性(甲酸选择性=随温度变化曲线如下图所示。
①下列措施能提高CO2平衡转化率的是 ( 填标号)。
A.降低温度 B.再充入Ar C.分离出HCOOH
②673.15K,反应后体系中H2的分压为a MPa,则反应i的压力商计算式Qp= MPa-1。
③当温度高于673.15K,随温度升高,反应i与反应ii的反应速率相比,增加更显著的是反应 (填“ i”或“ii”),判断的理由是。
(4)、若在Bi或Bi/CeO2催化剂表面还原CO2生成HCOOH, 模拟经历两种中间体的能量变化如图所示。HCOOH的合成更倾向于通过生成中间体,且 (填 “Bi”或“Bi/CeO2”)的催化活性更优异。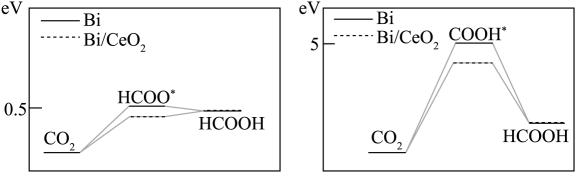 11. 含碘的物质广泛应用于生活中。如(CH3NH3)PbI3作为典型的有机金属卤化物,一直是太阳能电池研究的宠儿;AgI可用于显影剂和人工增雨。(1)、基态碘原子的价电子排布式为。(2)、CH3NH中所含元素电负性从大到小的顺序为。(3)、I的VSEPR模型如下图,中心I原子的杂化方式是(填“sp3”、“sp”、“sp3d”或“sp3d2”)。I的空间构型为。
11. 含碘的物质广泛应用于生活中。如(CH3NH3)PbI3作为典型的有机金属卤化物,一直是太阳能电池研究的宠儿;AgI可用于显影剂和人工增雨。(1)、基态碘原子的价电子排布式为。(2)、CH3NH中所含元素电负性从大到小的顺序为。(3)、I的VSEPR模型如下图,中心I原子的杂化方式是(填“sp3”、“sp”、“sp3d”或“sp3d2”)。I的空间构型为。 (4)、Ti的四卤化物熔点如下表所示。由此可推知,TiF4中的化学键类型是TiCl4至TiI4熔点依次升高,原因是。
(4)、Ti的四卤化物熔点如下表所示。由此可推知,TiF4中的化学键类型是TiCl4至TiI4熔点依次升高,原因是。化合物
TiF4
TiCl4
TiBr4
TiI4
熔点/℃
377
-24.12
38.3
155
(5)、(CH3NH3)PbI3晶体属于钙钛矿型结构(如图所示)。Pb2+周围距离最近且相等的I-数目有个;晶胞中A、B之间的距离为apm,(CH3NH3)PbI3式量为M,该物质的密度ρ=g·cm-3(列出计算式,设NA为阿伏加德罗常数的值)。 (6)、在离子晶体中,当0.414<r(阳离子)∶r(阴离子)<0.732时,AB型化合物往往采用和NaCl晶体相同的晶体结构。已知r(Ag+)∶r(I-)=0.573,但在室温下,AgI的晶体结构如下图所示,称为六方碘化银。造成AgI晶体结构不同于NaCl晶体结构的原因不可能是(填标号)。
(6)、在离子晶体中,当0.414<r(阳离子)∶r(阴离子)<0.732时,AB型化合物往往采用和NaCl晶体相同的晶体结构。已知r(Ag+)∶r(I-)=0.573,但在室温下,AgI的晶体结构如下图所示,称为六方碘化银。造成AgI晶体结构不同于NaCl晶体结构的原因不可能是(填标号)。
a.几何因素 b.电荷因素 c.键性因素
12. 席夫碱类化合物G在催化、药物、新材料等方面有广泛应用。合成G的一种路线如下:
已知以下信息:
①
 R1CHO+
R1CHO+
②1molB经上述反应可生成2molC,且C不能发生银镜反应
③D属于单取代芳烃,其相对分子质量为106
④核磁共振氢谱显示F苯环上有两种化学环境的氢
⑤RNH2+

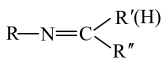 +H2O
+H2O回答下列问题:
(1)、由A生成B的化学方程式为 , 反应类型为。(2)、D的化学名称是 , 由D生成E的化学方程式为。(3)、G的结构简式为。(4)、F的同分异构体中含有苯环的还有种(不考虑立体异构)。其中核磁共振氢谱为4组峰,且面积比为6∶2∶2∶1的是(写出其中的一种的结构简式)。(5)、由苯及化合物C经如下步骤可合成N-异丙基苯胺:
反应条件1所选用的试剂为 , 反应条件2所选用的试剂为 , I的结构简式为。