四川省成都市郫都区2023-2024学年高二上学期11月期中考试化学试题
试卷更新日期:2023-12-26 类型:期中考试
一、选择题(每小题只有一个选项符合题意,每小题3分,共42分。)
-
1. 化学与生产、生活、科技密切相关。下列事实与化学反应速率无关的是( )A、在火箭上安装燃料雾化器以提高燃料燃烧的效率 B、食盐中添加碘酸钾 C、在汽车尾气净化器内放置催化剂以除去NO和CO D、工业矿石冶炼前先将矿石粉碎2. 下列关于电解质的说法正确的是( )A、液态HCl不导电,所以HCl不是电解质 B、氨气的水溶液导电能力较弱,所以氨气是弱电解质 C、难溶于水,所以不是电解质 D、同种电解质的溶液,浓度越大导电能力不一定越强3. 对于化学反应方向,下列说法错误的是( )A、非自发的反应不能通过改变条件使其成为自发反应 B、一定温度下,反应的 , C、自发进行的化学反应的方向,应由焓判据和熵判据的复合判据来判断 D、常温下反应能自发进行 , 则该反应的4. 下列说法正确且能用勒夏特列原理解释的是( )A、氧化成的反应,加入催化剂可以提高单位时间内的转化率 B、向2mL 0.1溶液滴加10滴6 NaOH溶液,溶液由黄色变橙色 C、加热0.5 溶液,溶液由绿色变为黄色 D、平衡体系: , 恒温缩小容积,气体颜色变深5. 苯甲酸是一种弱酸,结构式见右图,可用HA表示。下列事实不能证明苯甲酸是弱酸的是( )
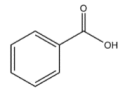 A、苯甲酸溶液能使紫色石蕊变红 B、苯甲酸溶液中存在电离平衡: C、常温下,pH=2.6的苯甲酸溶液稀释100倍,pH=3.6 D、相同条件下,0.1mol/L的苯甲酸溶液的导电能力比0.1mol/L盐酸的导电能力弱6. 下列关于测pH的实验操作和数据记录都正确的是( )A、用广泛pH试纸测得某浓度的盐酸的pH=2.3 B、用广泛pH试纸测得某浓度的NaClO溶液的pH为10 C、用pH计测得某浓度的氯水的pH为5.3 D、用湿润的pH试纸测定溶液的pH,一定会产生误差7. 某同学在如图所示装置中用50mL 盐酸与50mL NaOH溶液进行中和反应从而求的 , 下列说法正确的是( )
A、苯甲酸溶液能使紫色石蕊变红 B、苯甲酸溶液中存在电离平衡: C、常温下,pH=2.6的苯甲酸溶液稀释100倍,pH=3.6 D、相同条件下,0.1mol/L的苯甲酸溶液的导电能力比0.1mol/L盐酸的导电能力弱6. 下列关于测pH的实验操作和数据记录都正确的是( )A、用广泛pH试纸测得某浓度的盐酸的pH=2.3 B、用广泛pH试纸测得某浓度的NaClO溶液的pH为10 C、用pH计测得某浓度的氯水的pH为5.3 D、用湿润的pH试纸测定溶液的pH,一定会产生误差7. 某同学在如图所示装置中用50mL 盐酸与50mL NaOH溶液进行中和反应从而求的 , 下列说法正确的是( )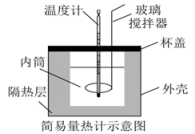 A、在测定中和反应反应热的实验中,只需要测定并记录2次温度 B、若简易量热计不盖杯盖,生成1mol 时所测得中和反应反热将偏大 C、为了实验的严谨性,与必须相同 D、为了保证实验反应充分,氢氧化钠溶液应该缓慢倒入量热计内筒的盐酸中8. 常温下,下列各组离子,在指定条件下一定能大量共存的是( )A、pH=9的溶液中,、、、 B、使甲基橙显红色的溶液:、、、 C、的溶液:、、、 D、水电离出的的溶液:、、、9. 下列有关反应热的叙述中正确的是( )A、 ; , 则 B、相同条件下,若1molO、1mol 所具有的能量分别为、 , 则 C、在相同条件下,金刚石(s)或石墨(s)燃烧生成1mol 时,放出的热量相等 D、 , 在恒温恒压的条件下,达到平衡后加入Y,该反应的不变10. 用甲、乙两装置分别定量测定锌与一定浓度稀硫酸的反应速率。下列说法正确的是( )
A、在测定中和反应反应热的实验中,只需要测定并记录2次温度 B、若简易量热计不盖杯盖,生成1mol 时所测得中和反应反热将偏大 C、为了实验的严谨性,与必须相同 D、为了保证实验反应充分,氢氧化钠溶液应该缓慢倒入量热计内筒的盐酸中8. 常温下,下列各组离子,在指定条件下一定能大量共存的是( )A、pH=9的溶液中,、、、 B、使甲基橙显红色的溶液:、、、 C、的溶液:、、、 D、水电离出的的溶液:、、、9. 下列有关反应热的叙述中正确的是( )A、 ; , 则 B、相同条件下,若1molO、1mol 所具有的能量分别为、 , 则 C、在相同条件下,金刚石(s)或石墨(s)燃烧生成1mol 时,放出的热量相等 D、 , 在恒温恒压的条件下,达到平衡后加入Y,该反应的不变10. 用甲、乙两装置分别定量测定锌与一定浓度稀硫酸的反应速率。下列说法正确的是( ) A、实验前,甲需检查装置的气密性,乙装置无需检查装置的气密性 B、甲、乙两实验均可通过收集一定体积的氢气所需的时间来测定反应速率的大小 C、甲、乙两实验测得生成氢气的速率一定相等 D、乙装置中玻璃燃烧匙不可用铜质燃烧匙替代11. 在一密闭容器中发生反应 , 3min达到平衡状态,增加了0.6 , 下列说法正确的是( )A、0~3min, B、在2min末, C、第4min时,和表示的反应速率的值相等 D、若相同时间内, , 则这两段时间内反应速率相等12. 工业上制备硫酸的一步重要反应是: 。下列有关说法正确的是( )A、为提高的平衡转化率,实际生产过程中,通入空气的量越多越好 B、为提高反应速率和平衡转化率,实际生产过程中,采用的压强越大越好 C、为提高的平衡转化率,实际生产过程中,反应温度越低越好 D、为提高原料利用率,实际生产过程中,、循环使用得越充分越好13. 向恒温、恒容的密闭容器中加入 , 发生反应 , 不能说明反应达到平衡状态的是( )A、的体积分数保持不变 B、保持不变 C、混合气体的密度保持不变 D、每断裂6个N-H的同时生成2个C=O14. 工业上可通过甲醇()羰基化法制取甲酸甲酯():
A、实验前,甲需检查装置的气密性,乙装置无需检查装置的气密性 B、甲、乙两实验均可通过收集一定体积的氢气所需的时间来测定反应速率的大小 C、甲、乙两实验测得生成氢气的速率一定相等 D、乙装置中玻璃燃烧匙不可用铜质燃烧匙替代11. 在一密闭容器中发生反应 , 3min达到平衡状态,增加了0.6 , 下列说法正确的是( )A、0~3min, B、在2min末, C、第4min时,和表示的反应速率的值相等 D、若相同时间内, , 则这两段时间内反应速率相等12. 工业上制备硫酸的一步重要反应是: 。下列有关说法正确的是( )A、为提高的平衡转化率,实际生产过程中,通入空气的量越多越好 B、为提高反应速率和平衡转化率,实际生产过程中,采用的压强越大越好 C、为提高的平衡转化率,实际生产过程中,反应温度越低越好 D、为提高原料利用率,实际生产过程中,、循环使用得越充分越好13. 向恒温、恒容的密闭容器中加入 , 发生反应 , 不能说明反应达到平衡状态的是( )A、的体积分数保持不变 B、保持不变 C、混合气体的密度保持不变 D、每断裂6个N-H的同时生成2个C=O14. 工业上可通过甲醇()羰基化法制取甲酸甲酯():。在容积固定的密闭容器中,投入等物质的量的和CO,测得相同时间内CO的转化率随温度变化如图所示。下列说法错误的是( )
 A、 B、生产时反应温度控制在80~85℃为宜 C、c点一定没有达到平衡,不能确定d点是否达到平衡 D、若使用了催化剂,e点的转化率低于d点,可能原因是催化剂中毒
A、 B、生产时反应温度控制在80~85℃为宜 C、c点一定没有达到平衡,不能确定d点是否达到平衡 D、若使用了催化剂,e点的转化率低于d点,可能原因是催化剂中毒二、非选择题(共58分)
-
15. 环境保护、绿色能源的使用是当今社会的热点问题(1)、对烟道气中的进行回收再利用具有较高的社会价值和经济价值。CO还原法:一定条件下,由和CO反应生成S和的能量变化如图所示,每生成64g , 该反应(填“放出”或“吸收”)的热量为kJ。
 (2)、近年来,研究人员提出利用含硫物质热化学循环实现太阳能的转化与存储。过程如下:
(2)、近年来,研究人员提出利用含硫物质热化学循环实现太阳能的转化与存储。过程如下:
反应Ⅱ:
反应Ⅲ:
反应Ⅰ的热化学方程式为。
(3)、为消除汽车尾气中含有NO、、CO等气体,可采取:NO和CO在催化转换器中发生如下反应: ;已知: ;CO的燃烧热为;
与CO发生反应的热化学方程式: (用、、表示)。
(4)、工业上接触法生产硫酸的主要反应之一是:在一定的温度、压强和钒催化剂存在的条件下,被空气中的氧化为。是钒催化剂的活性成分,在对反应Ⅰ的催化循环过程中,经历了Ⅱ、Ⅲ两个反应阶段,反应Ⅱ为决速步,如下图所示:
化学键
能量/kJ/mol
a
b
c
①根据气体分子中1mol化学键断裂时需要吸收的能量数据,计算反应Ⅰ的kJ/mol。
②反应Ⅰ、Ⅱ、Ⅲ中正反应活化能最小的是。
16. 滴定实验是化学学科中重要的定量实验.请根据其原理回答下列问题:(1)、Ⅰ.酸碱中和滴定是最基本、最简单的一种滴定方法。某学生用0.1500mol/L NaOH溶液测定某未知浓度的盐酸溶液,完成以下填空:
在使用滴定管前,首先要。(2)、滴定时边滴边摇动锥形瓶,眼睛应注意观察。(3)、滴定结果如表所示:滴定次数
待测液体积/mL
标准溶液的体积/mL
滴定前刻度
滴定后刻度
1
25.00
1.02
21.03
2
25.00
0.60
a
3
25.00
0.20
20.19
①第2次滴定后的刻度如右图所示,;

②计算:该盐酸的物质的量浓度为(精确至0.0001)。
(4)、Ⅱ.氧化还原滴定应用非常广泛。工业废水中常含一定量氧化性较强的 , 利用滴定原理测定含量的方法如下:
步骤①:量取30.00mL废水于锥形瓶中,加入适量稀硫酸酸化。
步骤②:加入过量的碘化钾溶液充分反应:。
步骤③:向锥形瓶中滴入几滴指示剂。用 溶液进行滴定,三次滴定平均消耗的体积为V mL。()
步骤③中滴加的指示剂为;滴定达到终点时的实验现象是(5)、的含量为。(6)、以下操作会造成废水中含量测定值偏高的是____(填字母)。A、盛装待测液的锥形瓶先用蒸馏水清洗,再用待测液润洗 B、摇动锥形瓶时部分液体溅出 C、滴定到终点时,滴定管尖嘴处悬挂一滴液体 D、滴定前读数时,仰视装标准液的滴定管的刻度17.(1)、Ⅰ.现将pH=3,体积均为的盐酸和醋酸溶液分别加水稀释至体积V,pH随的变化如图所示。
加水稀释过程中,醋酸的电离平衡向(填“正”或“逆”)反应方向移动,原醋酸溶液中水的电离平衡向(填“正”或“逆”)反应方向移动。 (2)、t℃,蒸馏水的pH=6.5则 , 该温度下,将pH=3的盐酸与pH=10的NaOH溶液等体积混合,所得溶液的pH=。(3)、a、b、c三点溶液的导电能力强弱关系为。(4)、用等浓度的NaOH溶液和a、b处溶液完全反应,消耗NaOH溶液的体积大小关系为。(5)、Ⅱ.已知,常温下几种酸的电离平衡常数如表:
(2)、t℃,蒸馏水的pH=6.5则 , 该温度下,将pH=3的盐酸与pH=10的NaOH溶液等体积混合,所得溶液的pH=。(3)、a、b、c三点溶液的导电能力强弱关系为。(4)、用等浓度的NaOH溶液和a、b处溶液完全反应,消耗NaOH溶液的体积大小关系为。(5)、Ⅱ.已知,常温下几种酸的电离平衡常数如表:
次磷酸()是一种精细化工产品,向10mL 溶液中加入30mL等物质的量浓度的NaOH溶液后,所得的溶液中阴离子为化学式
HClO
电离平衡常数
(6)、写出少量与NaClO溶液反应的离子方程式18. 氮的固定是几百年来科学家一直研究的课题。(1)、下表列举了不同温度下大气固氮和工业固氮的部分化学平衡常数K的值。反应
大气固氮
工业固氮
温度/℃
27
2000
25
400
450
平衡常数K
0.1
0.507
0.152
①分析数据可知:大气固氮反应属于(填“吸热”或“放热”)反应。
②分析数据可知:人类不适合大规模模拟大气固氮的原因:。
③下图是工业固氮反应达到平衡,混合气中的体积分数随温度或压强变化的曲线,图中L(、)、X分别代表温度或压强。其中X代表的是(填“温度”或“压强”);(填“>”“<”或“=”)原因是。
 (2)、实验室模拟工业固氮,在压强为P MPa的恒压容器中充入1mol 和3mol , 反应混合物中的物质的量分数随温度的变化曲线如图所示,其中一条是经过一定时间反应后的曲线,另一条是平衡时的曲线。
(2)、实验室模拟工业固氮,在压强为P MPa的恒压容器中充入1mol 和3mol , 反应混合物中的物质的量分数随温度的变化曲线如图所示,其中一条是经过一定时间反应后的曲线,另一条是平衡时的曲线。
①图中b点的转化率为;(填“>”“=”或“<”)。
②475℃时,该反应的压强平衡常数的代数式(用平衡分压代替平衡浓度计算,平衡分压=总压×物质的量分数,用含P的代数式表示,列式无需化简)