四川省成都市东部新区联考2023-2024学年九年级上学期化学期中试卷
试卷更新日期:2023-12-25 类型:期中考试
一、单项选择题(每小题只有一个选项符合题目要求,每小题 3 分,共 42 分)
-
1. “天宫课堂”真奇妙,下列过程发生了化学变化的是( )A、水油分离实验 B、无线电波通讯 C、宇航员的呼吸 D、太空抛物实验2. 第19届亚运会于2023年9月23日在杭州举行,为提高公众环保意识,下列做法不值得提倡的是( )A、垃圾分类处理 B、污水处理排放 C、开发利用清洁能源 D、随意焚烧塑料3. 规范操作是安全进行化学实验的保障。下列实验操作中正确的是( )A、加入块状固体
 B、闻药品气味
B、闻药品气味  C、点燃酒精灯
C、点燃酒精灯  D、取少量液体
D、取少量液体  4. 用分子的观点解释下列现象,其中说法错误的是( )A、通电分解水──分子分解成原子,原子又重新组合成新的分子 B、花香四溢──分子的大小发生了改变 C、食物变质--分子的化学性质发生了变化 D、气体受热膨胀——分子间间隔变大5. 下列物质的性质和用途对应关系错误的是( )A、氧气支持燃烧——作燃料 B、铜的导电性好——作导线 C、稀有气体通电时发出不同颜色的光——作电光源 D、氮气的化学性质不活泼——作保护气6. 从化学视角看“烟和雾”、“光和焰”是有区别的。下列实验现象正确的是( )A、硫在氧气中燃烧,发出蓝紫色火焰,生成有刺激性气味的气体 B、木炭在氧气中燃烧,发出白光,生成二氧化碳气体 C、红磷在空气中燃烧,产生大量白色烟雾 D、镁条在空气中燃烧,发出耀眼的白光,生成黑色固体7. 下列符号中,既可以表示一种元素,又可以表示一个原子,还可以表示一种物质的是( )A、N B、2H C、O2 D、Fe8. 科学家用Xe(氙气)首次合成了XePtF6(Xe显+1价、F显-1价),则XePtF6中Pt元素的化合价是( )A、+2 B、+4 C、+5 D、+79. 白银做容器有杀菌作用,净化水质。如图是关于银的元素周期表和原子结构示意图,下列说法不正确的是( )
4. 用分子的观点解释下列现象,其中说法错误的是( )A、通电分解水──分子分解成原子,原子又重新组合成新的分子 B、花香四溢──分子的大小发生了改变 C、食物变质--分子的化学性质发生了变化 D、气体受热膨胀——分子间间隔变大5. 下列物质的性质和用途对应关系错误的是( )A、氧气支持燃烧——作燃料 B、铜的导电性好——作导线 C、稀有气体通电时发出不同颜色的光——作电光源 D、氮气的化学性质不活泼——作保护气6. 从化学视角看“烟和雾”、“光和焰”是有区别的。下列实验现象正确的是( )A、硫在氧气中燃烧,发出蓝紫色火焰,生成有刺激性气味的气体 B、木炭在氧气中燃烧,发出白光,生成二氧化碳气体 C、红磷在空气中燃烧,产生大量白色烟雾 D、镁条在空气中燃烧,发出耀眼的白光,生成黑色固体7. 下列符号中,既可以表示一种元素,又可以表示一个原子,还可以表示一种物质的是( )A、N B、2H C、O2 D、Fe8. 科学家用Xe(氙气)首次合成了XePtF6(Xe显+1价、F显-1价),则XePtF6中Pt元素的化合价是( )A、+2 B、+4 C、+5 D、+79. 白银做容器有杀菌作用,净化水质。如图是关于银的元素周期表和原子结构示意图,下列说法不正确的是( )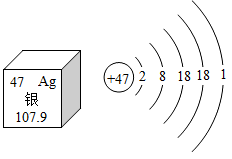 A、银是金属元素 B、银的相对原子质量为107.9 g C、银在AgNO3中,显+1价 D、银容易失去电子而形成Ag+10. 下列关于物质的检验、验满、鉴别正确的是( )A、检验气体是否为二氧化碳:向集气瓶内伸入燃着的木条,观察是否熄灭 B、检验氧气是否集满:向集气瓶内伸入带火星的木条,观察是否复燃 C、鉴别硬水和软水:取等量水样,滴加等量肥皂水,振荡,观察现象差异 D、鉴别水和过氧化氢溶液:观察溶液的颜色11. 婴儿“尿不湿”最关键的材料是聚丙烯酸钠,它是由丙烯酸(C3H4O2)与氢氧化钠经过一系列的复杂反应而制得。下列有关丙烯酸(C3H4O2)的说法正确的是( )A、丙烯酸中氢元素的质量分数最大 B、丙烯酸是由碳、氢、氧三种元素组成 C、丙烯酸中碳、氢、氧元素的质量比是3:4:2 D、丙烯酸是由3个碳原子4个氢原子和2个氧原子构成12. 正确的实验操作可以保证实验的成功。下列关于过滤操作中,正确的是( )A、过滤时漏斗内液面高于滤纸 B、滤纸没有紧贴漏斗内壁可使过滤速率更快 C、过滤时用玻璃棒在漏斗内搅拌 D、利用过滤操作可除去液体中的难溶性固体13. 下列对物质的分类错误的是( )A、
A、银是金属元素 B、银的相对原子质量为107.9 g C、银在AgNO3中,显+1价 D、银容易失去电子而形成Ag+10. 下列关于物质的检验、验满、鉴别正确的是( )A、检验气体是否为二氧化碳:向集气瓶内伸入燃着的木条,观察是否熄灭 B、检验氧气是否集满:向集气瓶内伸入带火星的木条,观察是否复燃 C、鉴别硬水和软水:取等量水样,滴加等量肥皂水,振荡,观察现象差异 D、鉴别水和过氧化氢溶液:观察溶液的颜色11. 婴儿“尿不湿”最关键的材料是聚丙烯酸钠,它是由丙烯酸(C3H4O2)与氢氧化钠经过一系列的复杂反应而制得。下列有关丙烯酸(C3H4O2)的说法正确的是( )A、丙烯酸中氢元素的质量分数最大 B、丙烯酸是由碳、氢、氧三种元素组成 C、丙烯酸中碳、氢、氧元素的质量比是3:4:2 D、丙烯酸是由3个碳原子4个氢原子和2个氧原子构成12. 正确的实验操作可以保证实验的成功。下列关于过滤操作中,正确的是( )A、过滤时漏斗内液面高于滤纸 B、滤纸没有紧贴漏斗内壁可使过滤速率更快 C、过滤时用玻璃棒在漏斗内搅拌 D、利用过滤操作可除去液体中的难溶性固体13. 下列对物质的分类错误的是( )A、 单质
B、
单质
B、 化合物
C、
化合物
C、 化合物
D、
化合物
D、 混合物
14. 某兴趣小组利用氧气传感器探究不同物质在空气中燃烧的耗氧量情况。足量蜡烛和红磷分别在相同的密闭容器中燃烧、测定的氧气含量变化如图所示。下列判断不正确的是( )
混合物
14. 某兴趣小组利用氧气传感器探究不同物质在空气中燃烧的耗氧量情况。足量蜡烛和红磷分别在相同的密闭容器中燃烧、测定的氧气含量变化如图所示。下列判断不正确的是( )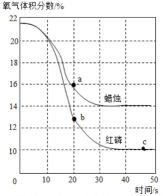 A、燃烧后,两容器中氧气均未耗尽,红磷耗氧量较多 B、红磷燃烧过程中,容器内压强先增大后减小 C、图中a点与b点对应容器内氮气体积分数相等 D、将足量蜡烛和红磷放在同一密闭容器中燃烧,无法将容器内的氧气完全消耗
A、燃烧后,两容器中氧气均未耗尽,红磷耗氧量较多 B、红磷燃烧过程中,容器内压强先增大后减小 C、图中a点与b点对应容器内氮气体积分数相等 D、将足量蜡烛和红磷放在同一密闭容器中燃烧,无法将容器内的氧气完全消耗二、(本题只有一个小题,共 10 分)
-
15. 根据图文回答问题。(1)、如图是铜、氯化钠和干冰的结构模型示意图。
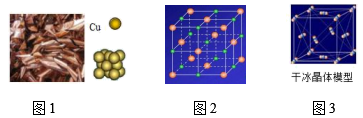
铜是由构成的;氯化钠是由构成的;干冰是由组成的。
(2)、请用化学符号填空。①4个氢分子;
②n个硝酸根离子;
③地壳中含量最多的金属元素所形成的氧化物的化学式;
④标出硫酸铁中铁元素的化合价。
(3)、说出下列符号中“2”的意义。①Ca2+;
②2NH3;
③P2O5。
三、(本题只有一个小题,共 9 分)
-
16. N(NO2)3是科学家 2011 年发现的一种新型火箭燃料。请计算:(1)、①N(NO2)3中氮元素和氧元素的质量比为;
②N(NO2)3的相对分子质量是;
③下列化合物中,氮元素质量分数最小的是(填字母)。
A.N(NO2)3
B.N2O3
C.N2O5
(2)、氧气家族的“生长树”如图所示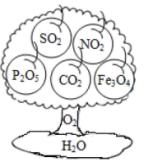
树子上的“果子”相同之处是。(3)、树上的果子中,属于空气污染物的是。(4)、树上有种“果子”为黑色固体,写出由单质生成该“果子”的化学反应的表达式。(5)、“生长树”成长所必需的其中一种物质便是水,请任意写出一种通过化合反应生成水的化学反应表达式。四、(本题有三个小题,共 39 分)
-
17. 根据装置图,回答下列问题:
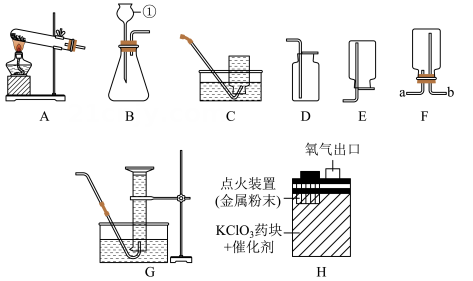 (1)、写出带有标号的仪器名称:①。(2)、实验室可用装置 A 制取氧气,该反应的表达式为;试管口还需加一团棉花,目的是。实验室用装置 B 制取氧气,欲得到平稳的氧气流,可以将仪器①换成。(3)、装置 H 是一种紧急供氧设备内部结构示意图。使用时按动点火装置,金属粉末反应放热,使氯酸钾药块分解持续供氧,该反应产生氧气的表达式为。(4)、如果选用 C 装置收集完气体后,测得其纯度明显偏低,原因可能是____(填字母)。A、高锰酸钾中混入了二氧化锰 B、收集前,集气瓶中未注满水 C、收集后,集气瓶中仍有少量水 D、未见气泡连续均匀冒出时就开始收集(5)、若用装置 F 收集氧气,检验氧气是否集满的操作是:。(6)、小强同学利用装置 G 测定生成的氧气体积。若读取氧气的体积时仰视读数,所得读数较实际体积(填“偏大”、“偏小”或“不变”)。(7)、已知:硫化亚铁固体和稀硫酸在常温下反应可以制得硫化氢气体,该气体易溶于水,标准状况下,密度比空气大。由上述信息推知实验室制取硫化氢可选用的发生装置是 , 收集装置是(从 A 到 G 中选,填字母)。18. 创新实验能激发探索欲望,提高实验探究能力、动手动脑能力和创新精神,下面三个都是学生设计的创新实验。
(1)、写出带有标号的仪器名称:①。(2)、实验室可用装置 A 制取氧气,该反应的表达式为;试管口还需加一团棉花,目的是。实验室用装置 B 制取氧气,欲得到平稳的氧气流,可以将仪器①换成。(3)、装置 H 是一种紧急供氧设备内部结构示意图。使用时按动点火装置,金属粉末反应放热,使氯酸钾药块分解持续供氧,该反应产生氧气的表达式为。(4)、如果选用 C 装置收集完气体后,测得其纯度明显偏低,原因可能是____(填字母)。A、高锰酸钾中混入了二氧化锰 B、收集前,集气瓶中未注满水 C、收集后,集气瓶中仍有少量水 D、未见气泡连续均匀冒出时就开始收集(5)、若用装置 F 收集氧气,检验氧气是否集满的操作是:。(6)、小强同学利用装置 G 测定生成的氧气体积。若读取氧气的体积时仰视读数,所得读数较实际体积(填“偏大”、“偏小”或“不变”)。(7)、已知:硫化亚铁固体和稀硫酸在常温下反应可以制得硫化氢气体,该气体易溶于水,标准状况下,密度比空气大。由上述信息推知实验室制取硫化氢可选用的发生装置是 , 收集装置是(从 A 到 G 中选,填字母)。18. 创新实验能激发探索欲望,提高实验探究能力、动手动脑能力和创新精神,下面三个都是学生设计的创新实验。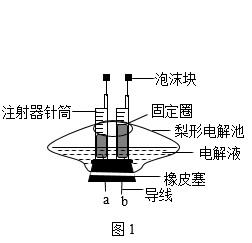
 (1)、如图1为电解水的实验
(1)、如图1为电解水的实验①导线a端连接的是电源极(填“正”或“负”)。
②该实验中常加入少量硫酸钠目的是 , 该反应的表达式是 , 该反应中的最小粒子是 , 该实验说明水是由组成的。
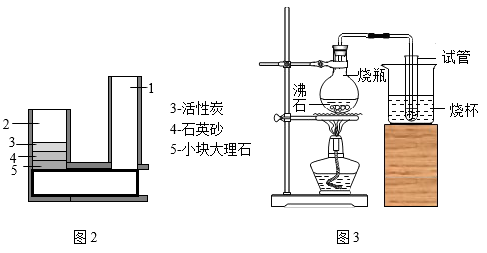
(2)、如图2为一种家庭净水器①这种净水器可以除去水中的难溶性物质,还可以利用活性炭的作用除去臭味和一些可溶性的杂质。其中大理石、石英砂与实验室中的(填实验用品)作用相同。
②该净水器进水口为图中“1”、“2”中的处,出水口为另一处。净化后的水,要检验是硬水还是软水,可向水样中加入等量 , 搅拌,若观察到 , 则为硬水,家庭中常采用的方法进一步降低水的硬度。
(3)、如图3为制取蒸馏水的简易装置。①烧杯中的水应装(填字母)。
A.沸水 B.温水 C.冷水
②获得一试管蒸馏水后,应先进行的操作是(填字母)。
A.移出酒精灯并熄灭 B.移开试管和烧杯
19. 学习了二氧化锰对过氧化氢分解有催化作用的知识后,我们对催化剂已有了初步的认识。(1)、下列有关于催化剂的说法中错误的是____(填字母)A、催化剂只能加快化学反应速率 B、催化剂可以增加产物的质量 C、二氧化锰是可做所有反应的催化剂 D、一个化学反应只有一种催化剂(2)、实验一:某同学想:氧化铜(CuO)能否起到类似的催化剂作用呢?于是进行了以下探究。
【猜想与假设】Ⅰ、氧化铜不是催化剂,也不参与反应,反应前后质量和化学性质不变;Ⅱ、氧化铜参与了反应产生氧气,反应前后质量和化学性质发生改变;
Ⅲ、氧化铜是反应的催化剂,反应前后。
【进行实验】
用天平称量 0.2gCuO,取 5mL5%的过氧化氢溶液于试管中,进行如图实验:
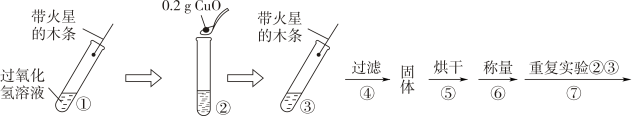 (3)、请补充能证明猜想Ⅲ 成立的实验现象:步骤③现象为 , 步骤⑥中二氧化锰固体质量为g。
(3)、请补充能证明猜想Ⅲ 成立的实验现象:步骤③现象为 , 步骤⑥中二氧化锰固体质量为g。结论:猜想Ⅲ成立。
(4)、步骤①的目的是。(5)、定性判断步骤①和步骤②的反应快慢,可根据。(6)、过氧化氢能被 CuO 催化分解放出氧气的表达式为。(7)、每次实验时,海藻酸钠微球数应相同的目的是。(8)、从实验曲线看,催化效果较好、反应温和的催化剂是(填化学符号)。(9)、用含 MnO2的海藻酸钠微球进行实验,60s 时压强瞬间回落,其原因可能是。(10)、除上述影响过氧化氢溶液分解的因素外,你认为还有哪些因素会影响过氧化氢溶液的分解速率,请你再探究(探究一种因素即可)影响因素:;
探究方案:。
-
-