2023-2024学年高一上学期化学期末复习专题:元素周期律
试卷更新日期:2023-12-24 类型:复习试卷
一、选择题
-
1. 下列有关物质的应用错误的是( )A、钾钠合金可用作原子反应堆的导热剂 B、氯气可用作自来水消毒 C、碳酸钠可用作食品膨松剂 D、可用作供氧剂2. 下列有关钾及钾的化合物叙述错误的是( )A、钾及钾的化合物灼烧时均会发出紫色的火焰 B、 受热易分解产生 C、金属钾燃烧时生成氧化钾 D、金属钾可保存在煤油中3. 下列关于碱金属元素的说法中,错误的是A、原子核外最外层电子数都是1 B、单质与水反应的剧烈程度:K>Na C、最高价氧化物对应水化物的碱性:LiOH <KOH D、碱金属元素的单质在氧气中燃烧均生成过氧化物4. 在医疗上,掺钕钇铝石榴石激光器代替手术刀用于摘除手术或消毒创伤口。钕元素的相关信息如图,下列说法中错误的是 ( )
 A、原子核内有84个中子 B、、互为同位素 C、、的化学性质有很大不同 D、图中“144.2”表示Nd元素的相对原子质量5. 下列说法不正确的是( )A、第四周期 VIA 族的 Se 是人体必需的微量元素,其原子序数为 34 B、在元素周期表中,IIIB 族元素种类最多 C、在周期表中金属与非金属的分界处可以找到半导体材料 D、在周期表中,从上到下碱金属单质及卤素单质的熔沸点均逐渐降低6. 溴、碘均为卤族元素,下列关于溴、碘说法错误的是( )。A、将分别通入NaBr溶液和NaI溶液中,可以得到溴单质和碘单质 B、溴单质和碘单质在四氯化碳中的溶解度均大于它们在水中的溶解度 C、碘酒可以使淀粉碘化钾试纸变蓝 D、通常将固体添加到食盐中来制作碘盐7. 短周期主族元素X、Y、Z和W的原子序数依次增大,X、Y、W位于不同周期,Y、Z、W的原子最外层电子数之和为14,Z的原子半径在短周期主族元素中最大。下列说法正确的是( )A、Y与Z形成的化合物溶于水所得溶液呈碱性 B、W的氧化物对应的水化物为强酸 C、简单离子半径:Y<Z<W D、与X形成的简单化合物的还原性:Y>W>Z8. X、Y、Z、W为原子序数依次增大的四种短周期主族元素,Y、Z的最外层电子数之和等于W的原子序数,Z元素在地壳中含量最高,Y与X形成的化合物极易溶于水。下列说法正确的是( )A、非金属性:Y>X B、原子半径:W>Z>Y>X C、Z与W形成的化合物中只含有离子键 D、简单氢化物的沸点:Y>Z9. 中国国家航天局公布了由“祝融号”火星车拍摄的科学影像图,发现火星岩石中富含X、Y、Z、W四种短周期元素,其原子序数递增。Y是地球地壳中含量最高的元素,Z的原子半径是所有短周期主族元素中最大的,X、W同主族,且X、Z、W原子的最外层电子数之和为9。下列叙述正确的是( )A、简单离子半径: Y<Z B、Y、Z、W形成的盐溶液呈碱性 C、氢化物的沸点: X一定低于Y D、X与W形成WX是离子化合物10. 如图是部分短周期元素的原子序数与其某种常见化合价的关系图,原子序数a、b、c、d、e所对应的元素分别为A、B、C、D、E,则下列说法正确的是( )
A、原子核内有84个中子 B、、互为同位素 C、、的化学性质有很大不同 D、图中“144.2”表示Nd元素的相对原子质量5. 下列说法不正确的是( )A、第四周期 VIA 族的 Se 是人体必需的微量元素,其原子序数为 34 B、在元素周期表中,IIIB 族元素种类最多 C、在周期表中金属与非金属的分界处可以找到半导体材料 D、在周期表中,从上到下碱金属单质及卤素单质的熔沸点均逐渐降低6. 溴、碘均为卤族元素,下列关于溴、碘说法错误的是( )。A、将分别通入NaBr溶液和NaI溶液中,可以得到溴单质和碘单质 B、溴单质和碘单质在四氯化碳中的溶解度均大于它们在水中的溶解度 C、碘酒可以使淀粉碘化钾试纸变蓝 D、通常将固体添加到食盐中来制作碘盐7. 短周期主族元素X、Y、Z和W的原子序数依次增大,X、Y、W位于不同周期,Y、Z、W的原子最外层电子数之和为14,Z的原子半径在短周期主族元素中最大。下列说法正确的是( )A、Y与Z形成的化合物溶于水所得溶液呈碱性 B、W的氧化物对应的水化物为强酸 C、简单离子半径:Y<Z<W D、与X形成的简单化合物的还原性:Y>W>Z8. X、Y、Z、W为原子序数依次增大的四种短周期主族元素,Y、Z的最外层电子数之和等于W的原子序数,Z元素在地壳中含量最高,Y与X形成的化合物极易溶于水。下列说法正确的是( )A、非金属性:Y>X B、原子半径:W>Z>Y>X C、Z与W形成的化合物中只含有离子键 D、简单氢化物的沸点:Y>Z9. 中国国家航天局公布了由“祝融号”火星车拍摄的科学影像图,发现火星岩石中富含X、Y、Z、W四种短周期元素,其原子序数递增。Y是地球地壳中含量最高的元素,Z的原子半径是所有短周期主族元素中最大的,X、W同主族,且X、Z、W原子的最外层电子数之和为9。下列叙述正确的是( )A、简单离子半径: Y<Z B、Y、Z、W形成的盐溶液呈碱性 C、氢化物的沸点: X一定低于Y D、X与W形成WX是离子化合物10. 如图是部分短周期元素的原子序数与其某种常见化合价的关系图,原子序数a、b、c、d、e所对应的元素分别为A、B、C、D、E,则下列说法正确的是( ) A、和属于同种核素 B、B和C的最高价氧化物对应的水化物可以反应 C、简单气态氢化物的稳定性: D、A和B只能形成一种化合物11. “跑道式”元素周期表结构如图所示:
A、和属于同种核素 B、B和C的最高价氧化物对应的水化物可以反应 C、简单气态氢化物的稳定性: D、A和B只能形成一种化合物11. “跑道式”元素周期表结构如图所示:
下列有关叙述错误的是
A、元素a能与水置换出 , 且反应比与水反应更剧烈 B、元素b形成的两种单质分子的化学性质完全不同 C、元素c、d、e、f、g的原子最外层电子数相同,且对应的单质都有比较强的氧化性 D、位置h和i处均各含有15种元素12. X、Y、Z、M是四种短周期主族元素,且原子序数依次增大,其中Y、M位于同一主族,Z与M位于同一周期。Y原子的最外层电子数是其电子层数的3倍,X原子的核外电子数比Y原子的少1。Z是同周期主族元素中原子半径最大的元素。下列说法正确的是( )A、简单离子的半径:M>Y>X>Z B、简单氢化物的稳定性:Y<M C、元素M的氧化物对应的水化物为强酸 D、Y、Z、M可以组成多种离子化合物13. 2022年5月,人类首次利用月球土壤成功种活了植物,未来的宇航员们有可能在月球上种植食物,月壤中所含短周期主族元素X、Y、Z、W的原子序数依次增大,X、Y、W的原子核外最外层电子数为互不相等的偶数,X原子的最外层电子数是其内层电子总数的3倍,W元素在地壳中的含量位居第二,常见元素乙的单质是目前使用量最大的主族金属元素,下列叙述正确的是A、原子半径大小顺序: B、Y、Z、W的最高价氧化物的水化物均显碱性,且碱性逐渐减弱 C、元素W和X的简单氢化物的沸点: D、元素X与Y、Z、W形成的二元化合物的化学键依次为离子键、离子键、共价键14. 有五种短周期元素X、Y、Z、M、W的原子序数依次增大,其最高正化合价或最低负化合价与原子序数的关系如下图,下列说法错误的是 A、元素X可能是锂 B、中各原子均达到8电子稳定结构 C、原子半径: D、元素气态氢化物的稳定性:15. 侯氏制碱法又称联合制碱法,是我国化学工程专家侯德榜于1943年所发明的一种高效,低成本的制碱方法,某化学兴趣小组模拟“侯氏制碱法”制纯碱,下列说法正确的是( )
A、元素X可能是锂 B、中各原子均达到8电子稳定结构 C、原子半径: D、元素气态氢化物的稳定性:15. 侯氏制碱法又称联合制碱法,是我国化学工程专家侯德榜于1943年所发明的一种高效,低成本的制碱方法,某化学兴趣小组模拟“侯氏制碱法”制纯碱,下列说法正确的是( ) A、乙装置中盛装液体为饱和溶液 B、纯碱是一种碱 C、纯碱可以做发酵粉和治疗胃酸过多 D、用装置丙中产生的制取时,需要进行的实验操作有过滤、洗涤、干燥、加热(灼烧)
A、乙装置中盛装液体为饱和溶液 B、纯碱是一种碱 C、纯碱可以做发酵粉和治疗胃酸过多 D、用装置丙中产生的制取时,需要进行的实验操作有过滤、洗涤、干燥、加热(灼烧)二、多选题
-
16. 短周期主族元素A~E在元素周期表中的位置如表所示,A组成的单质是空气中含量最高的物质。下列判断正确的是( )
A
B
C
D
E
A、原子半径:C>E B、最高正价:E>B>A C、A的非金属性在上述五种元素中最强 D、最高价氧化物对应水化物的酸性:A>C17. X、Y、Z、M是四种短周期主族元素,其中X、Y位于同一主族,Y与M、X与Z位于同一周期。X原子的最外层电子数是其电子层数的3倍,Z原子的核外电子数比X原子的少1。M是同周期主族元素中半径最大的。下列说法正确的是( )A、X、Y、Z的最简单氢化物中,X的最简单氢化物沸点最高 B、四种元素简单离子的半径大小为Y>X>Z>M C、Y的最高价氧化物对应水化物的化学式可表示为HYO3 D、X、Y、M可以组成多种离子化合物18. 几种短周期元素的原子半径及主要化合价如下表。元素代号
X
Y
Z
W
原子半径/mn
0.160
0.143
0.070
0.066
主要化合价
+2
+3
+5、+3、-3
-2
下列有关这几种元素的叙述中,正确的是( )
A、元素的金属性:X<Y B、元素Z的价电子数为7 C、元素的简单离子半径:r(X2+)<r(W2-) D、元素Y的最高价氧化物能溶于氢氧化钠19. X、Y、Z、M是四种短周期主族元素,其中X、Y位于同一主族,Y与M、X与Z位于同一周期。X原子的最外层电子数是其电子层数的3倍,Z原子的核外电子数比X原子的少1。M是同周期主族元素中半径最大的。下列说法错误的是( )A、X、Y、Z的最简单氢化物中,X的最简单氢化物沸点最高 B、四种元素简单离子的半径大小为Y>X>Z>M C、Y的最高价氧化物对应水化物的化学式可表示为HYO3 D、X、Y、M可以组成多种离子化合物20. X、Y、Z、W、R属于短周期主族元素,X的原子半径在短周期主族元素中最大,Y元素位于元素周期表的第二周期,Y元素原子的最外层电子数为m,次外层电子数为n,Z元素原子的L层电子数为m+n,M层电子数为m−n,W元素与Z元素同主族,R元素原子与Y元素原子的核外电子数之比为2∶1。下列叙述正确的是( )A、WY2、RY2都属于共价化合物 B、Y的简单气态氢化物比R的简单气态氢化物稳定 C、X与Y形成的两种化合物中阳、阴离子的个数比均为1∶2 D、Z、W、R最高价氧化物对应水化物的酸性由强到弱的顺序是R>Z>W三、非选择题
-
21. X、Y、Z、M、R、Q为六种短周期元素,其原子半径和最外层电子数之间的关系如图所示,请回答下列问题:
 (1)、Q的元素符号为;M在元素周期表中的位置为;(2)、实验室中R的单质可保存在中;(3)、R、M的简单离子的半径由大到小的顺序为(填离子符号);(4)、Y、Z的最简单气态氢化物的稳定性由强到弱的顺序为(填化学式)。22. 元素周期表的一部分如图,根据①~⑨在元素周期表中的位置,按题目要求回答下列问题:
(1)、Q的元素符号为;M在元素周期表中的位置为;(2)、实验室中R的单质可保存在中;(3)、R、M的简单离子的半径由大到小的顺序为(填离子符号);(4)、Y、Z的最简单气态氢化物的稳定性由强到弱的顺序为(填化学式)。22. 元素周期表的一部分如图,根据①~⑨在元素周期表中的位置,按题目要求回答下列问题: (1)、在元素②~⑧中,非金属性最强的元素是(填元素符号)。(2)、③~⑥四种元素的原子半径由大到小的顺序是(填元素符号)。(3)、⑧和⑨两种元素的最高价氧化物对应的水化物中酸性较强的是(填化学式)。(4)、由元素①和元素④形成的原子个数比为1∶1的化合物中所含化学键的种类为(填“离子键”、“极性共价键”或“非极性共价键”,有几种填几种);写出由元素⑤和元素④形成的原子个数比为1∶1的化合物的电子式:。(5)、写出元素⑦的单质与元素⑤的最高价氧化物对应的水化物之间反应的离子方程式:。(6)、元素⑤和元素⑧形成的常见化合物的化学式为 , 高温灼烧该化合物时,火焰呈色。23. 如图为元素周期表的一部分。门捷列夫预言了多种当时未知的元素,T为其中之一。已知J的原子序数是Z的两倍。
(1)、在元素②~⑧中,非金属性最强的元素是(填元素符号)。(2)、③~⑥四种元素的原子半径由大到小的顺序是(填元素符号)。(3)、⑧和⑨两种元素的最高价氧化物对应的水化物中酸性较强的是(填化学式)。(4)、由元素①和元素④形成的原子个数比为1∶1的化合物中所含化学键的种类为(填“离子键”、“极性共价键”或“非极性共价键”,有几种填几种);写出由元素⑤和元素④形成的原子个数比为1∶1的化合物的电子式:。(5)、写出元素⑦的单质与元素⑤的最高价氧化物对应的水化物之间反应的离子方程式:。(6)、元素⑤和元素⑧形成的常见化合物的化学式为 , 高温灼烧该化合物时,火焰呈色。23. 如图为元素周期表的一部分。门捷列夫预言了多种当时未知的元素,T为其中之一。已知J的原子序数是Z的两倍。L
Y
Z
X
J
Q
T
M
请回答如下问题:
(1)、L元素在周期表中的位置是(2)、下列说法不正确的是____________。A、Y与Q元素形成的化合物 YQ3中所有原子最外层都满足8电子结构 B、X、T 的最高价氧化物对应水化物碱性:X<T C、用 pH 试纸测得 Q单质的水溶液 pH=3 D、简单离子半径: X>Y>Z(3)、已知 JZQ2与 H2O 反应时有刺激性气味气体和白雾产生,试写出其化学反应方程式:(4)、非金属性 QM(用“<”、“=”、“>”来表示),判断依据是(试用一个化学方程式来表示)。24. 下表为元素周期表的一部分,表中列出了种元素在周期表中的位置,按要求完成下列各小题。主族
ⅠA
ⅡA
ⅢA
ⅣA
ⅤA
ⅥA
ⅦA
0
周期
2
⑥
⑦
⑨
3
①
③
⑤
⑧
⑩
4
②
④
⑪
(1)、化学性质最不活泼的元素是(填元素符号,下同),非金属性最强的元素。金属性最强的单质与水反应的离子方程式是。(2)、①、③、⑤三种元素的最高价氧化物水化物中,碱性最强的化合物的化学式是。(3)、①、③、⑤三种元素的原子半径由大到小的顺序是(元素符号表示)。(4)、⑥、⑦两种元素形成的最简单氢化物的稳定性由大到小的顺序(写化学式);写出⑦元素形成的简单氢化物的电子式。(5)、⑧、⑪两种元素形成的最简单氢化物的沸点由大到小的顺序(写化学式)。25. 随原子序数递增,x、y、z、……等八种短周期元素原子半径的相对大小、最高正价或最低负价的变化如图所示(已知:一般情况下当微粒电子层数相同时,核电荷数越大微粒半径越小;如半径: , ) (1)、g的离子结构示意图为。(2)、d、e、f、g、h的离子半径由大到小的顺序为(填离子符号)。(3)、元素g位于周期表的第族,其非金属性比h弱,用原子结构的知识解释原因:。请写出能证明h比g非金属性强的一个化学方程式:。(4)、g的一种氧化物是形成酸雨的主要原因之一,工业上用z的气态氢化物的水溶液作该氧化物的吸收剂,写出吸收剂与足量该氧化物反应的离子方程式:。(5)、f和z组成的化合物fz,被大量用于制造电子元件。工业上用f的氧化物、y单质和z单质在高温下制备fz,其中f的氧化物和y单质的物质的量之比为1:3,则该反应的化学方程式为。26. 已知X、Y、Z、W、M、N为短周期元素且原子序数依次增大,X与M、W与N分别同主族,且元素X、Y、Z、W分属两个短周期,它们四者原子序数之和为22,最外层电子数之和为16,在化合物、、中,相应分子内各原子最外层电子都满足稳定结构,请回答下列问题:(1)、Y元素在周期表中的位置是 , X、Y、Z、W、M的原子半径由大到小的顺序为:(用元素符号表示)。(2)、用电子式描述化合物的形成过程:。(3)、均含X、W、M、N四种元素的两种化合物相互反应有刺激性气味气体放出,反应的离子方程式为。(4)、火箭发动机曾经利用作燃料、作助燃剂,产物环保无污染,写出二者反应的化学方程式:。27. 为探究某橙色含结晶水的盐 X的组成和性质,设计并完成如下实验。请回答:
(1)、g的离子结构示意图为。(2)、d、e、f、g、h的离子半径由大到小的顺序为(填离子符号)。(3)、元素g位于周期表的第族,其非金属性比h弱,用原子结构的知识解释原因:。请写出能证明h比g非金属性强的一个化学方程式:。(4)、g的一种氧化物是形成酸雨的主要原因之一,工业上用z的气态氢化物的水溶液作该氧化物的吸收剂,写出吸收剂与足量该氧化物反应的离子方程式:。(5)、f和z组成的化合物fz,被大量用于制造电子元件。工业上用f的氧化物、y单质和z单质在高温下制备fz,其中f的氧化物和y单质的物质的量之比为1:3,则该反应的化学方程式为。26. 已知X、Y、Z、W、M、N为短周期元素且原子序数依次增大,X与M、W与N分别同主族,且元素X、Y、Z、W分属两个短周期,它们四者原子序数之和为22,最外层电子数之和为16,在化合物、、中,相应分子内各原子最外层电子都满足稳定结构,请回答下列问题:(1)、Y元素在周期表中的位置是 , X、Y、Z、W、M的原子半径由大到小的顺序为:(用元素符号表示)。(2)、用电子式描述化合物的形成过程:。(3)、均含X、W、M、N四种元素的两种化合物相互反应有刺激性气味气体放出,反应的离子方程式为。(4)、火箭发动机曾经利用作燃料、作助燃剂,产物环保无污染,写出二者反应的化学方程式:。27. 为探究某橙色含结晶水的盐 X的组成和性质,设计并完成如下实验。请回答: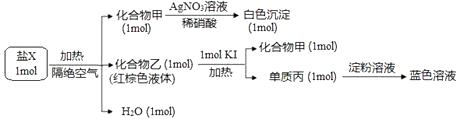 (1)、X的化学式是(2)、乙与 KI反应的化学方程式为:(3)、乙化学性质与其组成元素的单质相似,下列物质中能与乙发生反应的是A、Mg B、CaCl2 C、NaOH D、K2SO428. 根据题意解答(1)、在实验室里做钠跟水反应的实验时,可能用到的仪器是 . (填序号,多选不得分,少选扣分)
(1)、X的化学式是(2)、乙与 KI反应的化学方程式为:(3)、乙化学性质与其组成元素的单质相似,下列物质中能与乙发生反应的是A、Mg B、CaCl2 C、NaOH D、K2SO428. 根据题意解答(1)、在实验室里做钠跟水反应的实验时,可能用到的仪器是 . (填序号,多选不得分,少选扣分)a.试管夹 b.镊子 c.小刀 d.冷凝管 e.滤纸 f.研钵
g.烧杯 h.坩埚 i.石棉网 j.玻璃片 k.药匙 l.燃烧匙
(2)、某课外活动小组研究金属钾的性质.他们通过Na、K原子结构示意图及查找有关资料,知道了Na、K属于同一类物质,且K燃烧生成产物是KO2 . 请完成下列内容:①观察钾的切面.硬度: , 颜色:
②预测钾的性质,并进行实验验证(用化学方程式表示):
在空气中缓慢氧化:;
点燃,发生剧烈燃烧: .
③结论:钾是一种活泼的金属单质,其化学性质比钠活泼.
④该小组研究钾的性质用到了哪几种方法? .
(3)、用MnO2和浓盐酸制取纯净干燥的氯气,并让氯气与铜粉反应制取纯净的无水CuCl2 , 装置如图所示.
请回答下列问题:
①B中选用的试剂是饱和食盐水,其作用是;
②D中反应的化学方程式是;
③E中发生的反应的离子方程式是 .
29. 过氧化钙(CaO2)是一种白色、无毒、难溶于水的固体,能杀菌消毒,广泛用于果蔬保鲜、空气净化、污水处理等方面。(1)、CaO2溶于盐酸可得H2O2 , 反应的化学方程式是。(2)、CaO2在保存时要密封,避免接触水蒸气和二氧化碳。水蒸气与CaO2反应的化学方程式是 。(3)、已知:CaO2在350℃迅速分解生成CaO和O2。取某CaO2样品10 g(含有少量CaO杂质),充分加热后剩余固体的质量为8.4 g,则该样品中CaO2的质量分数为。