2023-2024学年 浙教版科学 八年级上册 期末复习重难点提升练 专题07 溶质的质量分数及相关计算
试卷更新日期:2023-12-21 类型:复习试卷
一、选择题
-
1. 硫酸镁在工农业以及医疗上有广泛应用,其溶解度如表所示。则下列说法正确的是( )
温度/℃
10
30
50
70
90
溶解度/g
27.7
39.3
49.0
54.1
51.1
A、硫酸镁的溶解度随温度升高而增大 B、10℃时,27.7g硫酸镁和72.3g水可配制成质量分数为27.7%的硫酸镁溶液 C、50℃时,100g的硫酸镁饱和溶液中溶质和溶剂的质量比为49:100 D、70℃时的硫酸镁饱和溶液升温至90℃,溶液的溶质质量分数增大2. 下图是对某固体物质的溶液在一定温度下进行恒温蒸发操作的实验记录,下列说法正确的是( ) A、乙中的溶液为饱和溶液 B、丁溶液的溶质质量分数大于丙 C、给丙溶液升高温度,固体一定会溶解 D、甲中的溶液一定是不饱和溶液3. 如图,某温度下,向一定量的水中不断加入食盐粉末并搅拌,能正确表示加入食盐的量 M 与所得溶液溶质质量分数w关系的图像是( )A、
A、乙中的溶液为饱和溶液 B、丁溶液的溶质质量分数大于丙 C、给丙溶液升高温度,固体一定会溶解 D、甲中的溶液一定是不饱和溶液3. 如图,某温度下,向一定量的水中不断加入食盐粉末并搅拌,能正确表示加入食盐的量 M 与所得溶液溶质质量分数w关系的图像是( )A、 B、
B、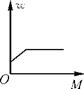 C、
C、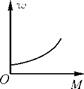 D、
D、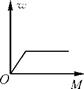 4. 为探究硝酸钾(KNO3)的溶解性,进行了如图所示实验(实验过程)结合硝酸钾在不同温度下的溶解度,判断下列说法不正确的是( )
4. 为探究硝酸钾(KNO3)的溶解性,进行了如图所示实验(实验过程)结合硝酸钾在不同温度下的溶解度,判断下列说法不正确的是( )
温度/℃
10
20
30
40
50
60
KNO3溶解度/g
20.9
31.6
45.8
63.9
85.5
110.0
A、①③中的溶液均为不饱和溶液 B、②③中溶液的质量:③>② C、②③④中溶液的溶质质量分数:③>②>④ D、④中析出晶体的质量是0.9g5. 下列关于 a、b 数值的比较中,a 一定小于 b 的是( )
A、不饱和溶液中溶质的质量分数为 a%,饱和溶液中溶质的质量分数为 b% B、同一饱和溶液中,溶质的质量分数为 a%,溶解度为 b 克 C、某物质的饱和溶液中溶质的质量分数为 a%,向其中加入少量该物质后,溶质的质量分数为 b% D、某物质的溶解度在低温时为 a 克,高温时为 b 克6. 现有100克质量分数为15%的硝酸钾溶液,若要使溶质的质量分数增大1倍,可采用的方法是( )A、增加15克硝酸钾 B、蒸发50克水 C、倒出50克硝酸钾溶液 D、使硝酸钾的溶解度达到30克7. 要使含水99%的a克氯化钠溶液中的含水量降为98%,应蒸发掉水的质量为( )A、0.1a克 B、a克 C、0.5a克 D、0.2a克8. 向50克水中加100克稀硫酸,混合后硫酸溶液的溶质质量分数为12%,则原稀硫酸溶液的溶质质量分数为( )A、20% B、18% C、8% D、6%9. 农业上常用饱和食盐水选种。在室温保持不变的情况下,饱和食盐水露置在空气中一段时间后,有少量固体析出。对此过程的描述,下列图象正确的是( )A、 B、
B、 C、
C、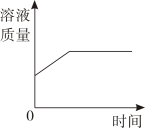 D、
D、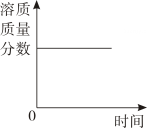 10. 某温度下,a克物质溶于水形成100克饱和溶液,则此物质在该温度下的溶解度是( )A、100克 B、a克 C、克 D、以上均不正确
10. 某温度下,a克物质溶于水形成100克饱和溶液,则此物质在该温度下的溶解度是( )A、100克 B、a克 C、克 D、以上均不正确二、填空题
-
11. 20℃时,将等质量的甲、乙两种固体物质(不含结晶水)分别加入到盛有100g水的烧杯中,充分搅拌后现象如图1所示,加热到50℃时现象如图2所示。
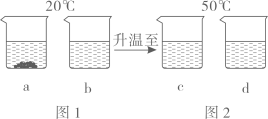 (1)、a、b、c、d四个烧杯中的溶液,在相应温度下一定属于饱和溶液的是。(2)、a、b、c、d四个烧杯中的溶液,其溶质质量分数的大小关系是。12. 常温下,取100克质量分数为5%的NaCl溶液,先按实验1将NaCl溶液分成两等份,再进行实验2操作,如图所示。完成下列问题:
(1)、a、b、c、d四个烧杯中的溶液,在相应温度下一定属于饱和溶液的是。(2)、a、b、c、d四个烧杯中的溶液,其溶质质量分数的大小关系是。12. 常温下,取100克质量分数为5%的NaCl溶液,先按实验1将NaCl溶液分成两等份,再进行实验2操作,如图所示。完成下列问题: (1)、配置100克质量分数为5%的NaCl溶液,不需要用到的仪器是____;A、集气瓶 B、烧杯 C、玻璃棒 D、量筒(2)、完成实验2操作后,比较甲、乙两只烧杯中溶液的溶质质量分数,其大小关系是(选填“大于”“等于”或“小于”)。13. 现有20℃时质量分数为15%的硝酸钾溶液500克。从溶液中取出100克,其溶质的质量分数为 , 含溶剂的质量是克。若将取出的100克硝酸钾恒温蒸发掉20克水,析出晶体3克,继续蒸发掉20克水,析出晶体6克,则硝酸钾在此温度下的饱和溶液溶质质量分数是(精确到1%)。14. 氯化钠和硝酸钾在不同温度时的溶解度,根据此表回答:
(1)、配置100克质量分数为5%的NaCl溶液,不需要用到的仪器是____;A、集气瓶 B、烧杯 C、玻璃棒 D、量筒(2)、完成实验2操作后,比较甲、乙两只烧杯中溶液的溶质质量分数,其大小关系是(选填“大于”“等于”或“小于”)。13. 现有20℃时质量分数为15%的硝酸钾溶液500克。从溶液中取出100克,其溶质的质量分数为 , 含溶剂的质量是克。若将取出的100克硝酸钾恒温蒸发掉20克水,析出晶体3克,继续蒸发掉20克水,析出晶体6克,则硝酸钾在此温度下的饱和溶液溶质质量分数是(精确到1%)。14. 氯化钠和硝酸钾在不同温度时的溶解度,根据此表回答:温度/℃
20
30
40
50
60
溶解度/g
氯化钠
36.0
36.3
36.6
37.0
37.3
硝酸钾
31.6
45.8
63.9
85.5
110
(1)、50℃时,在100g水中加入40g氯化钠,充分搅拌后得到的溶液质量分数为(精确到1%)(2)、由表中数据分析可知,硝酸钾和氯化钠在某一温度时具有相同的溶解度X,则X的取值范围是。15. 某同学进行硫酸铜晶体(化学式为CuSO4·5H2O)的制备和生长实验,配制了某温度时的硫酸铜热饱和溶液,静置、冷却到室温,观察晶体的生长,如图。 (1)、能判断原硫酸铜溶液已饱和的方法是____。A、观察颜色,溶液蓝色较深 B、溶液冷却,有蓝色晶体析出 C、蒸发少量水,有蓝色晶体析出 D、加入硫酸铜晶体,晶体质量不变(2)、现称取49克无水硫酸铜溶于水,配成150克某温度时的热饱和溶液,再冷却到室温,共析出50克硫酸铜晶体,请计算该室温时硫酸铜饱和溶液的溶质质量分数。
(1)、能判断原硫酸铜溶液已饱和的方法是____。A、观察颜色,溶液蓝色较深 B、溶液冷却,有蓝色晶体析出 C、蒸发少量水,有蓝色晶体析出 D、加入硫酸铜晶体,晶体质量不变(2)、现称取49克无水硫酸铜溶于水,配成150克某温度时的热饱和溶液,再冷却到室温,共析出50克硫酸铜晶体,请计算该室温时硫酸铜饱和溶液的溶质质量分数。三、实验探究题
-
16. 下表是部分物质的溶解度数据。
温度(℃)
20
40
50
60
80
溶解度 (g/100g 水)
氯化铵
37.2
45.8
50.4
55.2
65.6
氯化钠
36.0
36.6
37.0
37.3
38.4
硝酸钾
31.6
63.9
85.5
110
169
(1)、氯化铵溶于水,温度降低,说明该溶解过程 (选填“吸收 ”或“放 出 ”)热量。(2)、20℃时,20克的氯化钠加入50g水中,充分溶解后溶液质量 g。(3)、A是80℃含有120g水的硝酸钾(KNO3 )溶液。经过如下操作,得到102g硝酸钾固 体。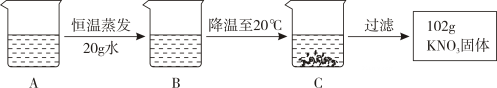
a、A溶液为 (选填“饱和 ”或“不饱和 ”)溶液。
b、下列对以上过程的分析中正确的是 (填数字)。
①.A到B的过程中,溶质质量分数没有改变 ②.B中溶质与溶剂的质量比为169:100
③.开始析出硝酸钾固体的温度在60℃至80℃之间 ④.A溶液的质量等于222g
17. 下图是实验室配制一定溶质质量分数的氯化钠溶液的步骤示意图。请回答下列问题: (1)、应称量g氯化钠。(2)、若称量氯化钠时,指针向左偏转,则应。(3)、下列实验操作与目的分析均正确的一组是。
(1)、应称量g氯化钠。(2)、若称量氯化钠时,指针向左偏转,则应。(3)、下列实验操作与目的分析均正确的一组是。项目
实验操作
目的分析
A
称量时,将取出的过量氯化钠放回原瓶
节约药品
B
溶解氯化钠时用玻璃棒搅拌
增大氯化钠的溶解度
C
称取氯化钠时,在天平两边托盘上各放一张质量相等的纸
整洁美观
D
量取所需水量时,视线与量筒内液体凹液面的最低处保持相平
准确读数
(4)、实验过程中发现称量的氯化钠固体全部溶于水中,若要判断所得溶液是否为该温度下的饱和溶液,应采用的实验操作及观察要点是:。18. 配制一定溶质质量分数的氯化钠溶液是初中化学的基础实验之一。请回答下列问题:(1)、现欲配制一瓶75g溶质质量分数为10%的氯化钠溶液,请用图中的序号表示配制溶液的正确操作顺序。 (2)、认真观察,图中某步骤错误,写出该步骤的正确操作为。若不进行改正,其他操作步骤正确(使用游码),则所配制溶液的溶质的质量分数(填“大于”、“小于”或“等于”)10%。(3)、t℃时某氯化钠溶液400克,在温度不变的情况下,第一次蒸发20克水,析出晶体4克;第二次又蒸发20克水,析出晶体6克。则t℃时氯化钠的溶解度为克。
(2)、认真观察,图中某步骤错误,写出该步骤的正确操作为。若不进行改正,其他操作步骤正确(使用游码),则所配制溶液的溶质的质量分数(填“大于”、“小于”或“等于”)10%。(3)、t℃时某氯化钠溶液400克,在温度不变的情况下,第一次蒸发20克水,析出晶体4克;第二次又蒸发20克水,析出晶体6克。则t℃时氯化钠的溶解度为克。四、解答题
-
19. 氢氧化钠常温下是一种白色晶体,具有强腐蚀性。易溶于水,在生产染料、塑料、药剂等方面也要使用大量的氢氧化钠。现用质量分数为16%的氢氧化钠溶液(密度为1.2g/cm3)去配制60g质量分数为8%的氢氧化钠溶液。(1)、60g质量分数为8%的氢氧化钠溶液中,溶质的质量为克。(2)、需要质量分数为16%的氢氧化钠溶液多少毫升?需要水多少毫升?20. 如图是硫酸的密度和浓度的对照表,阅读后计算:
硫酸的密度和硫酸溶液中溶质的质量分数对照表(20℃)
密度(克/厘米3)
1.01
1.07
1.14
1.22
1.30
1.40
1.50
1.61
1.73
1.81
1.84
质量分数(%)
1
10
20
30
40
50
60
70
80
90
98
(1)、欲配制1000克溶质质量分数为9.8%的稀硫酸,需要98%浓硫酸多少毫升?再加水多少毫升?(2)、100毫升90%的硫酸与144.8毫升水混合后所得溶液的密度为多少?21. 二氧化氯消毒液是一种消毒剂,一瓶二氧化氯消毒液的标签如右图所示,试回答: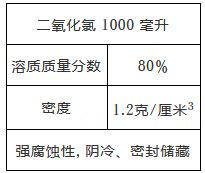 (1)、取该二氧化氯消毒液200毫升,其中含溶质二氧化氯多少克?(2)、若将这200毫升二氧化氯消毒液与1千克水均匀混合,所得稀二氧化氯消毒液中二氧化氯的质量分数是多少?(小数点后保留一位有效数字)(3)、该校欲配置60千克20%的稀二氧化氯消毒液用以消毒,需多少千克这种二氧化氯消毒液和多少升水?22. 由于水的导电性很弱,为了增强水的导电性,做电解水实验时常在水中加入少量氢氧化钠固体(在水电解过程中,氢氧化钠质量和性质都不发生变化)。把180克氢氧化钠的质量分数为1%的溶液进行电解,电解结束后氢氧化钠的质量分数为1.5%。(1)、180克氢氧化钠溶液中含有溶质氢氧化钠的质量为多少?(2)、在水电解过程中,有多少克水被电解了?(3)、在配制1%的氢氧化钠溶液时,不会引起溶液中氢氧化钠的质量分数偏小的是____。A、量筒量取水时仰视 B、烧杯用蒸馏水润洗后直接配制溶液 C、转移已配好的溶液时,有少量液体溅出 D、将称量好的氢氧化钠转移到烧杯中,有部分洒落在桌上23. 如图是某学校实验室从化学试剂商店买回的硫酸试剂的标签上的部分内容,阅读后计算:
(1)、取该二氧化氯消毒液200毫升,其中含溶质二氧化氯多少克?(2)、若将这200毫升二氧化氯消毒液与1千克水均匀混合,所得稀二氧化氯消毒液中二氧化氯的质量分数是多少?(小数点后保留一位有效数字)(3)、该校欲配置60千克20%的稀二氧化氯消毒液用以消毒,需多少千克这种二氧化氯消毒液和多少升水?22. 由于水的导电性很弱,为了增强水的导电性,做电解水实验时常在水中加入少量氢氧化钠固体(在水电解过程中,氢氧化钠质量和性质都不发生变化)。把180克氢氧化钠的质量分数为1%的溶液进行电解,电解结束后氢氧化钠的质量分数为1.5%。(1)、180克氢氧化钠溶液中含有溶质氢氧化钠的质量为多少?(2)、在水电解过程中,有多少克水被电解了?(3)、在配制1%的氢氧化钠溶液时,不会引起溶液中氢氧化钠的质量分数偏小的是____。A、量筒量取水时仰视 B、烧杯用蒸馏水润洗后直接配制溶液 C、转移已配好的溶液时,有少量液体溅出 D、将称量好的氢氧化钠转移到烧杯中,有部分洒落在桌上23. 如图是某学校实验室从化学试剂商店买回的硫酸试剂的标签上的部分内容,阅读后计算:浓硫酸(H2SO4)500毫升
浓度(质量分数)
98%
密度
1.84克/厘米3
相对分子质量
98
强腐蚀性,阴冷,密封贮藏
(1)、这瓶浓硫酸的含溶质g。(2)、欲配制600克溶质质量分数为19.6%的稀硫酸,需要这种硫酸多少毫升?