黑龙江省克东县“五校联谊”2023-2024学年高一上学期期中考试化学试题
试卷更新日期:2023-12-21 类型:期中考试
一、选择题:本题共15小题,每小题3分,共45分。在每小题给出的四个选项中,只有一项是符合题目要求的。
-
1. 使用含氯泡腾片[主要成分为二氧化氯]可有效杀死病毒。下列关于二氧化氯的说法正确的是( )
 A、属于酸 B、属于碱 C、属于盐 D、属于氧化物2. 我国科学家在世界上第一次为一种名为“钴酞菁”的分子(直径为1.3nm)恢复了磁性,下列关于“钴酞菁”分子的说法正确的是( )A、其在水中形成的分散系属于溶液 B、“钴酞菁”分子直径比的直径小 C、其在水中形成的分散系能产生丁达尔效应 D、“钴酞菁”分子不能透过滤纸3. 下列物质在给定条件下的转化均能一步实现的是( )A、 B、 C、 D、4. 常温下,下列溶液中的微粒能大量共存的是( )A、加入铁产生氢气的溶液: B、的溶液: C、加入硫酸镁的溶液: D、加入氢氧化钠的溶液:5. 现有一种固体化合物X不导电,但熔融状态或溶于水导电,下列关于X的说法中,正确的是( )A、X一定为电解质 B、X可能为非电解质 C、X只能是盐类 D、X只能是碱类6. 关于钠的单质及其化合物的叙述正确的是( )A、金属钠长期露置于空气中,最终变为碳酸钠 B、与水反应是水做还原剂的氧化还原反应 C、、都能与二氧化碳反应并生成 D、、都能与水反应,且都是碱性氧化物7. 某同学向一定体积的Ba(OH)2溶液中滴加稀硫酸,测得混合溶液的导电能力随时间的变化如图所示。下列说法中正确的是( )
A、属于酸 B、属于碱 C、属于盐 D、属于氧化物2. 我国科学家在世界上第一次为一种名为“钴酞菁”的分子(直径为1.3nm)恢复了磁性,下列关于“钴酞菁”分子的说法正确的是( )A、其在水中形成的分散系属于溶液 B、“钴酞菁”分子直径比的直径小 C、其在水中形成的分散系能产生丁达尔效应 D、“钴酞菁”分子不能透过滤纸3. 下列物质在给定条件下的转化均能一步实现的是( )A、 B、 C、 D、4. 常温下,下列溶液中的微粒能大量共存的是( )A、加入铁产生氢气的溶液: B、的溶液: C、加入硫酸镁的溶液: D、加入氢氧化钠的溶液:5. 现有一种固体化合物X不导电,但熔融状态或溶于水导电,下列关于X的说法中,正确的是( )A、X一定为电解质 B、X可能为非电解质 C、X只能是盐类 D、X只能是碱类6. 关于钠的单质及其化合物的叙述正确的是( )A、金属钠长期露置于空气中,最终变为碳酸钠 B、与水反应是水做还原剂的氧化还原反应 C、、都能与二氧化碳反应并生成 D、、都能与水反应,且都是碱性氧化物7. 某同学向一定体积的Ba(OH)2溶液中滴加稀硫酸,测得混合溶液的导电能力随时间的变化如图所示。下列说法中正确的是( ) A、a时刻Ba(OH)2溶液与稀硫酸没有完全反应 B、AB段溶液的导电能力减弱,说明生成的BaSO4不是电解质 C、BC段溶液的导电能力增大,主要是由于过量的H2SO4电离出的离子导电 D、实验过程中反应的离子方程式为8. 下列物质的性质与用途具有对应关系的是( )A、盐酸有挥发性,可用于除铁锈 B、能溶于水,可用于工业制盐酸 C、NaClO具有强氧化性,可用作漂白剂 D、NaOH显碱性,可用作干燥剂9. 下列化学反应的离子方程式书写正确的是( )A、用小苏打治疗胃酸过多: B、氧化镁与稀盐酸反应: C、氢氧化钡溶液跟硫酸镁反应: D、氢氧化铜和稀盐酸反应:10. 下列关于液氯和氯水的叙述正确的是( )A、液氯具有较强的漂白性 B、液氯与氯水均有酸性 C、液氯与氯水均可导电 D、氯水放置数天后pH将变小11. 是一种广谱型的消毒剂,根据世界环保联盟的要求,将逐渐取代成为生产自来水的消毒剂。工业上常用和溶液混合并加酸化后反应制得,在以上反应中氧化剂与还原剂的个数之比为( )A、 B、 C、 D、12. 已知: , 实验室制取氯气时,下列实验装置能达到实验目的的是( )A、
A、a时刻Ba(OH)2溶液与稀硫酸没有完全反应 B、AB段溶液的导电能力减弱,说明生成的BaSO4不是电解质 C、BC段溶液的导电能力增大,主要是由于过量的H2SO4电离出的离子导电 D、实验过程中反应的离子方程式为8. 下列物质的性质与用途具有对应关系的是( )A、盐酸有挥发性,可用于除铁锈 B、能溶于水,可用于工业制盐酸 C、NaClO具有强氧化性,可用作漂白剂 D、NaOH显碱性,可用作干燥剂9. 下列化学反应的离子方程式书写正确的是( )A、用小苏打治疗胃酸过多: B、氧化镁与稀盐酸反应: C、氢氧化钡溶液跟硫酸镁反应: D、氢氧化铜和稀盐酸反应:10. 下列关于液氯和氯水的叙述正确的是( )A、液氯具有较强的漂白性 B、液氯与氯水均有酸性 C、液氯与氯水均可导电 D、氯水放置数天后pH将变小11. 是一种广谱型的消毒剂,根据世界环保联盟的要求,将逐渐取代成为生产自来水的消毒剂。工业上常用和溶液混合并加酸化后反应制得,在以上反应中氧化剂与还原剂的个数之比为( )A、 B、 C、 D、12. 已知: , 实验室制取氯气时,下列实验装置能达到实验目的的是( )A、 制取
B、
制取
B、 除去中的少量HCl
C、
除去中的少量HCl
C、 干燥
D、
干燥
D、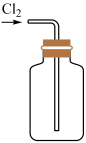 收集
13. 根据下列实验操作和现象所得到的结论不正确的是( )
收集
13. 根据下列实验操作和现象所得到的结论不正确的是( )选项
实验操作和现象
结论
A
用洁净铂丝蘸取某溶液在火焰上灼烧,火焰呈黄色
该溶液中一定含有钠元素
B
取少量氧化钠固体在空气中继续加热,固体变为淡黄色
氧化钠与氧气生成过氧化钠
C
取久置的粉末,向其中滴加过量的盐酸,产生无色气体
没有变质
D
将金属钠在燃烧匙中点燃,迅速伸入集满的集气瓶中,瓶中产生大量的烟和黑色颗粒
黑色颗粒是炭
A、A B、B C、C D、D14. 把图2中的物质补充到图1中,可得到一个完整的氧化还原型离子方程式(未配平)。
对该氧化还原反应型离子方程式,说法不正确的是( )
A、作氧化剂具有氧化性 B、氧化剂和还原剂的个数之比为 C、若有2个参加反应时则转移电子的个数为10 D、氧化性:15. 有一包固体粉末X,可能含有碳酸钙、硫酸铜、硫酸亚铁、镁粉。为确定固体粉末的成分,现取X进行下列实验,实验过程及现象如下图所示(不考虑水、稀盐酸的挥发:碳酸钙与硫酸铜、硫酸亚铁不发生化学反应)。下列说法中正确的是( ) A、若气体1为纯净物,则原固体X一定不含有碳酸钙 B、若气体1为混合物,则溶液2中可能含有Fe2+、Cu2+、Ca2+ C、若溶液1呈无色,则固体粉末X中不可能含有硫酸铜 D、若溶液2呈浅绿色,则沉淀2一定是纯净物
A、若气体1为纯净物,则原固体X一定不含有碳酸钙 B、若气体1为混合物,则溶液2中可能含有Fe2+、Cu2+、Ca2+ C、若溶液1呈无色,则固体粉末X中不可能含有硫酸铜 D、若溶液2呈浅绿色,则沉淀2一定是纯净物二、非选择题:本题共4小题,共55分。
-
16. “分类研究”是重要的学习与科研方法。现有下列9种物质:①HCl气体;②NaCl固体;③;④蔗糖;⑤固体;⑥熔融;⑦氢氧化铁胶体;⑧硫酸溶液;⑨铜。回答下列问题:(1)、上述物质中属于电解质的有 , 能导电的纯净物有。(填序号)(2)、NaCl溶于水的电离方程式为。(3)、上述9种物质中有两种物质在水溶液中发生反应的离子方程式为 , 则该反应的化学方程式为。(4)、溶液与足量的溶液反应的离子方程式为。(5)、实验室制备⑦,需要在沸水中滴加(填化学式)饱和溶液,反应的化学方程式为。17. 下图是一些单质及其化合物之间的转化关系图。常温常压下,D、F、K均为无色无刺激性气味的气体,B是最常见的无色液体,A是由单质C在D中燃烧生成的淡黄色固体。(反应中生成的部分物质已略去)
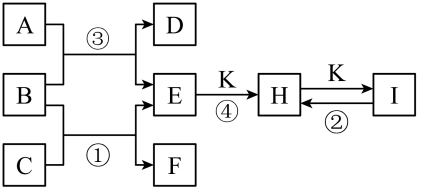
回答下列问题:
(1)、物质A、I的化学式为、。(2)、单质C的实验室保存方法是。(3)、反应③的化学方程式为。(4)、写出反应①的化学方程式并用双线桥法表示电子转移的方向和数目: , 该反应中氧化剂与还原剂质量之比为。(5)、反应④的化学方程式为。18. 经检测,某化工厂排出的废水呈酸性,且其中含有大量。回答下列问题:(1)、下列离子中,能大量存在于该废水中的是____(填字母)。A、 B、 C、 D、(2)、取该废水于烧杯中,向烧杯中逐滴加入溶液至溶液呈碱性,此过程中,原废水中存在的离子的量会发生变化的是、(用离子符号表示)。(3)、某化学社团小组成员欲除去废水样品中的和 , 最终得到中性溶液,设计的方案流程如图所示。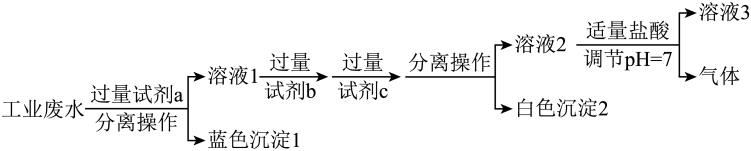
①试剂a、c分别为、(写化学式);“溶液3”所含的溶质离子有、(写离子符号)。
②“分离操作”的名称是。
③向“白色沉淀2”中加入足量盐酸,发生反应的离子方程式为。
19. 某小组使用下图装置制取并收集干燥、纯净的氯气,请回答下列问题:
 (1)、A装置中仪器a的名称是 , 的作用是。
(1)、A装置中仪器a的名称是 , 的作用是。已知常温下即可与浓盐酸反应生成 , 请配平化学方程式:。
, 其中做还原剂的HCl占参与反应的HCl的(填分数)。
(2)、B装置中盛放的试剂是 , 其作用是。D装置处理尾气时,使用NaOH溶液而不用澄清石灰水吸收氯气的原因是。若将图1收集到的氯气通入图2所示装置中,可观察到的现象为。(3)、查阅资料知次氯酸或氯气可被还原成 , 设计实验方案测定某氯水中氯元素质量:。