河北省石家庄市多校2023-2024学年高一上学期期中考试化学试题
试卷更新日期:2023-12-20 类型:期中考试
一、选择题:本题共14小题,每小题3分,共42分.在每小题给出的四个选项中,只有一项是符合题目要求的.
-
1. 化学与生活生产科技环境等关系密切.下列说法错误的是( )A、蔗糖(纯净物)在水溶液和熔融状态下均不能导电,所以蔗糖属于非电解质 B、我国成功研制出纳米片,该化合物属于碱 C、钠着火可用干燥的沙土或石棉布盖灭 D、碳酸氢钠受热易分解,可用作焙制糕点的膨松剂2. 中国传统文化对人类文明贡献巨大.下列关于古代文献的表述不合理的是( )A、《准南万毕术》中记载:“曾青得铁则化为铜”,铁为还原剂. B、《天工开物》中记载:“凡铁分生熟,出炉未炒则生,既炒则熟”中,“炒”为氧化除碳过程. C、《本草经集注》中记载:“强烧之,紫青烟起,云是硝石也”,利用的是焰色试验区分硝石()和朴硝(). D、《天工开物》中记载:“凡火药,硫为纯阳,硝为纯阴”,不涉及氧化还原反应.3. 下列对常见物质的分类正确的是( )
选项
酸
碱
盐
混合物
A
KOH
自来水
B
HCl
纯碱
盐酸
C
烧碱
KCl
硫酸铁溶液
D
洁净的空气
A、A B、B C、C D、D4. 下列说法正确的是( )A、NaCl溶于水,在通电条件下才能发生电离 B、非金属单质与反应生成的产物为酸性氧化物 C、食物的腐败和钟乳石的形成过程均涉及氧化还原反应 D、生石灰可做食品干燥剂5. 下列离子反应方程式表达正确的是( )A、将稀盐酸滴在石灰石上: B、少量二氧化碳通入氢氧化钠溶液中: , C、向碳酸氢钠溶液中加入少量石灰水: D、还原性较强,过量通入NaClO溶液中:6. 下列关于物质之间转化的说法正确的是( )A、转化为 , 需要加入氧化剂才能实现 B、向NaClO溶液中加入还原剂可将其转化为NaCl C、溶液中通入可将其转化为 D、加入还原剂可实现的转化7. 下列实验现象和结论相符的是( )操作及现象
结论
A
某溶液中加入盐酸,产生能使澄清石灰水变浑浊的无色无味气体
溶液中一定含有
B
向某溶液中滴加氢氧化钠溶液,微热,将湿润的蓝色石蕊试纸放在试管口,试纸变红
溶液中一定含有
C
用洁净铂丝蘸取某溶液在火焰上灼烧,火焰呈黄色
该溶液一定为钠盐溶液
D
向某溶液中先加足量稀盐酸,无沉淀,再加入溶液,有白色沉淀生成
溶液中一定含有
A、A B、B C、C D、D8. 设阿伏加德罗常数的值为 , 则下列说法正确的是( )A、常温常压下,32g和的混合物中含有原子数为 B、常温下,7.8g固体中含有阴阳离子总数为 C、的溶液中所含阴离子数目为 D、标准状况下,11.2L中含有氢原子数为9. 将一定浓度的稀溶液分为两等份放入烧杯中,分别向其中滴入等浓度的稀和稀溶液,两份溶液导电能力随滴入溶液的体积变化曲线如图.下列分析正确的是( ) A、a→b发生的反应离子方程式为: B、曲线②代表滴加溶液的变化曲线 C、a→c发生反应的离子方程式为: D、a、c两点对应的溶液均为中性10. 下列实验中,能实现实验目的的是( )
A、a→b发生的反应离子方程式为: B、曲线②代表滴加溶液的变化曲线 C、a→c发生反应的离子方程式为: D、a、c两点对应的溶液均为中性10. 下列实验中,能实现实验目的的是( )选项
A
B
C
D
实验




目的
Na在空气中燃烧
配制100mL稀硫酸
制备氢氧化铁胶体
除去中少量HCl
A、A B、B C、C D、D11. 对固体充分加热,产生的气体先通过足量浓硫酸,再通过足量 , 增重0.28g,则固体的质量为( )A、0.42g B、1.68g C、0.84g D、3.36g12. 氯元素可形成多种物质,为了研究方便,绘制氯及其化合物的价类二维图如图所示,下列说法不正确的是( ) A、a溶液与e溶液混合一定条件下可发生氧化还原反应 B、可用pH试纸测定b的水溶液的pH值 C、c溶液中通入二氧化碳可增强其漂白、杀菌消毒的能力 D、d可用于自来水的杀菌消毒13. 某兴趣小组设计了如图所示实验装置,验证Na与能否发生反应.已知能被CO还原得到黑色的金属Pd.加热D装置中硬质玻璃管一段时间,观察到以下现象:
A、a溶液与e溶液混合一定条件下可发生氧化还原反应 B、可用pH试纸测定b的水溶液的pH值 C、c溶液中通入二氧化碳可增强其漂白、杀菌消毒的能力 D、d可用于自来水的杀菌消毒13. 某兴趣小组设计了如图所示实验装置,验证Na与能否发生反应.已知能被CO还原得到黑色的金属Pd.加热D装置中硬质玻璃管一段时间,观察到以下现象:①钠块表面变黑,熔融成小球;
②继续加热,钠燃烧产生黄色火焰,硬质玻璃管中有大量黑色和白色固体产生;
③F中试管内壁有黑色沉淀产生.
下列说法不正确的是( )
 A、B中盛放饱和NaCl溶液,C中盛放浓硫酸 B、连接装置,打开和 , 通入待E中出现白色沉淀后,再点燃酒精灯 C、D中产生的黑色固体为碳单质 D、F装置和气球的作用为检验并收集CO,防止CO污染空气14. 向浓度相等、体积均为50mL的A、B两份NaOH溶液中,分别通入一定量的后,再稀释到100mL.在稀释后的溶液中逐滴加入的盐酸,产生的体积(标准状况)与所加盐酸的体积关系如图所示.下列说法不正确的是( )
A、B中盛放饱和NaCl溶液,C中盛放浓硫酸 B、连接装置,打开和 , 通入待E中出现白色沉淀后,再点燃酒精灯 C、D中产生的黑色固体为碳单质 D、F装置和气球的作用为检验并收集CO,防止CO污染空气14. 向浓度相等、体积均为50mL的A、B两份NaOH溶液中,分别通入一定量的后,再稀释到100mL.在稀释后的溶液中逐滴加入的盐酸,产生的体积(标准状况)与所加盐酸的体积关系如图所示.下列说法不正确的是( ) A、A曲线说明,A原溶液通的体积为0.112L(标准状况) B、B曲线说明,B原溶液通入后,所得溶质成分为NaOH、 C、当所加盐酸体积为75mL时,A、B两溶液所含溶质相同,浓度不同 D、原NaOH溶液的物质的量浓度为
A、A曲线说明,A原溶液通的体积为0.112L(标准状况) B、B曲线说明,B原溶液通入后,所得溶质成分为NaOH、 C、当所加盐酸体积为75mL时,A、B两溶液所含溶质相同,浓度不同 D、原NaOH溶液的物质的量浓度为二、非选择题:本题共4个大题,共58分.
-
15. “分类”的思想在化学学习及化学学科发展中起着重要作用.现有下列物质:
①固体 ②熔融 ③淀粉溶液 ④液态氯化氢 ⑤NaCl溶液 ⑥ ⑦金属铜 ⑧ ⑨酒精 ⑩
回答下列问题:
(1)、以上物质中属于电解质的是(填序号,下同),属于非电解质的是 .(2)、②熔融能导电,其电离方程式为 .(3)、③淀粉溶液所属分散系为 , ⑤NaCl溶液所属分散系为 , 二者如果混合,可采用方法分离.(4)、⑧与水的反应属于氧化还原反应,化学方程式为 , 该反应中是(“氧化剂”“还原剂”或“既是氧化剂又是还原剂”),每当有1mol参与反应,转移电子数为(设为阿伏加德罗常数的值).(5)、已知⑨(次磷酸)与足量KOH溶液反应的化学方程式为 , 属于(填“正盐”或“酸式盐”).16. 纯碱在日常生活和工业生产中有着广泛的应用.化工专家侯德榜发明的“侯氏制碱法”为我国纯碱工业和国民经济发展做出了重要贡献.“侯氏制碱法”的反应原理是: , 实验室先用下图装置模拟“侯氏制碱法”制备纯碱,然后再对纯碱样品进行含量测定和分离提纯.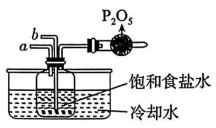
请回答下列问题:
(1)、在饱和食盐水中应该由先由管通、再由管通 .(2)、将反应后溶液进行 , 得到纯碱样品.(3)、经过分析,纯碱样品中可能含有的杂质为NaCl,如何证明含有NaCl,请写出检验方法 .(4)、为了测定纯碱样品中的质量分数,设计如下实验方案:称取6.0g纯碱样品,加入足量稀盐酸,将产生的气体通入碱石灰中进行吸收,测得碱石灰的质量增加2.4g,进而计算碳酸钠的质量分数.请问该实验方案是否可行(“可行”或“不可行”),若可行,请计算出碳酸钠的质量分数(保留小数点后一位).如果不可行,请写出改进方案: .(5)、如图为NaCl、在水中的溶解度曲线.请结合溶解度曲线,分析除去纯碱样品中的氯化钠杂质的具体操作为 .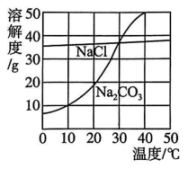 17. 很多化学反应条件不同,产物不同,如与KOH反应,常温下生成KClO,加热生成 . 实验室利用下图装置制备 , 然后进一步探究其性质.
17. 很多化学反应条件不同,产物不同,如与KOH反应,常温下生成KClO,加热生成 . 实验室利用下图装置制备 , 然后进一步探究其性质.
回答下列问题:
(1)、装置a可用于实验室制 , 反应的化学方程式是 .(2)、装置b的作用是 , 可选用溶液.(3)、c中采用的加热方式是 , 反应的离子方程式为 , 该反应中氧化剂和还原剂的物质的量之比为 .(4)、若d装置中溶液是NaOH溶液,其作用是 .(5)、取c中溶液,滴加浓盐酸并加热,可产生黄绿色气体,结合上述的制备实验,可说明在碱性条件下氧化性:(填“>”“<”或“=”,下同),酸性条件下氧化性: .18. 实验室中配制一定物质的量浓度的溶液一般分为两种情况,用固体配制溶液或者用浓溶液配制稀溶液.请依据以下情况回答问题:(1)、Ⅰ.实验室需要溶液480mL,即用胆矾()配制该溶液.
配制溶液时需要的玻璃仪器有 .(2)、实验前需要对配制溶液所用容量瓶进行 .(3)、配制溶液的第一步是计算,若该实验用托盘天平称量,需要称取g胆矾晶体.(4)、下列操作导致配制的溶液浓度偏大的是____.A、称量时砝码和胆矾位置放反 B、未洗涤烧杯和玻璃棒 C、定容时俯视容量瓶刻度线 D、摇匀后发现液面低于刻度线(5)、使用该“84消毒液”,需要事先进行稀释,现在实验室利用该“84消毒液”稀释配制成250mLNaClO溶液,需要用mL该溶液,在量取时宜选用量筒的规格为 .A.5mL B.10mL C.25mL D.50mL
(6)、“84消毒液”与稀盐酸混合使用可增强其漂白效果,原因是(用离子方程式表示,下同),但“84消毒液”却不能与“洁厕灵”(浓盐酸)混合使用,原因是 , 对比以上情况可知,加入的酸的不同,发生的反应不同.