湖北省武汉市部分重点中学2023-2024学年高二上学期期中联考化学试题
试卷更新日期:2023-12-20 类型:期中考试
一、选择题:本题共15小题,每小题3分,共45分。在每小题给出的四个选项中,只有一项符合题目要求。
-
1. 化学与生活关系密切,下列说法错误的是( )A、在NO2和N2O4的平衡体系中,加压后颜色变深,可用勒夏特列原理解释 B、将SOCl2与AlCl3·H2O混合并加热,可得到无水氯化铝 C、打开剧烈摇动后的碳酸饮料产生大量气泡的原因是压强对化学平衡的影响 D、NH4F水溶液中含有HF,因此NH4F溶液不能存放于玻璃试剂瓶中2. 已知过氧化氢分解生成氢气和氧气是放热反应。科研人员采用新型复合光催化剂,利用太阳光高效分解水的过程如下图所示,下列说法正确的是( )
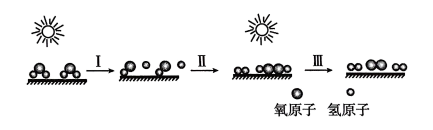 A、化学反应过程中催化剂并没有参加化学反应,但能大幅度提高反应速率 B、过程I的发生需要放出热量 C、过程Ⅲ中断裂旧键吸收的能量小于形成新键放出的能量 D、该过程涉及到极性键和非极性键的断裂和形成3. 下列有关说法中正确的是( )A、2CaCO3(s)+2SO2(g)+O2(g)=2CaSO4(s)+2CO2(g)在低温下能自发进行,则该反应的△H<0 B、NH4Cl(s)=NH3(g)+HCl(g)室温下不能自发进行,说明该反应的△H<0 C、稀溶液中,H+(aq)+OH-(aq)=H2O(l) △H=-57.3kJ·mol-1则稀醋酸与稀NaOH溶液反应生成1mol水,放出57.3kJ热量 D、在合成氨工业中N2的量越多,H2的转化率越大,因此充入的N2越多越有利于NH3的合成4. T℃时在2L密闭容器中使X(g)与Y(g)发生反应生成Z(g)。反应过程中X、Y、Z的物质的量变化如图1所示;若保持其他条件不变,温度分别为T1和T2时,Y的体积分数与时间的关系如图2所示。则下列结论错误的是( )
A、化学反应过程中催化剂并没有参加化学反应,但能大幅度提高反应速率 B、过程I的发生需要放出热量 C、过程Ⅲ中断裂旧键吸收的能量小于形成新键放出的能量 D、该过程涉及到极性键和非极性键的断裂和形成3. 下列有关说法中正确的是( )A、2CaCO3(s)+2SO2(g)+O2(g)=2CaSO4(s)+2CO2(g)在低温下能自发进行,则该反应的△H<0 B、NH4Cl(s)=NH3(g)+HCl(g)室温下不能自发进行,说明该反应的△H<0 C、稀溶液中,H+(aq)+OH-(aq)=H2O(l) △H=-57.3kJ·mol-1则稀醋酸与稀NaOH溶液反应生成1mol水,放出57.3kJ热量 D、在合成氨工业中N2的量越多,H2的转化率越大,因此充入的N2越多越有利于NH3的合成4. T℃时在2L密闭容器中使X(g)与Y(g)发生反应生成Z(g)。反应过程中X、Y、Z的物质的量变化如图1所示;若保持其他条件不变,温度分别为T1和T2时,Y的体积分数与时间的关系如图2所示。则下列结论错误的是( ) A、反应进行的前3min内,用X表示的反应速率v(X)=0.1mol/(L·min) B、容器中发生的反应可表示为3X(g)+Y(g)2Z(g) C、保持其他条件不变,升高温度,反应的化学平衡常数K增大 D、若改变反应条件,使反应进程如图3所示,则改变的条件可能是升高温度5. 催化剂I和II均能催化反应R(g)P(g)。反应历程(如图)中,M为中间产物。其它条件相同时,下列说法错误的是( )
A、反应进行的前3min内,用X表示的反应速率v(X)=0.1mol/(L·min) B、容器中发生的反应可表示为3X(g)+Y(g)2Z(g) C、保持其他条件不变,升高温度,反应的化学平衡常数K增大 D、若改变反应条件,使反应进程如图3所示,则改变的条件可能是升高温度5. 催化剂I和II均能催化反应R(g)P(g)。反应历程(如图)中,M为中间产物。其它条件相同时,下列说法错误的是( ) A、使用I和II,均有4个基元反应 B、使用催化剂I时,第三个基元反应是决速反应 C、使用II时,反应体系更快达到平衡 D、使用I时,反应过程中M所能达到的最高浓度更大6. 已知CO(g)+H2O(g)=CO2(g)+H2(g) △H=-41kJ·mol-1 , 下列叙述正确的是( )A、恒温恒压条件下加入惰性气体,活化分子数不变,反应速率不变 B、恒温、恒容条件下,加入水蒸气,活化分子百分数增大,反应速率加快 C、升高温度,活化分子百分数增大,有效碰撞频率增大,反应速率加快 D、加入合适的催化剂,可降低反应的活化能和焓变,活化分子百分数增大,反应速率加快7. 顺-1,2-二甲基环丙烷和反-1,2-二甲基环丙烷可发生如图转化:
A、使用I和II,均有4个基元反应 B、使用催化剂I时,第三个基元反应是决速反应 C、使用II时,反应体系更快达到平衡 D、使用I时,反应过程中M所能达到的最高浓度更大6. 已知CO(g)+H2O(g)=CO2(g)+H2(g) △H=-41kJ·mol-1 , 下列叙述正确的是( )A、恒温恒压条件下加入惰性气体,活化分子数不变,反应速率不变 B、恒温、恒容条件下,加入水蒸气,活化分子百分数增大,反应速率加快 C、升高温度,活化分子百分数增大,有效碰撞频率增大,反应速率加快 D、加入合适的催化剂,可降低反应的活化能和焓变,活化分子百分数增大,反应速率加快7. 顺-1,2-二甲基环丙烷和反-1,2-二甲基环丙烷可发生如图转化: 。该反应的速率方程可表示为:v(正)=k(正)·c(顺)和v(逆)=k(逆)·c(反);k(正)和k(逆)分别称作正、逆反应速率常数,它们受温度和催化剂影响。下列说法正确的是( ) A、某温度时,该反应的平衡常数可表示为 B、正、逆反应速率常数改变,平衡常数也一定会随之改变 C、若升高温度,平衡逆向移动,则说明正反应的活化能高于逆反应的活化能 D、催化剂改变反应速率但不影响平衡,说明催化剂同等程度改变k(正)和k(逆)8. 科学探究是化学学科核心素养之一,下列实验方案设计中,能达到实验目的的是( )
。该反应的速率方程可表示为:v(正)=k(正)·c(顺)和v(逆)=k(逆)·c(反);k(正)和k(逆)分别称作正、逆反应速率常数,它们受温度和催化剂影响。下列说法正确的是( ) A、某温度时,该反应的平衡常数可表示为 B、正、逆反应速率常数改变,平衡常数也一定会随之改变 C、若升高温度,平衡逆向移动,则说明正反应的活化能高于逆反应的活化能 D、催化剂改变反应速率但不影响平衡,说明催化剂同等程度改变k(正)和k(逆)8. 科学探究是化学学科核心素养之一,下列实验方案设计中,能达到实验目的的是( )选项
实验目的
实验方案
A
证明浓度对平衡FeCl3+3KSCNFe(SCN)3+3KCl的影响
向FeCl3和KSCN的混合溶液中,加入少量的KCl固体
B
氯气与水的反应存在限度
取两份新制氯水,分别滴加AgNO3溶液和KI溶液
C
KI3溶液中存在平衡:I2+I-
向盛有KI3溶液(显黄色)的①、②两支试管中分别滴加淀粉溶液、AgNO3溶液
D
证明HClO的酸性比CH3COOH弱
室温下,用pH试纸分别测定0.1mol·L-1的NaClO溶液和0.1mol·L-1的CH3COONa溶液的pH
A、A B、B C、C D、D9. 用CO合成甲醇(CH3OH)的化学方程式为CO(g)+2H2(g)CH3OH(g)△H<0,初始投料相同时,测得CO在不同温度下的平衡转化率与压强的关系如图。下列说法正确的是( ) A、平均摩尔质量:M(a)>M(b)>M(d)>M(c) B、正反应速率:v(a)>v(c)、v(b)>v(d) C、温度:T1>T2>T3 D、平衡常数:K(a)>K(c)、K(b)>K(d)10. 部分弱电解质的电离平衡常数如表所示。下列说法正确的是( )
A、平均摩尔质量:M(a)>M(b)>M(d)>M(c) B、正反应速率:v(a)>v(c)、v(b)>v(d) C、温度:T1>T2>T3 D、平衡常数:K(a)>K(c)、K(b)>K(d)10. 部分弱电解质的电离平衡常数如表所示。下列说法正确的是( )弱电解质
HCN
H2S
H2CO3
HClO
CH3COOH
电离平衡常数(25℃)
6.2×10-10
K1=1.1×10-7
K2=1.3×10-13
K1=4.5×10-7
K2=4.7×10-11
4.0×10-8
1.75×10-5
A、甲基橙变色范围为3.1~4.4,少量甲基橙滴入0.10mol·L-1的H2S溶液中,溶液呈红色 B、向Na2CO3溶液中滴加少量氯水:+2Cl2+H2O=2Cl-+2HClO+CO2↑ C、25℃时,物质的量浓度均为0.10mol·L-1的HCN溶液与NaCN溶液等体积混合,混合后溶液pH>7 D、相同pH的CH3COONa和NaClO溶液中,阴离子总数较大的是NaClO溶液11. 25℃时,向20mL浓度均为0.1mol·L-1的盐酸和醋酸混合溶液中逐滴加入0.1mol·L-1的NaOH溶液(醋酸的Ka=1.8×10-5);若用0.1mol·L-1的NaOH溶液滴定20mL等浓度的盐酸,滴定终点pH的突跃范围4.3~9.7。下列说法错误的是( )A、恰好中和时,溶液呈碱性 B、当c(Na+)=c(Cl-)时,溶液的pH<7 C、滴定过程中,c(Cl-)=c(CH3COO-)+c(CH3COOH) D、滴加NaOH溶液至pH=4.3的过程中,发生反应的离子方程式只有H++OH-=H2O12. 探究物质在水中的行为有重要意义。25℃时,下列说法错误的是( )①将pH=10的NaOH溶液与pH=12的NaOH溶液等体积混合后的pH接近于11.7(已知lg2=0.3);
②pH=4的盐酸与pH=4的醋酸溶液等体积混合后pH=4;
③向pH=m的盐酸中加入pH=n的氢氧化钠溶液,恰好完全反应时,测得盐酸与氢氧化钠溶液的体积比为10:1,则m+n=13;
④若NaHA的溶液呈酸性,可以推测H2A为强酸;
⑤pH=7.0的NaClO和HCO(Ka=4.0×10-8)的混合溶液中,c(HClO)>c(ClO-)=(Na+);
⑥pH=9的CH3COONa溶液与pH=9的NaOH溶液,水的电离程度相同;
⑦等物质的量浓度的四种溶液a.NH3·H2O、b.NH4HSO4、c.(NH4)2CO3、d.NH4Cl,其中c(NH)的关系为b>c>d>a
A、③④⑥⑦ B、①④⑤⑥ C、①③⑤⑦ D、②③⑤⑥13. 常温下,将0.01molH2S气体通入到100mL0.1mol·L-1NaOH溶液中,反应后溶液的pH=10。将反应后的混合液放置一段时间后,溶液的pH>10。忽略反应后溶液体积的变化,设NA为阿伏加德罗常数的值。下列说法错误的是( )A、常温下,HS-的电离常数小于其水解常数 B、放置前的混合溶液中由水电离产生的H+的数目为10-11NA C、放置后溶液中可能发生反应:2HS-+O2=2S↓+2OH- D、反应后pH=10的溶液中:c(S2-)+c(HS-)+c(H2S)=0.1mol·L-114. 如图,I是恒压密闭容器,II是恒容密闭容器。其它条件相同时,在I、II中分别加入2molX和2molY,起始时容器体积均为VL,发生如下反应并达到平衡:2X(?)+Y(?)aZ(g)(X、Y状态未知)。此时I中X、Y、Z的物质的量之比为1:3:2,则下列说法一定正确的是( ) A、若X、Y均为气态,则平衡时的压强:II>I B、若X为固态,Y为气态,则I、II中从起始到平衡所需时间相同 C、若X、Y不均为气态,则平衡时气体平均摩尔质量:I>II D、平衡时I容器的体积小于VL15. 知:CH4(g)+2H2S(g)⇌CS2(g)+4H2(g)。向恒容密闭容器中充入0.1molCH4和0.2molH2S,测得平衡时体系中各物质的物质的量分数与温度的关系如图所示。
A、若X、Y均为气态,则平衡时的压强:II>I B、若X为固态,Y为气态,则I、II中从起始到平衡所需时间相同 C、若X、Y不均为气态,则平衡时气体平均摩尔质量:I>II D、平衡时I容器的体积小于VL15. 知:CH4(g)+2H2S(g)⇌CS2(g)+4H2(g)。向恒容密闭容器中充入0.1molCH4和0.2molH2S,测得平衡时体系中各物质的物质的量分数与温度的关系如图所示。
下列说法不正确的是( )
A、该反应的ΔH>0 B、X点CH4的转化率为20% C、X点与Y点容器内压强比 51∶55
D、维持Z点温度,向容器中再充入CH4、H2S、CS2、H2各0.1mol时v(正)<v(逆)
51∶55
D、维持Z点温度,向容器中再充入CH4、H2S、CS2、H2各0.1mol时v(正)<v(逆)
二、非选择题:本题共4小题,共55分。
-
16. 回答以下问题。(1)、Sb2O3可用作白色颜料和阻燃剂等。在实验室中可利用SbCl3的水解反应制取Sb2O3(SbCl3的水解分三步进行,中间产物有SbOCl等),写出SbCl3水解生成SbOCl的水解反应方程式;SbCl3水解的总反应可表示为:2SbCl3+3H2OSb2O3+6HCl为了得到较多的Sb2O3 , 操作时要将SbCl3缓慢加入大量水中的原因是。(2)、次磷酸(H3PO2)是一种弱酸,将等体积、等物质的量浓度的H3PO2溶液和NaOH溶液混合,所得溶液中阴离子只有、OH-两种。写出H3PO2溶液与NaOH溶液恰好完全反应的溶液中各离子浓度由大到小的顺序为。(3)、已知Cr(OH)3与NaOH溶液反应生成Na[Cr(OH)4],与稀硫酸反应生成Cr2(SO4)3 , 写出Cr(OH)3在水中的电离方程式、。(4)、一定温度下,用水吸收SO2气体时,溶液中水的电离平衡移动(填“向左”“向右”或“不”);若得到pH=4的H2SO3溶液,试计算溶液中c():c(H2SO3)=(已知该温度下,H2SO3的电离常数:Ka1=4.5×10-2 , Ka2=2.5×10-7)。(5)、某温度下,pH=3的盐酸中c(OH-)=1×10-9mol·L-1;该温度下pH=2的H2SO4溶液与pH=11的NaOH溶液混合后溶液的pH=9,则H2SO4与NaOH溶液的体积比为。17. 化学反应常伴随热效应。某些反应(如中和反应)的热量变化,其数值Q可通过测量反应前后体系温度变化计算测得。(1)、盐酸浓度的测定:移取20.00mL待测液,向其中滴加两滴酚酞溶液,用0.5000mol·L-1的NaOH溶液滴定至终点,消耗NaOH溶液22.00mL。
①上述滴定操作用到的仪器有(填标号,下同)。

②该盐酸浓度为mol·L-1。
③该实验到达滴定终点时的现象是。
④下列关于滴定的操作及分析,正确的是。
A.碱式滴定管量取NaOH溶液时,未进行润洗,测量结果将偏高
B.滴定时应一直观察滴定管中溶液体积的变化
C.终点读数时如果俯视测量结果将偏高
D.平行滴定时,须重新装液并调节液面至“0”刻度
(2)、热量 测定:取上述NaOH溶液和盐酸各50mL进行反应,测得反应前后体系的温度值(℃)分别为T0、T1 , 则该过程放出的热量为J(为了计算方便,可近似认为实验所用的稀溶液的密度为1.0g·mL-1 , 比热容为4.18J·g-1·℃-1 , 忽略水以外各物质吸收的热量,下同)。 (3)、借鉴(2)的方法,甲同学测量放热反应Fe(s)+CuSO4(aq)=FeSO(aq)+Cu(s)的焓变△H(忽略温度对焓变的影响)。实验结果见下表。
测定:取上述NaOH溶液和盐酸各50mL进行反应,测得反应前后体系的温度值(℃)分别为T0、T1 , 则该过程放出的热量为J(为了计算方便,可近似认为实验所用的稀溶液的密度为1.0g·mL-1 , 比热容为4.18J·g-1·℃-1 , 忽略水以外各物质吸收的热量,下同)。 (3)、借鉴(2)的方法,甲同学测量放热反应Fe(s)+CuSO4(aq)=FeSO(aq)+Cu(s)的焓变△H(忽略温度对焓变的影响)。实验结果见下表。序号
反应试剂
体系温度/℃
反应前
反应后
i
0.2mol·L-1CuSO4溶液100mL
1.20g铁粉
a
b
ii
0.56g铁粉
a
c
①温度:bc(填“>”“<”或“=”)。
②△H=kJ·mol-1(选择表中一组数据计算)。
18. 合成氨工业和硫酸工业在国民经济中占有重要地位。(1)、在合成氨工业中,原料气(N2、H2及少量CO、NH3的混合气)在进入合成塔前需经过铜氨液处理,目的是除去其中的CO其反应为:[Cu(NH3)2]++CO+NH3[Cu(NH3)3CO]+ △H<0。吸收CO后的铜氨液经过适当处理可再生,恢复其吸收CO的能力,可循环使用。铜氨液再生适宜的生产条件是。(2)、将等物质的量的H2和N2通入绝热恒容密闭容器中发生反应N2(g)+3H2(g)2NH3(g) △H<0,下列选项表明反应一定已达平衡状态的是____(填标号,下同)。A、容器内的压强不再变化 B、相同时间内,断开H-H键的数目和生成N-H键的数目相等 C、容器内气体的浓度c(N2):c(H2):c(NH3)=1:3:2 D、N2的体积分数不再发生变化(3)、接触法制硫酸的关键反应为SO2的催化氧化,二氧化硫在V2O5作用下的催化氧化是工业上生产硫酸的主要反应。SO2的催化氧化热化学方程式为:2SO2(g)+O2(g)2SO3(g) △H=akJ·mol-1其催化机理分为三步:第1步:SO2(g)+V2O5(s)SO3(g)+V2O4(s) △H=bkJ·mol-1
第2步:V2O4(s)+O2(g)+2SO2(g)2VOSO4(s) △H=ckJ·mol-1
第3步:_______。
第3步热化学方程式(△H的值用a、b、c的代数式表示)。(4)、T℃时,将3molSO2和1molO2通入体积为2L的恒温恒容密闭容器中,发生反应。3min时反应达到平衡,此时测得O2还剩余0.1mol。则达平衡时SO2的转化率为;从反应开始至达到平衡,用SO3表示反应速率为。(5)、为寻求固定投料比下不同反应阶段的最佳生产温度,绘制相应转化率(α)下反应速率(数值已略去)与温度的关系如下图所示,下列说法正确的是____。 A、温度越高,反应速率越大 B、可根据不同α下的最大速率,选择最佳生产温度 C、α=0.88的曲线代表平衡转化率 D、α越大,反应速率最大值对应温度越低(6)、为提高钒催化剂的综合性能,我国科学家对其进行了改良。不同催化剂下,温度和转化率关系如图所示,催化性能最佳的是(填标号)。
A、温度越高,反应速率越大 B、可根据不同α下的最大速率,选择最佳生产温度 C、α=0.88的曲线代表平衡转化率 D、α越大,反应速率最大值对应温度越低(6)、为提高钒催化剂的综合性能,我国科学家对其进行了改良。不同催化剂下,温度和转化率关系如图所示,催化性能最佳的是(填标号)。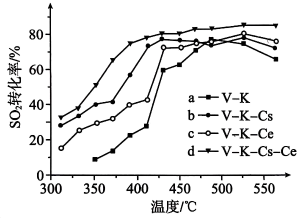 (7)、设O2的平衡分压为p,SO2的平衡转化率为α,用含p和α的代数式表示上述催化氧化反应的Kp=(用平衡分压代替平衡浓度计算)。19. 二氧化碳加氢制甲烷和甲烷重整对碳资源利用具有重要的战略意义。回答下列问题:(1)、I.CO2加氢选择合成甲烷的主要反应如下:
(7)、设O2的平衡分压为p,SO2的平衡转化率为α,用含p和α的代数式表示上述催化氧化反应的Kp=(用平衡分压代替平衡浓度计算)。19. 二氧化碳加氢制甲烷和甲烷重整对碳资源利用具有重要的战略意义。回答下列问题:(1)、I.CO2加氢选择合成甲烷的主要反应如下:①CO2(g)+4H2CH4(g)+2H2O(g) △H1(298K)
②CO2(g)+H2(g)CO(g)+H2O(g) △H2(298K)
③2CO(g)+2H2(g)CO2(g)+CH4(g) △H3(298K)
在一定温度下,由最稳定单质生成1mol某物质的焓变叫做该物质的标准摩尔生成焓,如表为298K时几种物质的标准摩尔生成焓。
有利于反应①自发进行的条件是(填“高温”或“低温”);根据表中数据计算反应②的焓变△H2(298K)=kJ·mol-1。物质
H2(g)
O2(g)
CO(g)
CO2(g)
H2O(g)
CH4(g)
标准摩尔生成焓(kJ·mol-1)
0
0
-110.5
-393.5
-241.8
-74.81
(2)、在一定条件下,向体积为VL的恒容密闭容器中通入1molCO2和4molH2发生上述反应,反应20min容器内反应达到平衡时,容器中CH4为amol,CO为bmol,以H2表示的0~20min内平均反应速率v(H2)=mol·L-1·min-1(用含a、b、V的代数式表示,下同),此时H2O(g)的浓度为mol·L-1 , 反应II的平衡常数为(列出计算式)。(3)、甲烷三重整制氢的逆反应CO(g)+3H2CH4(g)+H2O(g)。合成总反应在起始物=3时,在不同条件下达到平衡,设体系中CH4的物质的量分数为x(CH4),在t=250℃下的x(CH4)-p、在p=5×105Pa下的x(CH4)-t如图所示。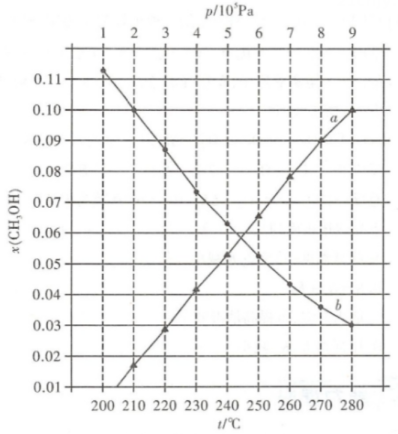
①当CO的平衡转化率为时,反应条件可能是。
②甲烷三重整制氢工业一般将反应温度设置为750℃~920℃,将反应压力设置为2~3MPa并向转化炉内通入空气或氧气,通入空气或氧气的目的是。