贵州省仁怀市2023-2024学年高二上学期化学期中考试试卷
试卷更新日期:2023-12-16 类型:期中考试
一、单选题(本题共14小题,每小题3分,共42分。在每小题给出的四个选项中,只有一项是符合题目要求的。)
-
1. 中华传统文化蕴含着丰富的化学知识,下列蕴含的化学知识分析不正确的是( )A、“沧海月明珠有泪,蓝田日暖玉生烟”,“珠”字对应的化学物质碳酸钙属于强电解质 B、“粉身碎骨浑不怕,要留清白在人间”,大理石变为生石灰的过程是吸热反应 C、“煮豆燃豆萁,豆在釜中泣”,这里的能量变化主要是化学能转化为热能 D、“投泥泼水愈光明,烁玉流金见精悍”,所指高温时碳与水蒸气反应为放热反应2. 下列措施不是为了改变化学反应速率的是( )A、加工馒头时添加膨松剂 B、将食物存放在冰箱中 C、糕点包装袋内放置除氧剂 D、冶铁时将铁矿石粉碎3. “蓝天保卫战”需要持续进行大气治理,有效处理SO2、NO2等大气污染物。化学研究为生产、生活处理废气,防止大气污染做出重要贡献。已知反应: , 下列说法正确的是( )A、增大压强有利于反应自发进行 B、该反应不能完全消除废气 C、降低反应温度可提高去除效率 D、升高反应温度可提高废气转化率4. 如图所示是298K时,A2与B2反应过程中能量变化的曲线图,下列叙述正确的是( )
 A、催化剂不参与化学反应,故反应前后的质量和性质不变 B、该反应的热化学方程式为A2(g)+B2(g)=2AB(g)△H=+(a-b)kJ•mol-1 C、每生成2molAB吸收bkJ热量 D、断裂1molA—A和1molB—B键,放出akJ能量5. 下列离子方程式书写正确的是( )A、用FeCl3溶液刻蚀铜电路板: B、氢氧化铁与盐酸反应:H++OH−=H2O C、FeSO4酸性溶液中加H2O2溶液:2Fe2++H2O2+2H+=2Fe3++2H2O D、氯化铝溶液中滴加过量氨水:Al3++3OH-- = Al(OH)3↓6. 下列说法正确的是( )A、C(s,金刚石)=C(s,石墨) , 则金刚石比石墨稳定 B、乙醇的燃烧热为 , 则乙醇燃烧的热化学方程式可表示为: C、 , ;则小于 D、在一定条件下将1molSO2和0.5molO2置于密闭容器中充分反应,放出热量79.2kJ,则反应的热化学方程式为7. 下列关于有效碰撞理论与影响速率因素之间关系正确的是( )A、增大反应物浓度,可以提高活化分子百分数,从而提高反应速率 B、对于气体反应来说,通过压缩体积增大压强,可以提高单位体积内活化分子数,从而提高反应速率 C、温度升高,反应所需活化能减少,反应速率增大 D、选用适当的催化剂,分子运动加快,增加了碰撞频率,故反应速率增大8. 用尿素水解生成的催化还原 , 是柴油机车辆尾气净化的主要方法。反应为 , 达到平衡后,再通入一定量 , 达到新平衡时,下列说法不正确的是( )A、N2的平衡浓度增大 B、NO的转化率增大 C、正向反应速率增大 D、反应平衡常数增大9. 恒温恒容的密闭容器中,在某催化剂表面上发生氨的分解反应:。下列能说明该反应达到平衡状态的是( )A、反应停止,反应速率为零 B、各组分的浓度保持不变 C、N2和H2的体积比保持不变 D、每生成3mol H2消耗2mol NH310. 下列反应方程式属于盐类的水解反应且书写正确的是( )A、Mg2++2H2OMg(OH)2+2H+ B、HS-+H2OH3O++S2- C、Na2O+H2O2Na++2OH- D、CO+2H2OH2CO3+2OH-11. 室温下,向10 mL pH=3的溶液中加入10 mL pH=11的NaOH溶液,所得溶液中与的大小关系是( )A、 B、 C、 D、无法判断12. 根据元素周期律,由下列事实进行归纳推测,推测不合理的是( )
A、催化剂不参与化学反应,故反应前后的质量和性质不变 B、该反应的热化学方程式为A2(g)+B2(g)=2AB(g)△H=+(a-b)kJ•mol-1 C、每生成2molAB吸收bkJ热量 D、断裂1molA—A和1molB—B键,放出akJ能量5. 下列离子方程式书写正确的是( )A、用FeCl3溶液刻蚀铜电路板: B、氢氧化铁与盐酸反应:H++OH−=H2O C、FeSO4酸性溶液中加H2O2溶液:2Fe2++H2O2+2H+=2Fe3++2H2O D、氯化铝溶液中滴加过量氨水:Al3++3OH-- = Al(OH)3↓6. 下列说法正确的是( )A、C(s,金刚石)=C(s,石墨) , 则金刚石比石墨稳定 B、乙醇的燃烧热为 , 则乙醇燃烧的热化学方程式可表示为: C、 , ;则小于 D、在一定条件下将1molSO2和0.5molO2置于密闭容器中充分反应,放出热量79.2kJ,则反应的热化学方程式为7. 下列关于有效碰撞理论与影响速率因素之间关系正确的是( )A、增大反应物浓度,可以提高活化分子百分数,从而提高反应速率 B、对于气体反应来说,通过压缩体积增大压强,可以提高单位体积内活化分子数,从而提高反应速率 C、温度升高,反应所需活化能减少,反应速率增大 D、选用适当的催化剂,分子运动加快,增加了碰撞频率,故反应速率增大8. 用尿素水解生成的催化还原 , 是柴油机车辆尾气净化的主要方法。反应为 , 达到平衡后,再通入一定量 , 达到新平衡时,下列说法不正确的是( )A、N2的平衡浓度增大 B、NO的转化率增大 C、正向反应速率增大 D、反应平衡常数增大9. 恒温恒容的密闭容器中,在某催化剂表面上发生氨的分解反应:。下列能说明该反应达到平衡状态的是( )A、反应停止,反应速率为零 B、各组分的浓度保持不变 C、N2和H2的体积比保持不变 D、每生成3mol H2消耗2mol NH310. 下列反应方程式属于盐类的水解反应且书写正确的是( )A、Mg2++2H2OMg(OH)2+2H+ B、HS-+H2OH3O++S2- C、Na2O+H2O2Na++2OH- D、CO+2H2OH2CO3+2OH-11. 室温下,向10 mL pH=3的溶液中加入10 mL pH=11的NaOH溶液,所得溶液中与的大小关系是( )A、 B、 C、 D、无法判断12. 根据元素周期律,由下列事实进行归纳推测,推测不合理的是( )事实
推测
A
可以和NaBr溶液反应生成
可以和NaCl溶液反应生成
B
Si与高温时反应,S与加热能反应
P与在高温时能反应
C
与水反应缓慢,与水反应较快
(ⅡA族)与水反应会更快
D
HCl在时分解,HI在时分解
HBr的分解温度介于二者之间
A、A B、B C、C D、D13. 反应mX(g)nY(g)+pZ(g) ΔH,在不同温度下的平衡体系中物质Y的体积分数随压强变化的曲线如图所示。下列说法错误的是( ) A、该反应的ΔH>0 B、m<n+p C、C两点化学平衡常数:KB>KC D、A、C两点的反应速率v(A)<v(C)14. 《本草纲目》中记载:“火药乃焰消(KNO3)、硫磺、杉木炭所合,以为烽燧铳机诸药者。”黑火药爆炸时反应的化学方程式为2KNO3+S+3CK2S+N2↑+3CO2↑。下列说法正确的是( )A、黑火药属于纯净物 B、生成2.24LCO2时被氧化的碳元素的质量为1.2g C、该反应中只有硫元素被还原 D、生成5.6g氮气时转移电子的物质的量为2.4mol
A、该反应的ΔH>0 B、m<n+p C、C两点化学平衡常数:KB>KC D、A、C两点的反应速率v(A)<v(C)14. 《本草纲目》中记载:“火药乃焰消(KNO3)、硫磺、杉木炭所合,以为烽燧铳机诸药者。”黑火药爆炸时反应的化学方程式为2KNO3+S+3CK2S+N2↑+3CO2↑。下列说法正确的是( )A、黑火药属于纯净物 B、生成2.24LCO2时被氧化的碳元素的质量为1.2g C、该反应中只有硫元素被还原 D、生成5.6g氮气时转移电子的物质的量为2.4mol二、非选择题(本题共4小题,除特殊标注外,每空2分,共58分)
-
15. 某同学欲测定市售小苏打中(含少量)的的质量分数,用的标准溶液滴定,甲基橙作指示剂。回答下列问题:(1)、配制待测溶液:准确称取样品于烧杯中,用蒸馏水溶解,冷却至室温后,转移至中,洗涤烧杯和玻璃棒2-3次,一并转移至容器中,定容。(2)、若定容时俯视刻度线,则所配溶液浓度(填偏大、偏小或不变);若定容时视线与凹液面最低处相平,塞好瓶塞,倒转均匀后,发现液面有所下降,此时不再定容至刻度线,则所配溶液的浓度(填偏大、偏小或不变)。(3)、用量取样品溶液至锥形瓶中,加入2滴甲基橙,用的标准溶液滴定,终点现象为。(4)、若滴定开始和结束时,酸式滴定管的液面如图所示,所用溶液的体积为mL。
 (5)、下列操作中可能使所测样品的质量分数偏高的是( )(填字母)。A、酸式滴定管未用待测液润洗就直接注入溶液 B、读取硫酸体积时,开始仰视读数,滴定结束时俯视读数 C、酸式滴定管在滴定前有气泡,滴定后气泡消失 D、锥形瓶用蒸馏水洗涤后,留有少量水(6)、某同学4次实验有关数据如下表:则样品中的质量分数为(保留四位有效数字)。
(5)、下列操作中可能使所测样品的质量分数偏高的是( )(填字母)。A、酸式滴定管未用待测液润洗就直接注入溶液 B、读取硫酸体积时,开始仰视读数,滴定结束时俯视读数 C、酸式滴定管在滴定前有气泡,滴定后气泡消失 D、锥形瓶用蒸馏水洗涤后,留有少量水(6)、某同学4次实验有关数据如下表:则样品中的质量分数为(保留四位有效数字)。实验序号
待测液体积/mL
标准溶液的体积/mL
滴定前刻度
滴定后刻度
1
20.00
0.00
23.13
2
20.00
1.68
26.18
3
20.00
0.22
23.31
4
20.00
0.70
23.78
16.(1)、汽车尾气主要含有一氧化碳、二氧化硫、一氧化氮等物质,是造成城市空气污染的主要因素之一、已知汽缸中氮气和氧气反应生成一氧化氮的能量变化值如图所示,则由该反应生成2molNO时,应(填“释放”或“吸收”) kJ能量。 (2)、用氮化硅()陶瓷代替金属制造发动机的耐热部件,能大幅度提高发动机的热效率。工业上用化学气相沉积法制备氮化硅,其反应如下:。
(2)、用氮化硅()陶瓷代替金属制造发动机的耐热部件,能大幅度提高发动机的热效率。工业上用化学气相沉积法制备氮化硅,其反应如下:。①写出的电子式:。
②在一定温度下进行上述反应,若反应容器的容积为2L,3min后达到平衡,测得固体的质量增加了2.80g,则H2的平均反应速率 。
③写出该反应的平衡常数表达式:K=
④一定条件下,在密闭恒容的容器中,能表示上述反应达到化学平衡状态的是。
A.
B. 容器内压强保持不变
C. 混合气体密度保持不变
D.
(3)、CO2/ HCOOH循环在氢能的贮存/释放、燃料电池等方面具有重要应用。 研究 HCOOH燃料电池性能的装置如图所示,两电极区间用允许K+、H+通过的半透膜隔开。
放电过程中需补充的物质A为(填化学式)。
17. 25℃时,常见的弱电解质电离平衡常数如下:化学式
电离平衡常数K
(1)、写出碳酸在水中的第一步电离方程式。(2)、25℃时,浓度均为的四种溶液:① ② ③NaCN ④ , 溶液pH从小到大排序(用序号排序)。(3)、25℃时,向溶液中加入一定量的 , 所得混合液 , 则混合液中。(4)、足量的溶液与稀充分反应,写出最可能发生反应的离子方程式:。(5)、向中加少量水稀释,下列关系式变小的是____。A、 B、 C、 D、(6)、向和混合溶液中加固体,恢复到室温后溶液均为中性,且溶液体积仍为 , 则(填>、<、=)(7)、气体与溶液充分反应得到溶液A,溶液A的pH7(填>、<、=)。18. 科学家利用CO2和H2合成CH3OH有利于实现碳中和。主要反应有:I.CO2(g)+3H2(g)CH3OH(g)+H2O(g),ΔH1=-49.4kJ·mol-1
II.CO2(g)+H2(g)CO(g)+H2O(g),ΔH2
III.CO(g)+2H2(g)CH3OH(g),ΔH3=-90.6kJ·mol-1
回答下列问题:
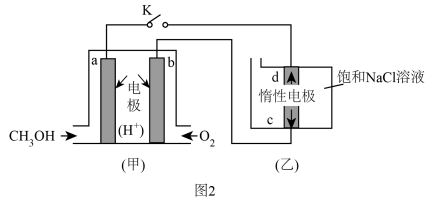
(1)、ΔH2=kJ·mol-1 , 反应III在(填“高温”或“低温”)易自发进行。(2)、若将反应I看成由反应II和反应III两步进行,反应II为慢反应,画出由反应原料经两步生成产物的反应过程能量示意图。 (3)、一定条件下,在体积为1L的密闭容器中发生反应I,起始物n(H2)/n(CO2)=3,CO2(g)和CH3OH(g)的浓度随时间变化如图1所示,3min内用H2浓度变化表示的反应速率mol·L-1·min-1。若平衡时压强为P0 , 该反应条件的平衡常数Kp=(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
(3)、一定条件下,在体积为1L的密闭容器中发生反应I,起始物n(H2)/n(CO2)=3,CO2(g)和CH3OH(g)的浓度随时间变化如图1所示,3min内用H2浓度变化表示的反应速率mol·L-1·min-1。若平衡时压强为P0 , 该反应条件的平衡常数Kp=(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)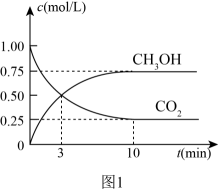 (4)、反应II中,为提高H2的转化率,可采取的措施有(任意答一条)。(5)、图2是以甲醇燃料电池为电源电解饱和食盐水,甲装置a电极反应式为。当甲装置中消耗11.2LO2(标准状况),理论上乙装置中通过导线的电子数目为。
(4)、反应II中,为提高H2的转化率,可采取的措施有(任意答一条)。(5)、图2是以甲醇燃料电池为电源电解饱和食盐水,甲装置a电极反应式为。当甲装置中消耗11.2LO2(标准状况),理论上乙装置中通过导线的电子数目为。