北京市朝阳区2023-2024学年高三上学期化学期中质量检测试卷
试卷更新日期:2023-12-14 类型:期中考试
一、本部分共14题,每题3分,共42分。在每题列出的四个选项中,选出最符合题目要求的一项。
-
1. 我国科学家首次合成大面积全碳纳米材料——石墨炔,其结构与石墨类似,可用于制备储锂电极材料。下列关于石墨炔的说法不正确的是( )
 A、与石墨互为同分异构体 B、碳原子有sp、sp2两种杂化方式 C、与石墨类似,层间存在范德华力 D、具有传导电子的性能2. 下列化学用语或图示表达不正确的是( )A、基态S原子的最外层电子轨道表示式:
A、与石墨互为同分异构体 B、碳原子有sp、sp2两种杂化方式 C、与石墨类似,层间存在范德华力 D、具有传导电子的性能2. 下列化学用语或图示表达不正确的是( )A、基态S原子的最外层电子轨道表示式: B、基态29Cu原子的电子排布式:
C、H2O的VSEPR模型:
B、基态29Cu原子的电子排布式:
C、H2O的VSEPR模型: D、Cl2分子中σ键的形成:
D、Cl2分子中σ键的形成: 3. 核污染水中含有38Sr、55Cs等多种放射性同位素粒子,会对人体和环境产生危害。下列说法不正确的是( )A、含有的中子比质子多27个 B、Sr位于元素周期表第五周期、第ⅡA族 C、可用沉淀法或离子交换法去除核污染水中的 D、借助元素周期表比较可知Sr的金属性比Cs强4. 下列应用中未涉及氧化还原反应的是( )A、将过氧化钠置于呼吸面具中供氧 B、将明矾置于浑浊的水中净水 C、将漂白粉置于水中漂白衣物 D、将覆铜板置于氯化铁溶液中制作电路板5. 金属钾可以与水(滴加酚酞溶液)剧烈反应,下列说法不正确的是( )
3. 核污染水中含有38Sr、55Cs等多种放射性同位素粒子,会对人体和环境产生危害。下列说法不正确的是( )A、含有的中子比质子多27个 B、Sr位于元素周期表第五周期、第ⅡA族 C、可用沉淀法或离子交换法去除核污染水中的 D、借助元素周期表比较可知Sr的金属性比Cs强4. 下列应用中未涉及氧化还原反应的是( )A、将过氧化钠置于呼吸面具中供氧 B、将明矾置于浑浊的水中净水 C、将漂白粉置于水中漂白衣物 D、将覆铜板置于氯化铁溶液中制作电路板5. 金属钾可以与水(滴加酚酞溶液)剧烈反应,下列说法不正确的是( ) A、溶液变红,证明生成了碱性物质 B、钾浮在液面上并燃烧,与其密度及反应的热效应有关 C、钾与水反应比钠与水反应更剧烈,说明钾的金属性比钠强 D、金属钾与水发生反应前后化学键类型不变6. 下列反应的方程式不正确的是( )A、C和浓H2SO4反应: B、NH3的催化氧化反应: C、向氢硫酸中通入SO2: D、向FeBr2溶液中通入足量Cl2:7. 下列事实与水解反应无关的是( )A、常温下相同浓度溶液的pH大小:Na2S(aq)>(NH4)2S(aq) B、纯碱溶液去除油污的能力强弱:热纯碱液>冷纯碱液 C、除去工业废水中的Hg2+:向废水中加入FeS固体 D、配制FeCl3溶液:将FeCl3固体溶于浓盐酸,再稀释至所需浓度8. 下列实验能达到实验目的的是( )
A、溶液变红,证明生成了碱性物质 B、钾浮在液面上并燃烧,与其密度及反应的热效应有关 C、钾与水反应比钠与水反应更剧烈,说明钾的金属性比钠强 D、金属钾与水发生反应前后化学键类型不变6. 下列反应的方程式不正确的是( )A、C和浓H2SO4反应: B、NH3的催化氧化反应: C、向氢硫酸中通入SO2: D、向FeBr2溶液中通入足量Cl2:7. 下列事实与水解反应无关的是( )A、常温下相同浓度溶液的pH大小:Na2S(aq)>(NH4)2S(aq) B、纯碱溶液去除油污的能力强弱:热纯碱液>冷纯碱液 C、除去工业废水中的Hg2+:向废水中加入FeS固体 D、配制FeCl3溶液:将FeCl3固体溶于浓盐酸,再稀释至所需浓度8. 下列实验能达到实验目的的是( )A
B
C
D
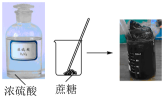

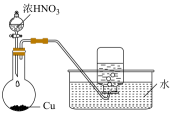
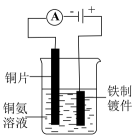
验证浓硫酸具有脱水性
配制100 mL一定物质的量浓度的溶液
制备并收集NO2
铁件镀铜
A、A B、B C、C D、D9. 根据下列实验操作和现象所得结论正确的是( )选项
实验操作
现象
结论
A
将 Cl₂通入品红溶液
溶液红色褪去
Cl₂具有漂白性
B
向某溶液中滴加几滴氯水,再滴加KSCN溶液
溶液变红
原溶液中有Fe2+
C
向Ca(ClO)2溶液中通入SO2气体
有沉淀生成
酸性:H2SO3>HClO
D
向Al(OH)3沉淀中分别滴加足量盐酸或NaOH溶液
沉淀均溶解
Al(OH)3是两性氢氧化物,Al 表现一定的非金属性
A、A B、B C、C D、D10. 一定温度下,在2L的恒容密闭容器中,“甲烷重整”反应()原理如下。
已知“甲烷重整”反应在不同温度下的化学平衡常数:
温度/℃
850
1000
1200
1400
K
0.5
2
275
1772
下列说法不正确的是( )
A、物质a可能是Fe3O4 B、若增大的值,则CH4的平衡转化率降低 C、 D、1000℃,若容器中、 , 则反应处于平衡状态11. 基于水煤气转化反应 , 通过电化学装置制备纯氢的原理示意如下。下列说法不正确的是( ) A、电解质溶液可以是KOH溶液 B、阴极电极反应为: C、使用阴离子交换膜能减缓单位时间内乙室中c(OH-)的降低 D、该装置中氧化反应和还原反应分别在两极进行,利于制得高纯度氢气12. 某小组同学进行如下实验探究沉淀转化:
A、电解质溶液可以是KOH溶液 B、阴极电极反应为: C、使用阴离子交换膜能减缓单位时间内乙室中c(OH-)的降低 D、该装置中氧化反应和还原反应分别在两极进行,利于制得高纯度氢气12. 某小组同学进行如下实验探究沉淀转化:①向20mL0.1mol·L-1Na2CO3溶液中滴加20mL0.1mol·L-1BaCl2溶液,得浊液Ⅰ;
②向浊液Ⅰ中继续滴加20mL0.1mol·L-1Na2SO4溶液,充分振荡,得浊液Ⅱ;
③将浊液Ⅱ过滤,向滤渣中加入过量盐酸产生气体,过滤、洗涤、干燥,测得剩余固体a的质量大于0.233g。
下列说法不正确的是( )
A、Na2CO3溶液显碱性的原因: B、固体a的成分为BaSO4 C、c(Ba2+)大小关系:浊液Ⅰ<浊液Ⅱ D、由该实验可以推断13. 分别向相同浓度的Na2CO3、NaHCO3溶液中逐滴加入盐酸,滴定过程中溶液的pH变化如下图,下列说法不正确的是( ) A、曲线①、②分别表示盐酸滴定Na2CO3、NaHCO3溶液的过程 B、a、b、c点水的电离程度:a>b>c C、a、b、d点均满足: D、ab段和de段发生的主要反应均为:14. 一定温度下,向含一定浓度金属离子M2+(M2+代表、和)的溶液中通H2S气体至饱和c(H2S)为时,相应的金属硫化物在溶液中达到沉淀溶解平衡时的与pH关系如下图。下列说法不正确的是( )
A、曲线①、②分别表示盐酸滴定Na2CO3、NaHCO3溶液的过程 B、a、b、c点水的电离程度:a>b>c C、a、b、d点均满足: D、ab段和de段发生的主要反应均为:14. 一定温度下,向含一定浓度金属离子M2+(M2+代表、和)的溶液中通H2S气体至饱和c(H2S)为时,相应的金属硫化物在溶液中达到沉淀溶解平衡时的与pH关系如下图。下列说法不正确的是( ) A、a点所示溶液中, B、该温度下, C、b点所示溶液中,可发生反应 D、Zn2+、Mn2+浓度均为的混合溶液,通入H2S并调控pH可实现分离
A、a点所示溶液中, B、该温度下, C、b点所示溶液中,可发生反应 D、Zn2+、Mn2+浓度均为的混合溶液,通入H2S并调控pH可实现分离二、本部分共5题,共58分。
-
15. 2023年杭州亚运会开幕式首次使用“零碳甲醇”作为主火炬塔燃料,实现废碳再生、循环内零碳排放。已知某些共价键的键能:
化学键
H-H
C-H
O-H
C-O
C=O
键能/(kJ·mol-1)
436
413
463
351
745
(1)、CO2的电子式为。(2)、CH3OH分子结构如图。
①CH3OH分子中O的杂化轨道类型。
②键长a、b、c从长到短的顺序为。
③乙醇
 沸点(78℃)高于甲醇(65℃)。解释原因:。(3)、在350℃、催化下用CO2制备CH3OH的反应原理如图。
沸点(78℃)高于甲醇(65℃)。解释原因:。(3)、在350℃、催化下用CO2制备CH3OH的反应原理如图。
①该条件下制备甲醇的化学方程式为:。
②下列说法正确的是 (填序号)。
A.电负性由大到小的顺序:O>C>H
B.步骤a涉及s-s σ键的断裂和s-sp3 σ键的形成
C.步骤d、e的反应热(ΔH)相等
D.升高温度可以提高反应速率和CH3OH的平衡产率
(4)、干冰(CO2)的晶胞结构如图所示,若该晶胞边长为apm,则干冰晶体的密度为。(已知:;表示阿伏加德罗常数) 16. 合成氨的发展体现了化学科学与技术的不断进步。(1)、1898年,化学家用氮气、碳化钙(CaC2)与水蒸气反应制备氨:
16. 合成氨的发展体现了化学科学与技术的不断进步。(1)、1898年,化学家用氮气、碳化钙(CaC2)与水蒸气反应制备氨:i.碳化钙和氮气在1000℃的高温下产生氰氨化钙(CaCN2);
ii.氰氨化钙与水蒸气反应生成氨气。
写出反应ii
 化学方程式:。(2)、20世纪初,以N2和H2为原料的工业合成氨方法研制成功。其反应为:。
化学方程式:。(2)、20世纪初,以N2和H2为原料的工业合成氨方法研制成功。其反应为:。①N2的化学性质稳定,即使在高温、高压下,N2和H2的化合反应仍然进行得十分缓慢。从分子结构角度解释原因:。
②压强对合成氨有较大影响。下图为不同压强下,以物质的量分数x(H2)=0.75、x(N2)=0.25进料(组成1),反应达平衡时,x(NH3)与温度的计算结果。

i.判断压强:p1p2(填“>”或“<”),简述理由:。
ii.在p1、x(NH3)=0.20时,氮气的转化率为。
iii.合成氨原料气中存在不参与反应的Ar时会影响NH3的平衡含量。在p1时,以物质的量分数x(H2)=0.675、x(N2)=0.225、x(Ar)=0.10进料(组成2),反应达平衡时x(NH3)与温度的计算结果与组成1相比有一定变化,在上图中用虚线画出相应曲线。
(3)、我国科学家研制出双催化剂,通过光辐射产生温差(如体系温度为495℃时,纳米Fe的温度为547℃,而的温度为415℃,解决了温度对合成氨工业反应速率和平衡转化率影响矛盾的问题,其催化合成氨机理如图所示。
分析解释:与传统的催化合成氨(铁触媒、)相比,双催化剂双温催化合成氨具备优势的原因是。
17. 研究人员对Na2SO3和Fe粉去除废水中的硝态氮进行研究。已知:i.某工厂排放的含氮废水中总氮=10mg·L-1 , 含有硝态氮、氨氮。
ii.本实验中Na2SO3在时,脱除硝态氮(转化为N2)效果较强。
iii.Na2SO3和Fe粉均可以脱除硝态氮,本实验中二者均为过量。
(1)、Na2SO3和Fe粉在去除废水中硝态氮的过程中表现性(填“氧化”或“还原”)。(2)、研究Na2SO3在pH=1的含氮废水中发生反应的情况,实验结果如图1。
①根据图1,写出“实验组一”中发生反应的离子方程式。
②进行“实验组二”实验时发现,降低溶液pH更有利于的去除,可能的原因是。
(3)、脱除pH=1的含氮废水中硝态氮,单独加入Na2SO3或同时加入Na2SO3与Fe粉的实验结果如图2和图3。
①根据图2,前15min内Na2SO3 , 脱除NO;主要反应的离子方程式为。
②根据图2和图3,20~60min内体系中生成主要反应的离子方程式为。
③检验处理后的废水中存在取一定量废水蒸发浓缩,(补充操作和现象)。
18. 铅、铜是芯片焊接和封装工艺过程中常用的金属材料,采用“火法工艺”和“湿法工艺”均可将铅冰铜冶炼成铅和铜。已知:i.铅冰铜成分:Cu2S、PbS及少量FeS、ZnS;富冰铜主要成分:Cu2S、FeS。
ii.Cu2S、PbS难溶于酸,FeS、ZnS可溶于酸。
iii.0.1mol·L-1Fe2+沉淀为Fe(OH)2 , 起始的pH为6.3,完全沉淀的pH为8.3;
0.1mol·L-1Fe3+沉淀为FeOOH,起始的pH为1.5,完全沉淀的pH为2.8。
(1)、Ⅰ.火法工艺:
“第一次熔炼”过程中,控制空气用量可使铁以FeS的形式留在富冰铜中。
①“熔炼”时铁可以将PbS中的铅置换出来,化学方程式是。
②富冰铜中的Cu2S转化生成1mol铜时,理论上至少需要反应molO2。
③控制空气用量进行二次熔炼而不能使用足量空气一次性熔炼的原因是。
(2)、Ⅱ.湿法工艺:
“酸浸”过程是用过量稀硫酸浸取铅冰铜。①氧气可将Cu2S氧化成硫和Cu2+ , 酸浸液中的阳离子还有。
②废电解液不能循环使用次数过多,原因是。
(3)、用废电解液制备ZnSO4和铁黄。①经氧气处理后的废电解液中。实际浓度大于 , 则用ZnO调节溶液pH1.5(填“>”、“<”或“=”)时开始有FeOOH沉淀析出。
②废电解液中Fe2+转化为铁黄的离子方程式是。
(4)、“湿法工艺”与“火法工艺”处理铅冰铜相比,湿法工艺的优点是。19. 实验小组探究金属银与碘水的反应。已知25℃时:i.碘水中、
ii.次碘酸不稳定,室温下部分分解为碘酸。
iii.;AgI在浓KI溶液中可以(无色)形式存在。
将碘水I2溶于蒸馏水)加入盛有银粉的试管中,实验记录如下:
实验Ⅰ
现象

现象a:棕黄色溶液(pH≈5.9)迅速变为无色,Ag粉表面略变暗,未见其他明显现象,溶液pH≈6.2。
现象b:滴加淀粉溶液,未见明显变化;继续滴加稀H2SO4 , 溶液仍未见明显变化。
(1)、碘水中I2与H2O反应的化学方程式为。(2)、针对实验Ⅰ现象a“棕黄色溶液迅速变为无色”的原因,实验小组提出如下假设:假设1:银粉与氢碘酸发生反应(填化学方程式)生成碘化银,使碘单质减少;。
假设2:银粉与碘单质直接化合生成碘化银,使碘单质减少;
假设3:银粉与氢碘酸及O2共同作用生成碘化银,使碘单质减少。
实验小组结合资料分析并设计实验验证假设:
①结合数据和实验现象判断假设l(填“是”或“不是”)主要原因。
②通过实验证实银粉表面生成了AgI:取表面变暗的银粉,加入一定量浓KI溶液,振荡,静置,取上层清液,加蒸馏水稀释,出现黄色浑浊。用化学平衡移动原理解释出现黄色浑浊的原因:。
③资料表明假设2成立。
④实验小组针对假设3,在实验Ⅰ的基础上设计了实验Ⅱ和实验Ⅲ:
实验Ⅱ:取一定量碘水,加入CCl4 , 充分振荡后分液,取上层清液,加入淀粉溶液,未见明显变化;加入稀硫酸后溶液变蓝。
实验Ⅲ:向实验Ⅰ最后所得溶液中加入(填试剂),溶液立即变蓝。
综合实验Ⅰ、实验Ⅱ、实验Ⅲ,可以证实假设3.分析实验Ⅱ的作用是。
(3)、反思:实验小组认为,本实验Ag与碘水反应的过程中,AgI的生成促进了体系中氧化还原反应的进行。进行电化学实验证实。补全下图所示电化学装置中的试剂、。