人教版高中化学2023-2024学年必修一期末模拟试卷(一)
试卷更新日期:2023-12-12 类型:期末考试
一、选择题
-
1. 判断下列有关化学基本概念的依据正确的是( )A、氧化还原反应:元素化合价是否变化 B、纯净物与混合物:是否仅含有一种元素 C、强弱电解质:溶液的导电能力大小 D、溶液与胶体:本质不同是能否发生丁达尔效应2. 下列关于物质的分类中,正确的是 ( )
分类
组合酸性氧化物 酸 盐 混合物 电解质 A CaO HClO 烧碱 漂白粉 H2O B CO H2SO4 NaOH 碱石灰 蔗糖 C CO2 Al(OH)3 NaHCO3 CuSO4·5H2O NH3 D SO2 HNO3 CaCO3 Fe(OH)3胶体 KCl A、A B、B C、C D、D3. 下列离子方程式正确的是( )A、稀硫酸滴在铜片上:Cu+2H+=Cu2++H2↑ B、稀硝酸滴在大理石上:CaCO3+2H++2NO3-=Ca2++2NO3-+CO2+H2O C、氧化铁与稀盐酸混合:Fe2O3+6H+=2Fe3++3H2O D、氢氧化铜和稀盐酸反应:OH-+H+=H2O4. 硝酸是一种重要的化工原料,工业制备涉及的一个反应为:3NO2 + H2O=2HNO3 + NO。下列说法不正确的是( )A、H2O既不是氧化剂也不是还原剂 B、NO是还原产物 C、氧化剂与还原剂之比为2:1 D、生成1molHNO3 转移电子1mol5. Na2O2是常用的供氧剂,下列说法不正确的是( )A、Na2O2可由Na在空气中加热而生成 B、Na2O2中阴、阳离子个数比为1∶2 C、Na2O2与水反应有1个O2生成时,转移1个电子 D、Na2O2与H2O反应生成O2的化学方程式为2Na2O2+2H2O=4NaOH+O2↑6. 某无土栽培的植物培养液成分为:KCl : 0.3mol/L、K2SO4: 0.2mol/L、ZnSO4: 0.1mol/L,若以KCl、K2SO4、ZnCl2为原料配制1 L培养液,需要KCl的物质的量为( )mol 。A、0.1 B、0.2 C、0.3 D、0.47. 用表示阿伏加德罗常数的值,下列叙述不正确的是( )A、固体中含离子总数为 B、与的混合物中含氧原子的数目为 C、含的浓盐酸与反应,被氧化的的质量为 D、通常状况下,和的混合气体,其物质的量小于8. 如图所示是配制一定物质的量浓度溶液的过程。下列说法中不正确的是( ) A、所配制的溶液中的物质的量浓度为 B、操作中玻璃棒的下端应该抵在容量瓶的刻度线下方 C、操作如果仰视,所配得溶液浓度偏高 D、操作中,定容摇匀后发现液面低于刻度线,不再需要加水9. 向一定体积的Ba(OH)2中逐滴滴入稀硫酸,导电能力随时间变化的曲线如右图所示,下列说法不正确的是( )
A、所配制的溶液中的物质的量浓度为 B、操作中玻璃棒的下端应该抵在容量瓶的刻度线下方 C、操作如果仰视,所配得溶液浓度偏高 D、操作中,定容摇匀后发现液面低于刻度线,不再需要加水9. 向一定体积的Ba(OH)2中逐滴滴入稀硫酸,导电能力随时间变化的曲线如右图所示,下列说法不正确的是( ) A、A点导电能力强,是因为:Ba(OH)2 = Ba2+ + 2OH- B、AB段发生的反应为:Ba2+ + 2OH-+ SO42- + 2H+ = BaSO4 ↓+ 2H2O C、a时刻恰好完全反应,导电性约为零,说明BaSO4是非电解质 D、BC段导电性增强,是因为过量的硫酸电离出的离子导电10. 实验室常采用点滴板来完成部分实验,这样既可以节约药品的用量,又便于观察实验现象。图中所示的实验点滴板上描述的实验现象或推论正确的是( )
A、A点导电能力强,是因为:Ba(OH)2 = Ba2+ + 2OH- B、AB段发生的反应为:Ba2+ + 2OH-+ SO42- + 2H+ = BaSO4 ↓+ 2H2O C、a时刻恰好完全反应,导电性约为零,说明BaSO4是非电解质 D、BC段导电性增强,是因为过量的硫酸电离出的离子导电10. 实验室常采用点滴板来完成部分实验,这样既可以节约药品的用量,又便于观察实验现象。图中所示的实验点滴板上描述的实验现象或推论正确的是( ) A、新制氯水滴加到pH试纸及淀粉-KI溶液孔穴,发生的现象都体现了新制氯气的漂白性 B、生锈铁屑加入过量稀硫酸反应后,若加入溶液后,溶液褪色,说明该溶液中有存在 C、固体中滴加溶液后最终为白色沉淀 D、生锈铁屑加入足量稀硫酸后,若加入KSCN溶液,溶液一定变血红色11. 部分含铁物质的分类与相应化合价关系如图所示。下列推断合理的是( )
A、新制氯水滴加到pH试纸及淀粉-KI溶液孔穴,发生的现象都体现了新制氯气的漂白性 B、生锈铁屑加入过量稀硫酸反应后,若加入溶液后,溶液褪色,说明该溶液中有存在 C、固体中滴加溶液后最终为白色沉淀 D、生锈铁屑加入足量稀硫酸后,若加入KSCN溶液,溶液一定变血红色11. 部分含铁物质的分类与相应化合价关系如图所示。下列推断合理的是( )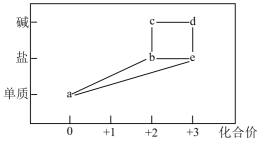 A、a可与e反应生成b B、b只有还原性,没有氧化性 C、可将溶液e加入浓碱液中制得d的胶体 D、不可能存在b→c→d→e→b的循环转化关系12. 已知短周期元素的四种离子aA2+、bB+、cC3-、dD-具有相同的电子层结构,则下列叙述中正确的是( )A、原子半径:B>A>C>D B、原子序数:D>C>B>A C、离子半径:C3->D->A2+>B+ D、氧化性:A2+>B+ , 还原性:C3-<D-13. 和亚氯酸钠 (NaClO2)都是广泛使用的漂白剂、消毒剂,高浓度气体易发生爆炸,在生产、使用时需用其他气体进行稀释。某工厂生产和的工艺流程为:
A、a可与e反应生成b B、b只有还原性,没有氧化性 C、可将溶液e加入浓碱液中制得d的胶体 D、不可能存在b→c→d→e→b的循环转化关系12. 已知短周期元素的四种离子aA2+、bB+、cC3-、dD-具有相同的电子层结构,则下列叙述中正确的是( )A、原子半径:B>A>C>D B、原子序数:D>C>B>A C、离子半径:C3->D->A2+>B+ D、氧化性:A2+>B+ , 还原性:C3-<D-13. 和亚氯酸钠 (NaClO2)都是广泛使用的漂白剂、消毒剂,高浓度气体易发生爆炸,在生产、使用时需用其他气体进行稀释。某工厂生产和的工艺流程为:
发生器中反应为(未配平),下列关于生产流程的相关说法不正确的是( )
A、工业上将制成固体,便于贮存和运输 B、参加反应的和的物质的量之比为 C、吸收器中生成的离子方程式为: D、生产时向发生器中通入空气,可避免发生危险14. 部分含氯物质的分类与相应氯元素的化合价关系如图所示。下列说法不正确的是( ) A、c是一种新型自来水消毒剂 B、e的钾盐常用于实验室制 C、a的浓溶液和一定条件下可生成b D、e与a的浓溶液反应不可能同时生成b和c两种产物15. 下列实验能够达到相应目的的是( )
A、c是一种新型自来水消毒剂 B、e的钾盐常用于实验室制 C、a的浓溶液和一定条件下可生成b D、e与a的浓溶液反应不可能同时生成b和c两种产物15. 下列实验能够达到相应目的的是( )



将FeCl3饱和溶液滴入热NaOH溶液中制备氢氧化铁胶体
一段时间后,若往烧杯中液体滴加硝酸酸化硝酸银有白色沉淀,则半透膜破损
装置可用于固体碳酸氢铵加热分解
装置可用于比较碳酸钠和碳酸氢钠的热稳定性
A
B
C
D
A、A B、B C、C D、D16. 物质W常用作漂白剂和氧化剂,其构成元素均为短周期主族元素,各元素原子半径与原子序数的关系如图所示,N和Z的原子序数之差为8。下列说法正确的是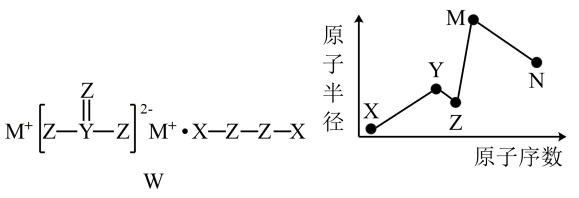 A、X、Z形成的化合物与M、N形成的化合物可以发生氧化还原反应 B、可通过比较Y单质与N单质的还原性强弱来判断Y、N的非金属性强弱 C、Z的氢化物的沸点一定大于Y的氢化物的沸点 D、化合物W常用作氧化剂,宜在高温下使用
A、X、Z形成的化合物与M、N形成的化合物可以发生氧化还原反应 B、可通过比较Y单质与N单质的还原性强弱来判断Y、N的非金属性强弱 C、Z的氢化物的沸点一定大于Y的氢化物的沸点 D、化合物W常用作氧化剂,宜在高温下使用二、非选择题
-
17. 元素周期表的一部分如图,根据①~⑨在元素周期表中的位置,按题目要求回答下列问题:
 (1)、在元素②~⑧中,非金属性最强的元素是(填元素符号)。(2)、③~⑥四种元素的原子半径由大到小的顺序是(填元素符号)。(3)、⑧和⑨两种元素的最高价氧化物对应的水化物中酸性较强的是(填化学式)。(4)、由元素①和元素④形成的原子个数比为1∶1的化合物中所含化学键的种类为(填“离子键”、“极性共价键”或“非极性共价键”,有几种填几种);写出由元素⑤和元素④形成的原子个数比为1∶1的化合物的电子式:。(5)、写出元素⑦的单质与元素⑤的最高价氧化物对应的水化物之间反应的离子方程式:。(6)、元素⑤和元素⑧形成的常见化合物的化学式为 , 高温灼烧该化合物时,火焰呈色。18. 为实现工业含铝、铁、铜合金(假定其余杂质与酸碱都不反应)废料的再利用,某化学兴趣小组设计了如下回收利用方案:
(1)、在元素②~⑧中,非金属性最强的元素是(填元素符号)。(2)、③~⑥四种元素的原子半径由大到小的顺序是(填元素符号)。(3)、⑧和⑨两种元素的最高价氧化物对应的水化物中酸性较强的是(填化学式)。(4)、由元素①和元素④形成的原子个数比为1∶1的化合物中所含化学键的种类为(填“离子键”、“极性共价键”或“非极性共价键”,有几种填几种);写出由元素⑤和元素④形成的原子个数比为1∶1的化合物的电子式:。(5)、写出元素⑦的单质与元素⑤的最高价氧化物对应的水化物之间反应的离子方程式:。(6)、元素⑤和元素⑧形成的常见化合物的化学式为 , 高温灼烧该化合物时,火焰呈色。18. 为实现工业含铝、铁、铜合金(假定其余杂质与酸碱都不反应)废料的再利用,某化学兴趣小组设计了如下回收利用方案:
回答下列问题:
(1)、请写出生成滤液A的离子方程式为。(2)、若要从滤液D得到绿矾晶体,步骤③实验操作有、、过滤、洗涤、干燥。(3)、滤液D易被空气氧化,设计实验检验滤液D是否变质。(4)、为配制的溶液,配制该溶液用到的玻璃仪器除量筒、烧杯、玻璃棒外,还需要(填玻璃仪器名称),需称量胆矾晶体的质量为g。下列操作会导致所配溶液浓度偏高的是(填字母)。A.转移溶液前容量瓶中存在少量蒸馏水 B.所称取的晶体失去了部分结晶水
C.定容前未洗涤烧杯和玻璃棒 D.定容时仰视容量瓶刻度线
19. “84 消毒液”能有效杀灭甲型 H1N1 等病毒,某同学购买了一瓶“威露士”牌“84 消毒液”,并查阅相关资料和消毒液包装说明得到如下信息:“84 消毒液”: 1000mL、含 25%NaClO、密度 1.20g·cm-3 , 稀释 100 倍(体积比)后使用。(1)、该“84 消毒液”中 NaClO 的物质的量浓度约为mol·L-1。(2)、该同学参阅该“84 消毒液”的配方,欲用 NaClO 固体配制 450mL 上述规格的“84 消毒液”。下列说法正确的是____(填字母)。 A、需要称量 NaClO 固体的质量为 134.1g B、转移溶液的示意图如图所示,其中存在一处错误 C、利用久置的商品 NaClO 来配制可能导致结果偏低 D、容量瓶在闲置不用时,应在瓶塞及瓶口处垫一纸条,以防粘结(3)、“84 消毒液”与稀硫酸混合使用可增强消毒能力,某消毒小组人员用98% (密度为 1.8g·cm-3)的浓硫酸配制 100mL 物质的量浓度为 0.8mol·L-1的稀硫酸。
A、需要称量 NaClO 固体的质量为 134.1g B、转移溶液的示意图如图所示,其中存在一处错误 C、利用久置的商品 NaClO 来配制可能导致结果偏低 D、容量瓶在闲置不用时,应在瓶塞及瓶口处垫一纸条,以防粘结(3)、“84 消毒液”与稀硫酸混合使用可增强消毒能力,某消毒小组人员用98% (密度为 1.8g·cm-3)的浓硫酸配制 100mL 物质的量浓度为 0.8mol·L-1的稀硫酸。①为配制上述稀硫酸,除了容量瓶、烧杯、玻璃棒外,还缺少的玻璃仪器是、。
②在配制过程中,下列实验操作可能导致配制的硫酸溶液浓度偏低的是(填序号)。
A.定容时仰视刻度线
B.定容后经振荡、摇匀、静置后,发现液面下降,再加适量的蒸馏水
C.浓硫酸在烧杯中加水稀释后,未冷却就向容量瓶中转移
D.把洗涤量筒所产生的洗涤液注入容量瓶
20. 国际化学年的中国宣传口号是“化学-我们的生活,我们的未来”。学习化学应该明白“从生活中来,到生活中去”道理。(1)、①高铁酸钠是一种新型的绿色消毒剂,主要用于饮用水处理,其中一种制备方法如下3ClO- +2Fe3++10OH- = 2FeO42- +3Cl- +5H2O, 该反应中氧化剂是 , 氧化产物是。
②用单线桥法表示上述反应中电子转移的方向和数目:。
(2)、胃舒平(含有氢氧化铝)可治疗胃酸过多,其反应的离子反应方程式为:。(3)、人体内的铁元素是以和的形式存在。易被人体吸收,服用维生素C,可使转化成 , 有利于人体吸收,说明维生素C具有(填“氧化性”或“还原性”)。(4)、漂白粉暴露在空气中易变质,向暴露在空气中的漂白粉中加入浓盐酸,可能收集到的气体除了挥发的HCl和水蒸气,还可能有 。(5)、探究碳酸氢钠的热稳定性,并利用其产物验证过氧化钠与二氧化碳的反应,按如图装置图进行实验。
①A中反应的化学方程式为。
②E中收集的气体主要是 。