浙江省湖州市安吉县2023-2024学年九年级第一学期科学期中阶段性检测试卷
试卷更新日期:2023-12-11 类型:期中考试
一、选择题(本题有16小题,每小题3分,共48分。请选出各小题中一个符合题意的选项,不选、多选、错选均不给分。)
-
1. 铁是目前人类使用最广泛的金属。下列过程中没有发生化学变化的是( )A、铁丝燃烧 B、矿石炼铁 C、钢铁生锈 D、铁丝织网2. pH是反映物质酸碱性强弱的指标。一些物质的pH范围如下,其中呈酸性的是( )A、厨房油污清洗剂(12-13) B、84消毒液(11-12) C、鸡蛋清(7-8) D、柠檬汁(2-3)3. 打开浓盐酸试剂瓶时,能看到瓶口产生白雾且闻到刺激性气味,说明浓盐酸具有( )A、挥发性 B、腐蚀性 C、吸水性 D、酸性4. 《易经》记载:“泽中有火”、“上火下泽”。这是对甲烷气体在湖泊沼泽水面上起火现象的描述。下列有关甲烷的叙述,正确的是( )A、甲烷的化学式为C2H4 B、甲烷燃烧只生成水 C、甲烷是天然气的主要成分 D、甲烷与空气的混合物,被点燃时不可能会发生爆炸5. 性质决定用途,用途反映性质。下列物质的用途与性质对应不正确的是( )A、用氢氧化铝治疗胃酸过多——氢氧化铝能与盐酸发生反应 B、湿法炼铜——铜的金属活动性比铁强 C、用生石灰制作自热盒饭的发热材料——与水反应放热 D、用氢氧化钠吸收二氧化硫——氢氧化钠能与二氧化硫反应6. 同一种物质往往会有不同的表述方式。下列有关物质的化学式、名称、俗名不完全对应的是( )A、NaCl氯化钠食盐 B、NaOH氢氧化钠火碱 C、Na2CO3碳酸钠纯碱 D、CaO氧化钙消石灰7. 物质间发生复分解反应需要满足一定的条件。下列物质混合后,能发生复分解反应的是( )A、氢氧化镁、硫酸铜溶液 B、盐酸溶液、氢氧化钡溶液 C、碳酸钠溶液、氯化钾溶液 D、硫酸溶液、氯化钠溶液8. 下列试管壁内残留的固体物质不能用稀盐酸除去的是( )A、盛放过生锈铁钉后留下的红棕色固体 B、装氧化铜粉末后留下的黑色固体 C、用氯化钡试液检验硫酸后留下的白色固体 D、用澄清石灰水检验CO2后留下的白色固体9. 下列关于硫酸的说法错误的是( )A、稀释浓硫酸时,应将水注入浓硫酸中,并用玻璃棒搅拌 B、浓硫酸有强烈的腐蚀性 C、稀硫酸能使紫色石蕊试液变红色 D、浓硫酸有吸水性,可作干燥剂10. 钴(Co)的金属活动性与铁相似,钴的化合物相关性质如下、下列预测合理的是( )
物质
CoO
Co(OH)2
CoCl2
CoCO3
在水中的溶解性
难溶,灰绿色固体
难溶,粉红色固体
易溶,溶液呈粉红色
难溶,粉红色固体
A、Co能从MgCl2溶液中置换出Mg B、CoO能与盐酸反应得到粉红色溶液 C、CoCO3能与盐酸反应生成H2 D、Co(OH)2可由Co与NaOH溶液反应制得11. 下列各级物质,能在酸性溶液中大量共存,且溶液是无色、透明的是( )A、Na2CO3、MgSO4、NaCl、K2SO4 B、CuSO4、KCl、NaNO3、CaCl2 C、Na2SO4、BaCl2、NaNO3、NaOH D、Na2SO4、KCl、Mg(NO3)2、AlCl312. 现有X、Y、Z三种金属,为探究其金属活动性顺序,进行了如下实验:①将X、Z分别放入稀硫酸中,X溶解并产生氢气,Z不反应;②将Y和Z分别放入硝酸银溶液中,过一会儿,在Z表面有银析出,而Y没有变化。则有关X、Y、Z的金属活动性顺序正确的是( )A、X>Y>Z B、X>Z>Y C、Y>X>Z D、Z>X>Y13. 下列实验操作(方案)不能达到实验目的的是( )选项
实验目的
实验操作
A
鉴别NaCl溶液和Na2CO3溶液
取样,分别滴加CaCl2溶液
B
检验稀盐酸中是否含有硫酸
取样,滴加少量Ba(OH)2溶液
C
除去氯化钠中的碳酸钠
加入适量盐酸溶液
D
分离CaCO3和CaO的混合物
加适量水,充分溶解后过滤
A、A B、B C、C D、D14. 相同质量的镁、铁、锌三种金属,分别与足量的、相同质量分数的稀硫酸充分反应,生成氢气质量与反应时间关系如图,分析图像判断,下列说法正确的是( ) A、金属锌反应最先完成 B、金属锌的活动性最强 C、金属镁生成氢气质量最多 D、金属铁消耗稀硫酸质量最多15. 下列物质的转化中,只有加入酸才能一步实现的是( )A、CaCO3→CaCl2 B、Fe→FeSO4 C、NaOH→NaCl D、Ba(NO3)2→BaSO416. 下列是分析久置于空气中的NaOH固体的相关实验(不考虑水分),其中合理的( )
A、金属锌反应最先完成 B、金属锌的活动性最强 C、金属镁生成氢气质量最多 D、金属铁消耗稀硫酸质量最多15. 下列物质的转化中,只有加入酸才能一步实现的是( )A、CaCO3→CaCl2 B、Fe→FeSO4 C、NaOH→NaCl D、Ba(NO3)2→BaSO416. 下列是分析久置于空气中的NaOH固体的相关实验(不考虑水分),其中合理的( )序号
实验目的
实验方案
①
证明变质
取少量固体,加水溶解,滴加紫色石蕊试液。若变蓝,则说明固体未变质
②
确定成分
取少量固体,加入足量氯化钙溶液,过滤,向滤液中滴加酚酞试液。若变红,则说明固体部分变质
③
测定纯度
称取ag样品与足量氯化钡溶液充分反应,将沉淀过滤,洗涤、干燥后,得到bg固体
④
除去杂质
取固体,加水溶解,滴加氯化钙溶液至恰好完全反应,过滤
A、①② B、①③ C、②③ D、③④二、填空题(本题有7小题16空格,每空格2分,共32分。)
-
17. “绿色化学”的特点之一是“零排放”。科学家通过研究实现了,在一定的条件下,二氧化碳和氢气可以按一定的比例发生反应(填一种基本反应类型),只生成一种产物,实现了“零排放”。这种物质就是甲酸(CH2O2)。在物质分类上,甲酸属于(选填“有机物”或“无机物”)。18. 如图所示为氢气和氧化铜反应的实验装置图。请分析回答:
 (1)、下面是该实验的四个步骤,正确的操作顺序是
(1)、下面是该实验的四个步骤,正确的操作顺序是
A.加热 B.通入氢气气 C.停止通入氢气 D.停止加热(2)、在实验过程中看到的现象是黑色氧化铜变成红色的物质,同时试管口有水珠出现,说明氢气具有性。19. 实现中华民族伟大复兴,每个新时代青年都有一个中国梦。(1)、航母梦:钢铁是制造第三艘航母“福建舰”的主要材料,与纯铁相比,钢铁的硬度更(填“大”或“小”)。(2)、强军梦:国产C919飞机采用了铝合金材料。铝比铁更耐腐蚀,是因为铝在空气中表面会生成一层致密的(填化学式)保护膜。20. 酸与碱的反应是中和反应。盐酸与氢氧化钠溶液反应时pH的变化如图。 (1)、m点所示溶液中的溶质为(填写化学式)。(2)、p点所示的溶液中滴加酚酞试剂后,溶液显。(3)、该反应的本质是。21. 物质往往可以按组成进行分类。(1)、已知“
(1)、m点所示溶液中的溶质为(填写化学式)。(2)、p点所示的溶液中滴加酚酞试剂后,溶液显。(3)、该反应的本质是。21. 物质往往可以按组成进行分类。(1)、已知“ ”“
”“ ”表示质子数不同的原子。如图所示的气体物质中,属于混合物的是。
”表示质子数不同的原子。如图所示的气体物质中,属于混合物的是。 (2)、有下列物质:①H2SO4、②H2O2、③NaOH、④Fe3O4、⑤O2、⑥Na2CO3。
(2)、有下列物质:①H2SO4、②H2O2、③NaOH、④Fe3O4、⑤O2、⑥Na2CO3。其中属于氧化物的是。
22. 以镁矿石(主要成分MgCO3、SiO2)为原料生产MgO的工艺流程如下图。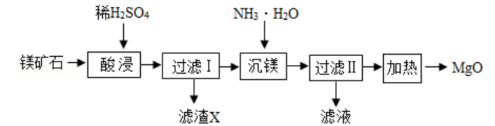
注:SiO2难溶于水和常见的酸;“沉镁”过程中有Mg(OH)2生成。
(1)、滤渣X的主要成分为(填化学式)。(2)、写出图示酸浸过程中发生反应的化学方程式。23. 物质间存在相互转化关系。化学实验小组同学用Na2CO3、H2SO4、BaCl2和NaOH四种无色溶液进行实验。(1)、小组同学经讨论后,一致认为这四种无色溶液两两之间能发生的反应有个,写出其中有气泡产生的化学反应方程式:。(2)、小组同学将四种无色溶液倒入同一大烧杯中,得到悬浊液,将其过滤,得到白色沉淀和无色滤液,向无色滤液中加入紫色石蕊试液,溶液变红,则该无色滤液中一定含有的粒子是(填微粒符号)。三、实验探究题(本题有5小题,第24、25、26每题各6分,第27题8分,第28题9分,共35分。)
-
24. 归纳总结是学习化学的重要方法,小明同学用思维导图的形式总结了NaOH的化学性质如图甲(即NaOH与四类物质能够发生化学反应)。请回答:
 (1)、小红同学将某稀酸溶液逐滴滴入一定量的稀氢氧化钠溶液中,用温度传感器对反应过程中溶液的温度进行实时测定,得到的曲线如图乙,根据图像可以得出该反应是 (填“吸热”或“放热”)反应。(2)、反应③可以选用的盐是____。A、NaNO3 B、CuSO4 C、CaCl2 D、KNO3(3)、二氧化碳和一氧化碳都是非金属氧化物,二氧化碳能和氢氧化钠反应,一氧化碳却不能,造成此化学性质差异的微观原因是。25. 镁条放置在空气中一段时间,表面会形成一层黑色物质。小科查得以下资料:
(1)、小红同学将某稀酸溶液逐滴滴入一定量的稀氢氧化钠溶液中,用温度传感器对反应过程中溶液的温度进行实时测定,得到的曲线如图乙,根据图像可以得出该反应是 (填“吸热”或“放热”)反应。(2)、反应③可以选用的盐是____。A、NaNO3 B、CuSO4 C、CaCl2 D、KNO3(3)、二氧化碳和一氧化碳都是非金属氧化物,二氧化碳能和氢氧化钠反应,一氧化碳却不能,造成此化学性质差异的微观原因是。25. 镁条放置在空气中一段时间,表面会形成一层黑色物质。小科查得以下资料:I.常温下,空气中的氮气和稀有气体不会与镁发生反应。
II.无水CaCl2固体有较强的吸水性,能吸收空气中的水蒸气。
为探究镁表面黑色物质的成因是与空气中的哪些成分有关,他开展如图实验进行探究。
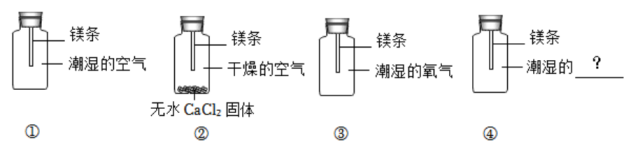
数日后第①组镁条表面出现黑色物质,第②、③组只观察到镁条表面变暗,并没有出现黑色物质。
(1)、对照第①、②两组实验,可以得出“镁条变黑一定与有关”的结论。(2)、对照第两组实验,可以得出镁条变黑还需要空气中二氧化碳气体的参与。(3)、小科通过查阅资料发现:镁条表面变黑,实质是镁与空气中的水、氧气、二氧化碳发生了反应。为了使实验结论更加严谨,还应该补做第④组实验,且观察到镁条表面无明显变化才能得出结论,则第④组实验“?”处应填写。26. 竹麻通过生石灰,草木灰(主要成分是K2CO3)浸泡以及打浆、抄纸等步骤可制得纸张。某兴趣小组模拟古代造纸技术,他们将一定量的生石灰(CaO)、K2CO3用足量的水溶解后。过滤得到澄清溶液。澄清溶液中溶质是什么,请你参与他们的探究。
【猜想假设】
猜想一:只含有KOH;
猜想二:含有KOH、;
猜想三:KOH、Ca(OH)2
【设计实验】
实验步骤
实验现象
实验结论
1.取溶液少许于试管中,滴加过量稀盐酸
无明显现象
猜想二不正确
2.取溶液少许于试管中,滴加少许K2CO3溶液
猜想三正确
【交流反思】
含有KOH、Ca(OH)2的废水直接排放会造成水体污染。小组同学对废水做如图处理。
C烧杯中出现现象时,说明水中已无KOH、Ca(OH)2。
27. 科学兴趣小组进行稀硫酸化学性质的探究。回答下列问题:(1)、将稀硫酸分别加入图中的试管中,无明显现象的是(填字母序号),要证明该试管中已发生了化学反应,以下方案可行的是(填数字序号)。①滴入酚酞溶液无明显现象②测得试管中溶液的pH小于7
③滴入BaCl2溶液有白色沉淀出现④滴入CuCl2溶液无蓝色沉淀出现
 (2)、上述实验结束后,兴趣小组继续探究。
(2)、上述实验结束后,兴趣小组继续探究。实验步骤
实验现象
步骤1:将试管A中物质全部倒入试管E中
产生气泡且白色沉淀增加
步骤2:过滤,得到滤液
/
步骤3:向滤液中逐滴滴加氢氧化钠溶液
开始无明显现象,一段时间后出现白色沉淀
①步骤2得到的滤液中,一定含有的溶质是(填化学式)。
②步骤3中,产生的白色沉淀是(填化学式)。
28. 某小组采用图甲所示实验装置探究CO还原Fe2O3时,出现了争论。甲同学观察到固体由红色变成黑色,推断黑色固体是Fe;乙同学提出质疑,认为黑色固体可能是Fe3O4 , 并查阅了资料:Fe3O4可被磁铁吸引,几乎不溶于稀的酸溶液。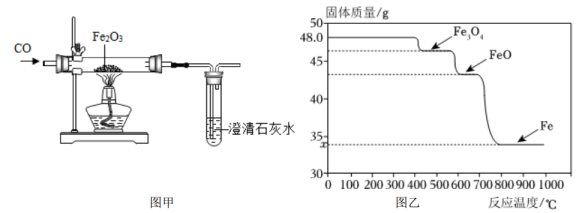
大家对乙同学提出的质疑进行分析和验证。
(1)、该小组通过对黑色固体进行检验,证明同时含有Fe3O4和Fe。检验的操作和现象是:取样于试管中,。(2)、该小组为了探索CO还原Fe2O3与温度的关系,走访了某钢铁厂。工程师用SDTQ热分析仪对该反应进行研究,根据不同温度下所得固体的质量,推导对应的固体成分,结果如图乙。①用CO炼铁时,还原Fe2O3的温度应不低于℃。(填“400”“600”或“800”)
②该小组查阅资料得知酒精灯加热温度为600℃左右,他们发现上述对黑色固体成分的检验结果与图像有矛盾,推测黑色固体在冷却过程中发生了以下反应:=Fe3O4+Fe。
③在适合的条件下,Fe2O3全部被还原成Fe,则图中:x=。
四、解答题(本题有7小题,第29、30、31、32、33每小题各6分,第34小题8分,第35小题7分,共45分)
-
29. 钢铁是使用最多的金属材料。生铁和钢是含碳量不同的两种铁合金,其中生铁的含碳量为2%-4.3%,钢的含碳量为0.03%~2%。(1)、从公元1世纪开始,铁便成了一种最主要的金属材料。历史上遗留下来的铜制品远比铁制品多。从物质性质的角度看,原因是。(2)、下列金属制品中,利用了金属导热性的是____(填字母)。A、
 后周铁狮子
B、
后周铁狮子
B、 铸铁井盖
C、
铸铁井盖
C、 不锈钢蒸锅
D、
不锈钢蒸锅
D、 铝导线
(3)、将1.0g某铁合金在纯氧中完全燃烧,得到0.11g二氧化碳。通过计算判断该铁合金属于生铁还是钢。(写出计算过程)。30. 农业生产与科学息息相关,科学在农业生产中发挥着重要作用。(1)、小红同学对自家麦田的土壤进行分析后,发现土壤呈酸性,为了改良土壤,可以加入下列哪种物质____(填字母)。A、氢氧化钠 B、熟石灰 C、食盐 D、盐酸(2)、粮食安全是“国之大者”,小麦是我国重要的粮食作物。合理施肥是小麦增产的最有利措施,下列肥料中属于复合肥的是____(填字母)。A、CO(NH2)2 B、Ca3(PO4)2 C、KNO3 D、KCl(3)、波尔多液是由硫酸铜和石灰乳配制成的杀菌剂。喷洒波尔多液后,果蔬表面有一些蓝色斑点,蓝色斑点的主要成分是(填化学式)。31. 在宏观、微观、符号之间建立联系,是化学学科特有的思维方式。
铝导线
(3)、将1.0g某铁合金在纯氧中完全燃烧,得到0.11g二氧化碳。通过计算判断该铁合金属于生铁还是钢。(写出计算过程)。30. 农业生产与科学息息相关,科学在农业生产中发挥着重要作用。(1)、小红同学对自家麦田的土壤进行分析后,发现土壤呈酸性,为了改良土壤,可以加入下列哪种物质____(填字母)。A、氢氧化钠 B、熟石灰 C、食盐 D、盐酸(2)、粮食安全是“国之大者”,小麦是我国重要的粮食作物。合理施肥是小麦增产的最有利措施,下列肥料中属于复合肥的是____(填字母)。A、CO(NH2)2 B、Ca3(PO4)2 C、KNO3 D、KCl(3)、波尔多液是由硫酸铜和石灰乳配制成的杀菌剂。喷洒波尔多液后,果蔬表面有一些蓝色斑点,蓝色斑点的主要成分是(填化学式)。31. 在宏观、微观、符号之间建立联系,是化学学科特有的思维方式。已知:氯化氢(HCl)是极易溶于水的无色气体,其水溶液俗称盐酸。
(1)、在充满HCl气体的试管中放入用石蕊试液浸泡成紫色并晾干的纸条,无明显现象;再滴入水,现象是。向盛有锌粉的试管中通入干燥的HCl气体,无明显现象;停止通气,再加入少量水,观察到有气泡产生,写出此时发生反应的化学方程式。(2)、由(1)中现象可知,HCl气体和盐酸具有不同的化学性质。请根据图中HCl气体的微观示意图,完成右边盐酸的微观示意图,并进行必要的标注(水分子不用画出)。 32. 一种物质能转化为另一种物质。取CaCl2和CaCO3的混合物12g于烧杯中,向其中滴加一定质量分数的稀盐酸,滴加稀盐酸的质量与产生气体质量的关系如图所示(注:CaCl2与稀盐酸不能发生反应)。
32. 一种物质能转化为另一种物质。取CaCl2和CaCO3的混合物12g于烧杯中,向其中滴加一定质量分数的稀盐酸,滴加稀盐酸的质量与产生气体质量的关系如图所示(注:CaCl2与稀盐酸不能发生反应)。
求:
(1)、混合物中CaCO3的质量。(写出计算过程)(2)、滴加的稀盐酸中的溶质质量分数。(写出计算过程)(3)、恰好完全反应时,所得溶液中溶质的质量分数。(写出计算过程,结果保留一位小数)33. 工业上常采用“天然苛化法”制取氢氧化钠,部分流程如下: (1)、生产工艺中可以回收再利用的物质是________。(2)、由天然碱得到碳酸钠溶液时,将天然碱粉碎的目的是________。(3)、制备时将53克溶质质量分数为20%的碳酸钠溶液与17克石灰乳(含水)混合,若二者恰好完全反应,计算经过浓缩、结晶后(不计损失),则可制得氢氧化钠晶体的质量(写出计算过程)。34. 有一包白色固体可能含碳酸钠、硫酸钠、氯化钠、硝酸钡、氢氧化钾中的一种或几种。某科学兴趣小组按以下操作检测其成分:
(1)、生产工艺中可以回收再利用的物质是________。(2)、由天然碱得到碳酸钠溶液时,将天然碱粉碎的目的是________。(3)、制备时将53克溶质质量分数为20%的碳酸钠溶液与17克石灰乳(含水)混合,若二者恰好完全反应,计算经过浓缩、结晶后(不计损失),则可制得氢氧化钠晶体的质量(写出计算过程)。34. 有一包白色固体可能含碳酸钠、硫酸钠、氯化钠、硝酸钡、氢氧化钾中的一种或几种。某科学兴趣小组按以下操作检测其成分:Ⅰ.取少量固体于烧杯中,逐渐加水并不断搅拌,烧杯内固体的质量随加入水的质量的变化如图1;
Ⅱ.继续向烧杯中滴加稀硝酸并不断搅拌,烧杯内固体的质量随加入稀硝酸的质量的变化如图2所示。
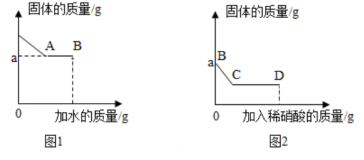
请回答下列问题:
(1)、图2中BC段可观察到的现象是;从C到D的过程中,液体的pH将逐渐(填“增大”、“减小”或“不变”);
到达D点时,溶液中含有的溶质有种(填“—”、“二”或“三”)。
(2)、原白色固体中一定含有的物质是:35. 科学小组为测定某实验废液中硫酸铜和硫酸的质量分数,分别在三只烧杯中倒入50g废液,并在烧杯中依次加入一定量的铁粉。实验结束后,测得的数据见如表:第一组
第二组
第三组
反应前加入铁粉质量/g
5.6
8.4
11.2
反应后剩余固体的质量/g
3.2
3.2
6.0
反应后产生氢气(H2)的质量
0.1
0.2
0.2
请回答:
(1)、对比第一、二组数据,第一组实验结束后,废液中的(填化学式)已全部参加反应。(2)、计算50g废液中所含硫酸的质量分数为多大。(3)、计算第二组反应完全后,所得溶液的溶质质量分数。