浙江省宁波市北仑区四校联考2023-2024学年九年级上学期科学期中考试试题
试卷更新日期:2023-12-07 类型:期中考试
一、选择题(本大题共30小题,每题3分,共60分)
-
1. 科学实验要规范操作,下列实验操作你认为正确的是( )A、熄灭酒精灯
 B、干燥氧气
B、干燥氧气 C、测定某溶液的pH
C、测定某溶液的pH D、检查气密性
D、检查气密性 2. 归纳和演绎是重要的科学方法,下列归纳或演绎合理的是( )A、纯净物是由一种物质组成的,所以纯净的空气是一种纯净物 B、酸与碱反应生成盐和水,所以生成盐和水的反应一定是酸与碱的反应 C、镁和稀硫酸反应能产生氢气,所以能和稀硫酸反应产生气体的物质一定是金属 D、碱性溶液能使石蕊试液变蓝,所以能使石蕊试液变蓝的溶液呈碱性3. 小科最近上腹部不适,经常反胃,经检查,原因是胃酸过多。下列数据为一些我市本地水果的近似pH,其中最适宜他吃的是( )A、
2. 归纳和演绎是重要的科学方法,下列归纳或演绎合理的是( )A、纯净物是由一种物质组成的,所以纯净的空气是一种纯净物 B、酸与碱反应生成盐和水,所以生成盐和水的反应一定是酸与碱的反应 C、镁和稀硫酸反应能产生氢气,所以能和稀硫酸反应产生气体的物质一定是金属 D、碱性溶液能使石蕊试液变蓝,所以能使石蕊试液变蓝的溶液呈碱性3. 小科最近上腹部不适,经常反胃,经检查,原因是胃酸过多。下列数据为一些我市本地水果的近似pH,其中最适宜他吃的是( )A、 翠冠梨pH=6.5
B、
翠冠梨pH=6.5
B、 东魁杨梅pH=2.0
C、
东魁杨梅pH=2.0
C、 桃形李pH=2.5
D、
桃形李pH=2.5
D、 柿子pH=8.5
4. 向一定量NaOH溶液中加水稀释,其pH与所加水的质量m的关系图正确的是( )A、
柿子pH=8.5
4. 向一定量NaOH溶液中加水稀释,其pH与所加水的质量m的关系图正确的是( )A、 B、
B、 C、
C、 D、
D、 5. 在空气中放置较长时间的锌片,表面会形成一层薄膜,其中含有Zn2(OH)2CO3。若该物质通过化合反应生成,反应物除了Zn外,还可能有N2、O2、CO2、H2O中的( )A、一种 B、两种 C、三种 D、四种6. 不能用金属跟酸直接反应得到的物质是 ( )
5. 在空气中放置较长时间的锌片,表面会形成一层薄膜,其中含有Zn2(OH)2CO3。若该物质通过化合反应生成,反应物除了Zn外,还可能有N2、O2、CO2、H2O中的( )A、一种 B、两种 C、三种 D、四种6. 不能用金属跟酸直接反应得到的物质是 ( )
A、氯化铜 B、氯化亚铁 C、氯化锌 D、氯化镁7. 如图为某化学反应的微观示意图,图中“●”表示硫原子,“O”表示氧原子。下列说法中错误的是( ) A、甲是SO2 B、该反应属于化合反应 C、反应前后,分子、原子种类均不变 D、反应中,甲、乙、丙三种物质的分子个数比为2:1:28. 有甲、乙、丙、丁四种无色溶液,它们分别是Na2CO3、BaCl2、HCl、H2SO4溶液中的一种。为区别这四种溶液,现将它们两两混合并得到下面现象:
A、甲是SO2 B、该反应属于化合反应 C、反应前后,分子、原子种类均不变 D、反应中,甲、乙、丙三种物质的分子个数比为2:1:28. 有甲、乙、丙、丁四种无色溶液,它们分别是Na2CO3、BaCl2、HCl、H2SO4溶液中的一种。为区别这四种溶液,现将它们两两混合并得到下面现象:溶液
甲+乙
乙+丙
丙+丁
甲+丁
现象
无明显现象
白色沉淀
白色沉淀
无色气体
根据对上述现象的分析,可推知甲、乙、丙、丁四种溶液的顺序依次是( )
A、HCl、BaCl2、Na2CO3、H2SO4 B、Na2CO3、BaCl2、H2SO4、HCl C、H2SO4、HCl、Na2CO3、BaCl2 D、HCl、H2SO4、BaCl2、Na2CO39. 下列除去杂质的方法中,正确的是( )选项
物质(括号内为杂质)
去除杂质的方法
A
NaCl(Na2CO3)
加入适量的Ca(OH)2溶液、过滤
B
CaO(CaCO3)
加水、过滤
C
Fe(Zn)
加过量FeSO4溶液、过滤
D
H2SO4(HNO3)
加Ba(NO3)2溶液、过滤
A、A B、B C、C D、D10. 化学与生活、社会发展息息相关,下列有关说法不正确的是( )A、古剑“沈卢”“以剂钢为刃,柔铁为茎干,不尔则多断折”,剂钢指的是铁的合金 B、制造新版人民币所用的棉花、优质针叶木等原料的主要成分是纤维素 C、“青蒿一握,以水二升溃,绞取汁”,该过程对青蒿素的提取属于物理变化 D、某种验钞笔中含有碘酒溶液,遇假钞呈现蓝色,其中遇碘变蓝的是葡萄糖11. 下列物质存放在烧杯中,一段时间后,质量变大且变质的是 ( )①浓盐酸 ②浓硫酸 ③烧碱 ④纯碱 ⑤生石灰 ⑥食盐
A、①⑥ B、②③④⑤ C、②③④ D、③⑤12. 下列物质混合后,不能发生复分解反应的一组是( )A、K2SO4溶液和Ba(OH)2溶液混合 B、KCl溶液和Cu(NO3)2溶液混合 C、CuSO4溶液和NaOH溶液混合 D、CaCO3和HCI溶液13. 下列各组离子,能在酸性的溶液中大量共存且形成无色溶液的是( )A、K+、Cu2+、SO42-、Cl- B、CO32-、K+、Na+、Cl- C、K+、SO42-、NO3-、Cl- D、Ba2+、Cl-、Na+、SO42-14. 下列表中物质、用途、反应方程式和基本反应类型完全正确的是( )选项
物质
用途
反应方程式
反应类型
A
过氧化氢
制氧气
H2O2=H2↑+O2↑
分解反应
B
稀硫酸
制氢气
2Fe+3H2SO4=Fe2(SO4)3+3H2↑
置换反应
C
生石灰
干燥剂
CaO+H2O=Ca(OH)2
化合反应
D
一氧化碳
冶炼金属
CO+CuOCu+CO2
复分解反应
A、A B、B C、C D、D15. 如图表示化学反应中溶液的颜色变化。下列叙述不正确的是( ) A、若X是稀盐酸,a可能是紫色石蕊试液 B、若X是稀盐酸,b可能是氧化物 C、若X是稀硫酸,c不可能是单质 D、若X是稀硫酸,d不一定是碱类物质16. 向盛有盐酸和氯化镁混合溶液的烧杯中加入一定量的氢氧化钠溶液,充分反应后发现有沉淀产生,过滤后得到滤液。有关滤液的成分,下列说法正确的有( )
A、若X是稀盐酸,a可能是紫色石蕊试液 B、若X是稀盐酸,b可能是氧化物 C、若X是稀硫酸,c不可能是单质 D、若X是稀硫酸,d不一定是碱类物质16. 向盛有盐酸和氯化镁混合溶液的烧杯中加入一定量的氢氧化钠溶液,充分反应后发现有沉淀产生,过滤后得到滤液。有关滤液的成分,下列说法正确的有( )①滤液中可能含有HCl②滤液可能只含有1种溶质
③取少量滤液于试管中,加入CuSO4溶液,无明显现象,则滤液一定含2种溶质
④取少量滤液于试管中,加入NaOH溶液,无明显现象,则滤液中可能含有NaOH
A、1个 B、2个 C、3个 D、4个17. 初中科学实验中,有许多涉及操作上的“先”与“后”的问题,如果把“先”与“后”顺序颠倒,就会影响实验效果或导致事故的发生。下列实验操作中“先”“后”顺序正确的是( )A、实验室用高锰酸钾制取氧气,停止加热时,应先熄灭酒精灯,再把导管移出水面 B、测未知溶液pH值,应先将pH试纸浸入待测溶液中,再与标准比色卡比较 C、浓硫酸不慎溅到皮肤上,要先用大量清水冲洗,后用干布擦干,最后涂抹小苏打 D、用氢气还原氧化铜时,应先通一段时间的氢气,后点燃酒精灯进行实验18. a和b为两份质量相等的固体,已知a为氯酸钾,b为混有少量二氧化锰的氯酸钾。当分别同时加热a和b至完全反应时,能正确表示生成氧气的质量随反应时间而变化的图象是( )
A、 B、
B、 C、
C、 D、
D、 19.
19.下列各图像能正确反映对应变化关系的是( )
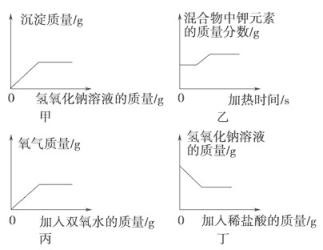 A、甲表示向一定量硫酸铜和硫酸混合液中加入氢氧化钠溶液 B、乙表示加热一定量氯酸钾和二氧化锰的混合物 C、丙表示向盛有少量二氧化锰的烧杯中不断加入双氧水 D、丁表示向一定量氢氧化钠溶液中加入稀盐酸20. 向一定质量的Mg(NO3)2和Cu(NO3)2混合溶液中加入a克锌粉和铁粉的混合物,充分反应后过滤,得到不饱和的滤液和滤渣,将滤渣洗涤、干燥后再称量,得到的固体质量仍为a克。下列分析合理的是( )
A、甲表示向一定量硫酸铜和硫酸混合液中加入氢氧化钠溶液 B、乙表示加热一定量氯酸钾和二氧化锰的混合物 C、丙表示向盛有少量二氧化锰的烧杯中不断加入双氧水 D、丁表示向一定量氢氧化钠溶液中加入稀盐酸20. 向一定质量的Mg(NO3)2和Cu(NO3)2混合溶液中加入a克锌粉和铁粉的混合物,充分反应后过滤,得到不饱和的滤液和滤渣,将滤渣洗涤、干燥后再称量,得到的固体质量仍为a克。下列分析合理的是( )①滤渣中可能有铜 ②向滤渣中加稀盐酸,可能有气泡产生
③滤液中一定有Mg(NO3)2、Zn(NO3)2和Fe(NO3)2 , 可能有Cu(NO3)2
④若忽略过滤操作中溶液损失,滤液中溶质的质量一定大于原混合溶液溶质的质量
A、①② B、①③ C、②③ D、②④二、填空题(本大题共6小题,共26分)
-
21. 在下列物质中:①小苏打②盐酸③聚乙烯④氢氧化钙。请选用合适物质的序号填空:(1)、可用于制作糕点的是。(2)、可用作塑料薄膜的是。22. 在新冠肺炎疫情防控期间,人们广泛使用医用口罩和“84”消毒液进行防护。(1)、医用口罩原料主要是聚丙烯,N95口罩实际上就是用聚丙烯无纺布SMMMS制作成的能过滤95%微细颗粒的5层口罩,聚丙烯属于(填“金属”或“合成”)材料。(2)、“84”消毒液的消毒原理是NaClO+CO2+H2O=X+HClO,生成的HClO具有杀菌作用,化学方程式中X的化学式为。23. 归纳总结是学习的一种方法,请结合小娇同学对碱的四点化学性质的归纳图完成下列问题:(箭头上方的物质是指与碱反应的物质)
 (1)、性质3的反应实质是。(2)、写出一个符合性质4的化学方程式。24. 硫酸铜晶体常用作杀菌剂,某工厂设计了2种由铜单质生产硫酸铜晶体的流程。
(1)、性质3的反应实质是。(2)、写出一个符合性质4的化学方程式。24. 硫酸铜晶体常用作杀菌剂,某工厂设计了2种由铜单质生产硫酸铜晶体的流程。 (1)、反应③的化学方程式为;(2)、已知:Cu+2H2SO4(浓)CuSO4+SO2↑+2H2O。从环保角度考虑途径Ⅱ还应采取的改进措施是。25. 当相同质量的A、B两种活泼金属(化合价均为+2价)与足量稀盐酸反应时,产生H2的质量与反应时间的关系如图所示。
(1)、反应③的化学方程式为;(2)、已知:Cu+2H2SO4(浓)CuSO4+SO2↑+2H2O。从环保角度考虑途径Ⅱ还应采取的改进措施是。25. 当相同质量的A、B两种活泼金属(化合价均为+2价)与足量稀盐酸反应时,产生H2的质量与反应时间的关系如图所示。 (1)、A、B两种金属的活动性顺序是AB。(填“>”“<”或“=”)(2)、A、B两种金属的相对原子质量大小是AB。(填“>”“<”或“=”)(3)、在Mg和Fe、Zn和Fe及Zn和Cu中,A、B两种金属可能是。26. 有一包白色固体样品,可能由硫酸钠、氢氧化销、碳酸钙、氯化钡、氯化镁中的一种或几种物质组成,为探究该样品的组成,某小组取适量样品按下列流程进行实验。
(1)、A、B两种金属的活动性顺序是AB。(填“>”“<”或“=”)(2)、A、B两种金属的相对原子质量大小是AB。(填“>”“<”或“=”)(3)、在Mg和Fe、Zn和Fe及Zn和Cu中,A、B两种金属可能是。26. 有一包白色固体样品,可能由硫酸钠、氢氧化销、碳酸钙、氯化钡、氯化镁中的一种或几种物质组成,为探究该样品的组成,某小组取适量样品按下列流程进行实验。
请回答下列问题:
(1)、滤渣a的成分是 , 滤液中溶质的成分除氯化钠还有。(2)、若现象①“滤渣全部溶解”变为“滤渣部分溶解”,其他现象不变,则原样品中不能确定是否存在的物质是。三、实验探究题(本大题共5小题,共42分)
-
27. 根据下列装置图回答问题(装置用代号表示):
 (1)、实验室用双氧水和二氧化锰来制取较纯净的氧气时,可选用的发生和收集装置是;(2)、实验室常用氯化铵固体与碱石灰固体共热来制取氨气,常温下NH3是一种无色、有刺激性气味的气体,密度比空气小,NH3极易溶于水,制取并收集NH3 , 应该从上图中选择的发生和收集装置是;(3)、在医院里给病人输氧时,在氧气钢瓶和病人吸氧器之间连接一个类似右图所示的装置,在装置中盛放大约半瓶蒸馏水,导气管(填“a”或“b”)端连接在供氧气的钢瓶上。28. 图一、图二是某兴趣小组探究金属、酸的化学性质时所做的两组实验。实验结束后、将两组实验试管中的物质分别全部倒入甲、乙两个洁净的烧杯中,据图回答:
(1)、实验室用双氧水和二氧化锰来制取较纯净的氧气时,可选用的发生和收集装置是;(2)、实验室常用氯化铵固体与碱石灰固体共热来制取氨气,常温下NH3是一种无色、有刺激性气味的气体,密度比空气小,NH3极易溶于水,制取并收集NH3 , 应该从上图中选择的发生和收集装置是;(3)、在医院里给病人输氧时,在氧气钢瓶和病人吸氧器之间连接一个类似右图所示的装置,在装置中盛放大约半瓶蒸馏水,导气管(填“a”或“b”)端连接在供氧气的钢瓶上。28. 图一、图二是某兴趣小组探究金属、酸的化学性质时所做的两组实验。实验结束后、将两组实验试管中的物质分别全部倒入甲、乙两个洁净的烧杯中,据图回答: (1)、甲烧杯中的物质完全反应后,发现红色固体物质明显增多。下列说法正确的是____。A、试管②反应后的固体中一定不含铁 B、完全反应后,甲烧杯中的固体一定含有铁 C、完全反应后,甲烧杯的溶液中可能含有Cu2+ D、完全反应后,甲烧杯的溶液中一定含有Mg2+、Fe2+(2)、乙烧杯中的物质充分反应后,仅观察到有白色沉淀,无其他现象。则试管③反应后的溶液中的溶质所有可能组合是(与化学式)。(3)、将乙烧杯内的物质进行过滤,对所得滤液中溶质成分进行了如下探究:
(1)、甲烧杯中的物质完全反应后,发现红色固体物质明显增多。下列说法正确的是____。A、试管②反应后的固体中一定不含铁 B、完全反应后,甲烧杯中的固体一定含有铁 C、完全反应后,甲烧杯的溶液中可能含有Cu2+ D、完全反应后,甲烧杯的溶液中一定含有Mg2+、Fe2+(2)、乙烧杯中的物质充分反应后,仅观察到有白色沉淀,无其他现象。则试管③反应后的溶液中的溶质所有可能组合是(与化学式)。(3)、将乙烧杯内的物质进行过滤,对所得滤液中溶质成分进行了如下探究:实验操作
实验现象
实验结论
步骤1:取少量滤液于试管中,向其中滴加足量硝酸钡溶液
有白色沉淀生成
滤液中的溶质是 ▲
步骤2:静置,向上层清液中滴加无色酚酞溶液
溶液变红
29. 由于大量使用一次性塑料袋造成的“白色污染”,已成为一个严重的社会问题。某化学研究小组同学欲对某种塑料袋的组成成分进行分析探究(资料显示该塑料袋只含 C、H 两种元素),他们设计了如图的实验装置,将该塑料袋试样在纯氧中燃烧,观察实验现象,分析有关数据,推算元素含量。 (1)、A 装置制取的气体,经 B 后通入 C 装置,使塑料试样能充分燃烧。B 装置中盛有足量的某种液体,其作用是 , E 装置中所装液体是。(2)、装置 C 的硬质玻璃试管中塑料试样充分燃烧后,测得装置 D 增重 a g,装置 E 增重bg,则样品中的碳元素的质量分数为(用字母 a、b 表示)。30. 生产生活中,我们经常发现存放不当的铁制品,一段时间后就会生锈的现象。如图是某兴趣小组对铁钉生锈的条件进行探究。
(1)、A 装置制取的气体,经 B 后通入 C 装置,使塑料试样能充分燃烧。B 装置中盛有足量的某种液体,其作用是 , E 装置中所装液体是。(2)、装置 C 的硬质玻璃试管中塑料试样充分燃烧后,测得装置 D 增重 a g,装置 E 增重bg,则样品中的碳元素的质量分数为(用字母 a、b 表示)。30. 生产生活中,我们经常发现存放不当的铁制品,一段时间后就会生锈的现象。如图是某兴趣小组对铁钉生锈的条件进行探究。 (1)、通过观察发现B、C试管中的铁钉都不易生锈,其原因是。(2)、该兴趣小组还发现铁钉生锈需要几天的时间。后查得资料:氯化物可能加快铁钉生锈的速度,为此进行了“氯化物对铁钉生锈有怎样的影响?”的探究实验:
(1)、通过观察发现B、C试管中的铁钉都不易生锈,其原因是。(2)、该兴趣小组还发现铁钉生锈需要几天的时间。后查得资料:氯化物可能加快铁钉生锈的速度,为此进行了“氯化物对铁钉生锈有怎样的影响?”的探究实验:编号
1号试管+铁钉
②号试管+铁钉
③号试管+铁钉
④号试管+铁钉
实验操作
加6mL蒸馏水
加5mL蒸馏水和1mL1%NaCl溶液
加5mL蒸馏水和1mL1%CaCl2溶液
加5mL蒸馏水和1mL1%CuCl2溶液
现象
3天后,铁钉表面出现红色物质
1天后,铁钉表面出现红色物质
1天后,铁钉表面出现红色物质
10分钟时铁钉表面出现红色物质
请结合上述实验回答:
Ⅰ、对比实验①②③可以得到的结论是。
Ⅱ、小组同学又提出了验证试管④中红色物质组成的实验思路:取红色物质和足量稀硫酸反应,如果观察到 , 则红色物质中既有铁锈,又有铜。
31. 在老师指导下,小科做了如下实验:点燃燃烧匙上的钠,迅速伸入盛有CO2的集气瓶中,盖上玻片,钠继续燃烧。反应结束后发现:集气瓶内附着灰白色固体。小科获知灰白色固体中的黑色固体成分是碳,但不清楚其中的白色固体成分是什么,于是进行了如下探究:【提出问题】白色固体的成分是什么?
【建立假设】假设一:白色固体的成分是氧化钠;假设二:白色固体的成分是碳酸钠;假设三:白色固体的成分是氧化钠和碳酸钠的混合物。
(1)、【进行实验】步骤1:取灰白色固体于烧杯中,加入适量的水充分溶解过滤,得到滤液。步骤2:取少量步骤Ⅰ中的滤液于试管中,滴加2滴酚酞试液,溶液变成红色。
【得出结论】白色固体的成分是氧化钠。
有同学认为通过上述实验得出的结论不正确,其理由是。
(2)、【继续实验】步骤3:取少量步骤1中的滤液于试管中,滴加足量稀盐酸,溶液中有气泡冒出,则假设不成立。(3)、步骤4:另取少量步骤2中的溶液于试管中,(写出具体操作及现象),则假设三成立。四、计算题(本大题共5小题,共32分)
-
32. 每年10-11月是橘子丰收的时节,橘子中含有丰富的核黄素即维生素B2(分子式:C17H20N4O6)分子量:376,黄至橙黄色结晶性粉末,微臭,味微苦。核黄素具有热稳定性,不受空气中氧的影响,在酸性溶液中稳定,但在碱性溶液中不稳定,光照射容易分解。(1)、核黄素在物质分类上属于。(选填“氧化物酸碱盐”“有机物”)(2)、一个核黄素分子中共有个原子。(3)、计算94克核黄素中含有克氢元素。33. 取氯酸钾和二氧化锰的混合物31克置于干燥的试管中,加热到质量不再减少为止,冷却后测得剩余固体质量为21.4克。试计算:(1)、能制得氧气多少克?(2)、原混合物中氯酸钾的质量是多少克?34. 某科学兴趣小组同学取一定质量的铁粉,放到含少量硫酸的硫酸铜溶液中,完全反应后,最终得到9.2g固体。为测定所得固体中各成分的含量,同学们将62.5g稀盐酸分五次加入到该固体中,得到数据如下表:
次数
1
2
3
4
5
加入盐酸溶液质量/g
12.5
12.5
12.5
12.5
12.5
剩余固体质量/g
8.5
7.8
a
6.4
6.4
请分析计算:
(1)、表中a的值是。(2)、稀盐酸的溶质质量分数是多少?(要有计算过程)(3)、与硫酸铜反应的铁的质量是多少?(要有计算过程)35. 小敏对实验室用石灰石和稀盐酸制取二氧化碳后的废液,进行溶质成分鉴定。取废液上层清液50g,逐滴加入质量分数为26.5%的碳酸钠溶液,出现气泡,滴加至10g开始出现白色沉淀。继续滴加至沉淀不再产生,过滤,测得沉淀的质量为5g,并绘制了图像。 (1)、废液中含有的溶质是(填化学式)。(2)、通过计算说明,图像中的a点数值是多少?(3)、通过计算说明,图像横坐标中的b点表示的溶液的质量是多少克?36. 工业盐酸常含少量FeCl3而呈黄色,小亮为测定某工业盐酸中HCl的含量进行如下实验:取某盐酸样品50g,滴加溶质质量分数为20%的NaOH溶液,反应产生沉淀的质量与加入的NaOH溶液质量关系如图所示,部分数据见表,请根据表格和图象完成下列问题:
(1)、废液中含有的溶质是(填化学式)。(2)、通过计算说明,图像中的a点数值是多少?(3)、通过计算说明,图像横坐标中的b点表示的溶液的质量是多少克?36. 工业盐酸常含少量FeCl3而呈黄色,小亮为测定某工业盐酸中HCl的含量进行如下实验:取某盐酸样品50g,滴加溶质质量分数为20%的NaOH溶液,反应产生沉淀的质量与加入的NaOH溶液质量关系如图所示,部分数据见表,请根据表格和图象完成下列问题:
加入NaOH溶液的质量/g
25
50
75
100
所得溶液的质量/g
75
100
m
n
(1)、表中m= , n=(2)、求该工业盐酸中HCI的质量分数;(3)、求加入86gNaOH溶液充分反应后所得溶液中的溶质质量。