吉林省长春市南关区2023-2024学年高一上学期10月第一次月考化学试题
试卷更新日期:2023-12-06 类型:月考试卷
一、选择题,本题共20题,1—10每题2分,11-20每题3分,共50分。在每小题给出的四个选项中,只有一个选项符合要求。
-
1. 在天宫课堂,通过实验展示了油水混合物在太空静置后不分层的现象。飞到太空中的油和水( )A、溶解性改变 B、化学性质改变 C、分子结构改变 D、以上三项均没变2. 下列物质中含有自由移动氯离子的是( )A、氯酸钾溶液 B、液态氯化氢 C、固体氯化钠 D、氯化钾溶液3. 化学与生活、社会发展息息相关,下列说法不正确的是( )A、食物的腐烂是发生了氧化还原反应 B、“春蚕到死丝方尽,蜡炬成灰泪始干”诗句中涉及氧化还原反应 C、“熬胆矾铁釜,久之亦化为铜”,该过程发生了复分解反应 D、“霾尘积聚难见路人”,雾霾所形成的气溶胶有丁达尔效应4. 下列化学方程式中,表示电子转移的方向和数目都正确的是( )A、
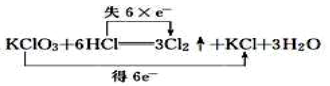 B、
B、 C、
C、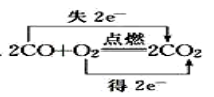 D、
D、 5. 铊(Tl)盐被列为A级危险品。已知下列反应在一定条件下能够发生:①②③。下列离子氧化性比较顺序正确的是( )A、 B、Ag+>Tl3+>Fe3+ C、 D、6. 下列分散系最不稳定是( )A、向NaOH溶液中通入CO2得到的无色溶液 B、向沸水中逐滴滴加FeCl3饱和溶液得到的红褐色液体 C、向CuSO4溶液中加入NaOH溶液得到的分散系 D、向Fe(OH)3固体中加入盐酸得到的棕黄色液体7. 硝酸厂的烟气中含有大量的氮氧化物(NOx),将烟气与H2的混合气体通入Ce(SO4)2与Ce2(SO4)3的混合溶液中实现无害化处理,其转化过程如图所示。下列说法正确的是( )
5. 铊(Tl)盐被列为A级危险品。已知下列反应在一定条件下能够发生:①②③。下列离子氧化性比较顺序正确的是( )A、 B、Ag+>Tl3+>Fe3+ C、 D、6. 下列分散系最不稳定是( )A、向NaOH溶液中通入CO2得到的无色溶液 B、向沸水中逐滴滴加FeCl3饱和溶液得到的红褐色液体 C、向CuSO4溶液中加入NaOH溶液得到的分散系 D、向Fe(OH)3固体中加入盐酸得到的棕黄色液体7. 硝酸厂的烟气中含有大量的氮氧化物(NOx),将烟气与H2的混合气体通入Ce(SO4)2与Ce2(SO4)3的混合溶液中实现无害化处理,其转化过程如图所示。下列说法正确的是( ) A、过程Ⅰ发生反应的离子方程式:H2+Ce4+=2H++Ce3+ B、该转化过程的实质为NOx被H2还原 C、时,过程Ⅱ中氧化剂与还原剂的个数之比为2:1 D、处理过程中,混合溶液中Ce3+和Ce4+总数减少8. “混盐”是指一种金属离子与多种酸根离子构成的盐,如氯化硝酸钙[Ca(NO3)Cl]就是一种混盐。“复盐”是指含有多种简单阳离子和一种酸根阴离子的盐如KAl(SO4)2 , 下列各化合物中属于混盐的是( )A、Ag(NH3)2OH B、(NH4)2Fe(SO4)2 C、Cu2(PO4)Cl D、K3[Fe(CN)6]9. 在碱性溶液中能大量共存且溶液为无色透明的离子组是( )A、K+、MnO 、Na+、Cl- B、K+、Na+、NO 、CO C、Na+、HCO 、NO 、SO D、Fe3+、Na+、Cl-、SO10. 向一定体积的Ba(OH)2溶液中逐滴加入稀硫酸,测得混合溶液的导电能力随时间变化的曲线如图所示,下列说法正确的是( )
A、过程Ⅰ发生反应的离子方程式:H2+Ce4+=2H++Ce3+ B、该转化过程的实质为NOx被H2还原 C、时,过程Ⅱ中氧化剂与还原剂的个数之比为2:1 D、处理过程中,混合溶液中Ce3+和Ce4+总数减少8. “混盐”是指一种金属离子与多种酸根离子构成的盐,如氯化硝酸钙[Ca(NO3)Cl]就是一种混盐。“复盐”是指含有多种简单阳离子和一种酸根阴离子的盐如KAl(SO4)2 , 下列各化合物中属于混盐的是( )A、Ag(NH3)2OH B、(NH4)2Fe(SO4)2 C、Cu2(PO4)Cl D、K3[Fe(CN)6]9. 在碱性溶液中能大量共存且溶液为无色透明的离子组是( )A、K+、MnO 、Na+、Cl- B、K+、Na+、NO 、CO C、Na+、HCO 、NO 、SO D、Fe3+、Na+、Cl-、SO10. 向一定体积的Ba(OH)2溶液中逐滴加入稀硫酸,测得混合溶液的导电能力随时间变化的曲线如图所示,下列说法正确的是( )
①XY段溶液的导电能力不断减弱,说明生成的BaSO4不是电解质
②YZ段溶液的导电能力不断增大,主要是由于过量的Ba(OH)2电离出的离子导电
③Y处溶液的导电能力约为0,说明溶液中几乎没有自由移动的离子
④a时刻Ba(OH)2溶液与稀硫酸恰好完全中和
A、①② B、①③ C、②④ D、③④11. 已知溶液与NaCl溶液混合无现象,溶液与盐酸混合可发生反应: , 下列说法不正确的是( )A、反应中氧化剂是NaClO3 B、反应中每生成1个Cl2 , 转移2个电子 C、向和NaCl混合溶液中滴加稀硫酸也能生成 D、反应可以发生12. 已知反应:①Cl2+2KBr=2KCl+Br2;②KClO3+6HCl=3Cl2↑+KCl+3H2O;③2KBrO3+Cl2=Br2+2KClO3。下列说法正确的是( )A、上述三个反应都有单质生成,所以都是置换反应 B、氧化性由强到弱的顺序为KClO3>KBrO3>Cl2>Br2 C、反应②中还原剂与氧化剂的物质的量之比为6∶1 D、根据题中所得信息,HCl和HBr共存的溶液中加入PbO2 , HBr先发生反应13. 下列离子方程式书写正确的是( )A、CH3COOH与钠反应:CH3COOH+Na=CH3COO-+Na++H2↑ B、向澄清石灰水中通入过量二氧化碳:Ca2++2OH-+CO2=CaCO3↓+H2O C、Cl2通入FeBr2溶液中,Cl2与FeBr2个数比4︰5:10Fe2++6Br-+8Cl2=10Fe3++3Br2+16Cl- D、(NH4)2Fe(SO4)2溶液与过量NaOH溶液反应制Fe(OH)2:Fe2++2OH-=Fe(OH)2↓14. 一定量的Cl2与NaOH溶液反应,所得产物中含NaClO和NaClO3之比为3∶5,则参加反应的Cl2与NaOH之比为( )A、8∶11 B、1∶2 C、3∶5 D、18∶815. 能够在人体血管中通行的药物分子运输车-“纳米药物分子运输车”在中国科学院上海硅酸盐研究所研制成功,该“运输车”可提高肿瘤的治疗效果,其结构如图所示。下列有关说法正确的是( )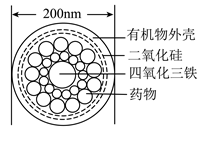 A、该“运输车”中四氧化三铁是碱性氧化物 B、该“运输车”的外壳一定含有碳元素 C、该“运输车”分散于水中所得的分散系属于胶体 D、二氧化硅不属于酸性氧化物16. 下列有关物质的分类与性质的说法正确的是( )A、冰醋酸属于纯净物 B、SO3、NO2均属于酸性氧化物 C、已知:H3RO2+NaOH(足量)=NaH2RO2+H2O,则H3RO2为三元酸,NaH2RO2为酸式盐 D、金属铜能导电,但它不是电解质,是非电解质17. 下列离子方程式书写正确的是( )A、H2S的电离:H2S2H+ + 2S 2 - B、NaHCO3在水溶液中的电离:HCO3−+ H2O H2 CO3+ OH− C、氢氧化钡溶液和足量碳酸氢钠溶液混合:Ba2+ + 2HCO3− + 2OH− = BaCO3↓+ 2H2O + CO32- D、AgCl的电离:AgCl Ag+ + Cl−18. 实验室分别进行如下实验:①向蓝色的VOSO4溶液中滴加酸性KMnO4溶液,溶液由蓝色变为淡黄色();②向(VO2)2SO4溶液中滴加浓盐酸,产生黄绿色气体,溶液变蓝。下列说法正确的是( )A、①中还原剂与氧化剂物质的量之比为1∶5 B、由①②可知,酸性条件下氧化性: C、②中每生成1分子气体,转移2个电子 D、向(VO2)2SO4溶液中滴加FeI2溶液发生反应19. NaCl溶于水,溶解过程如图所示。下列说法不正确的是( )
A、该“运输车”中四氧化三铁是碱性氧化物 B、该“运输车”的外壳一定含有碳元素 C、该“运输车”分散于水中所得的分散系属于胶体 D、二氧化硅不属于酸性氧化物16. 下列有关物质的分类与性质的说法正确的是( )A、冰醋酸属于纯净物 B、SO3、NO2均属于酸性氧化物 C、已知:H3RO2+NaOH(足量)=NaH2RO2+H2O,则H3RO2为三元酸,NaH2RO2为酸式盐 D、金属铜能导电,但它不是电解质,是非电解质17. 下列离子方程式书写正确的是( )A、H2S的电离:H2S2H+ + 2S 2 - B、NaHCO3在水溶液中的电离:HCO3−+ H2O H2 CO3+ OH− C、氢氧化钡溶液和足量碳酸氢钠溶液混合:Ba2+ + 2HCO3− + 2OH− = BaCO3↓+ 2H2O + CO32- D、AgCl的电离:AgCl Ag+ + Cl−18. 实验室分别进行如下实验:①向蓝色的VOSO4溶液中滴加酸性KMnO4溶液,溶液由蓝色变为淡黄色();②向(VO2)2SO4溶液中滴加浓盐酸,产生黄绿色气体,溶液变蓝。下列说法正确的是( )A、①中还原剂与氧化剂物质的量之比为1∶5 B、由①②可知,酸性条件下氧化性: C、②中每生成1分子气体,转移2个电子 D、向(VO2)2SO4溶液中滴加FeI2溶液发生反应19. NaCl溶于水,溶解过程如图所示。下列说法不正确的是( ) A、NaCl固体不导电 B、a离子为Na+ , b离子为Cl− C、NaCl溶液导电的原因是溶液中有自由移动的离子 D、NaCl在水分子的作用下,形成自由移动的水合钠离子和水合氯离子20. 下列说法中正确的是( )
A、NaCl固体不导电 B、a离子为Na+ , b离子为Cl− C、NaCl溶液导电的原因是溶液中有自由移动的离子 D、NaCl在水分子的作用下,形成自由移动的水合钠离子和水合氯离子20. 下列说法中正确的是( )①酸性氧化物在一定条件下均能与碱发生反应
②金属氧化物不一定都是碱性氧化物,但碱性氧化物一定都是金属氧化物
③蔗糖和水分别属于非电解质和电解质
④硫酸、纯碱、醋酸钠和生石灰分别属于酸、碱、盐和氧化物
⑤因为胶粒比溶液中溶质粒子大,所以胶体可以用过滤的方法把胶粒分离出来
⑥氢氧化铁胶体稳定存在的主要原因是胶粒直径介于1nm到100nm之间
A、2个 B、3个 C、4个 D、5个二、填空题本题共四道大题,每空2分,共50分。
-
21.(1)、Ⅰ.现有以下物质:①小苏打 ②盐酸 ③H2SO4 ④氨水 ⑤熔融KOH ⑥NH3 ⑦CCl4 ⑧CO2 ⑨冰醋酸 ⑩NaHSO4固体
上述物质中,属于电解质但不导电的是。(2)、上述物质中,属于弱电解质的是。(3)、写出⑨、⑩在水溶液中的电离方程式。⑨:。
⑩:。
(4)、Ⅱ.书写下列反应的离子方程式。①氨水与硫酸溶液混合:;
②Ca(HCO3)2与少量KOH溶液混合:;
③NaOH溶液和NaHSO4溶液混合:.
22.(1)、Ⅰ.一种无色透明溶液中含有下列离子中的某些离子:K+、Mg2+、Fe3+、Ba2+、SO、OH-、CO和Cl- , 溶液中各离子的个数相同。取该溶液进行如下实验:①.取少量原溶液滴入紫色石蕊试液,溶液呈蓝色。
②.取少许原溶液滴入溶液,无白色沉淀产生。
③.取少许原溶液先滴加硝酸再加溶液,产生白色沉淀。
④.再取少许原溶液滴入少量溶液,有白色沉淀产生。
根据以上现象判断,原溶液中肯定不存在的离子是;肯定存在的离子是。(2)、向原溶液中加入氯化镁溶液,发生反应的离子方程式为。(3)、Ⅱ.某无色溶液由Ba2+、Cu2+、Na+、Cl-、CO、SO离子中的几种离子构成,取一定量的样品进行实验:①加入足量BaCl2溶液,过滤后得到5克白色沉淀:
②在沉淀中加入过量稀硝酸,仍有3克白色沉淀;
③在滤液中滴加AgNO3溶液,产生白色沉淀。
实验①得到的白色沉淀为 , 则该溶液中一定含有。
23. 氧化还原反应在物质的制备和转化中有重要的应用。(1)、碘酸钾(KIO3)是一种重要的食品添加剂,可作为食盐中的补碘剂。一种制备KIO3的方法是将I2与KOH溶液共热,生成KIO3、H2O和另一种化合物。①写出该反应的化学方程式:。
②该反应中被氧化的I原子与被还原的I原子的个数之比为。
③每生成2个KIO3 , 该反应中转移电子个。
(2)、碘酸钾在酸性环境下可以与亚硫酸钠反应制备碘单质,配平下面的氧化还原方程式:Na2SO3+ KIO3+ H2SO4 = Na2SO4+ K2SO4+ I2+H2O。
(3)、KClO3和浓盐酸在一定温度下反应会生成黄绿色的易爆物二氧化氯。其变化可表述为2KClO3+4HCl(浓)=2KCl+2ClO2↑+Cl2↑+2H2O。
①请分析该反应中电子转移的情况(用双线桥表示)。
②浓盐酸在反应中显示出来的性质是 。
③ClO2具有很强的氧化性,因此常被用作消毒剂,其消毒的效率(以单位质量得到的电子数表示)是Cl2的倍。(提示:ClO2与Cl2消毒时氯元素都被还原为最低价)
24. 实验证明,胶体的凝聚能力主要取决于与胶粒带相反电荷的离子所带的电荷数,电荷数越大,凝聚能力越大。(1)、已知Fe(OH)3胶体粒子带正电,则 向Fe(OH)3胶体中加入下列电解质时,其凝聚能力最强的为①NaCl ②FeCl3 ③K2SO4 ④Na3PO4
(2)、为了把黏土溶胶(黏土胶体粒子带负电荷)变成较洁净的水,加入下列电解质时,____(填字母)效果最明显。A、BaCl2 B、Al2(SO4)3 C、KCl D、CuSO4(3)、将少量FeCl3饱和溶液分别滴加到下列物质中,得到三种分散系,完成相关问题:甲:将FeCl3饱和溶液滴加到冷水中;
乙:将FeCl3饱和溶液滴加到NaOH溶液中;
丙:将FeCl3饱和溶液滴加到沸水中,继续加热煮沸得到红褐色透明液体。
①丙中反应的化学方程式为。
②向经过检验后的丙中逐滴加入稀盐酸,出现的现象为
③向丙中插入电极后通电,Fe(OH)3胶粒移向(填“与电源负极相连”或“与电源正极相连”)的一极。
④可用如图所示的装置除去Fe(OH)3胶体中的杂质离子来提纯Fe(OH)3胶体,实验过程中需不断更换烧杯中的蒸馏水。该方法名称为。
