广东省深圳市龙岗区2023-2024学年高二上学期期中考试化学试题
试卷更新日期:2023-12-05 类型:期中考试
一、选择题:本题共10小题,每小题2分,共20分。在每小题给出的四个选项中,只有一项符合题目要求。
-
1. 下列反应中,反应物键能大于生成物键能的是( )A、锌粒与稀盐酸反应 B、与NH4Cl反应 C、酸碱中和反应 D、甲烷在O2中燃烧2. 下列热化学反应方程式书写正确的是(的绝对值均正确)( )A、 (燃烧热) B、 (中和热) C、 (反应热) D、 (反应热)3. 在5L的密闭容器中进行反应 , 10s后,SO3的物质的量增加了0.3mol。下列叙述正确的是( )A、 B、 C、当容器内气体密度不再变化时,反应达到平衡 D、当容器内SO3的消耗速率等于SO2的生成速率,反应达到平衡4. 下列实验不能达到目的的是( )
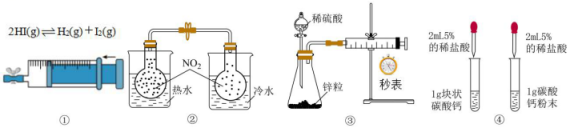 A、图①:探究压强对化学平衡的影响 B、图②:探究温度对化学平衡的影响 C、图③:测定锌与稀硫酸反应的反应速率 D、图④:探究反应物的接触面积对反应速率的影响5. 在一定温度下,下列叙述不是可逆反应达到平衡的标志的是( )
A、图①:探究压强对化学平衡的影响 B、图②:探究温度对化学平衡的影响 C、图③:测定锌与稀硫酸反应的反应速率 D、图④:探究反应物的接触面积对反应速率的影响5. 在一定温度下,下列叙述不是可逆反应达到平衡的标志的是( )①C的生成速率与C的分解速率相等;
②单位时间内生成a mol A,同时生成3a mol B;
③A、B、C的浓度不再变化;
④A、B、C的体积分数不再变化;
⑤混合气体的总压强不再变化;
⑥混合气体的物质的量不再变化;
⑦单位时间内消耗a mol A,同时生成3a mol B;
⑧A、B、C、D的分子数之比为1:3:2:2。
A、②⑧ B、②⑤⑧ C、①③④⑦ D、②⑤⑥⑧6. 下列事实能用勒夏特列原理解释的是( )A、工业上SO2催化氧化为SO3 , 采用常压而不是高压 B、由NO2和N2O4组成的平衡体系: , 恒温缩小容积,气体颜色变深 C、 , 工业上将钾蒸气从反应混合体系中分离出来,以制备金属钾 D、500℃高温比室温更有利于合成氨的反应7. 已知反应①和反应②在T℃时的平衡常数分别为K1和K2 , 该温度下反应③的平衡常数为K3。则下列说法正确的是( )A、反应①的平衡常数 B、反应②中,增大氢气浓度,平衡时其体积分数增大 C、对于反应③,CO和H2O的转化率一定相等 D、T℃时,8. 下列各可逆反应达平衡后,改变反应条件,其变化趋势正确的是( )A、 B、
B、 C、
C、 D、
D、 9. 已知: , 不同条件下反应进程的能量变化如图所示。下列说法正确的是能量( )
9. 已知: , 不同条件下反应进程的能量变化如图所示。下列说法正确的是能量( ) A、该反应达平衡时,升高温度,v(正)增大,v(逆)减小,平衡逆向移动 B、过程b使用了催化剂,使反应的减小 C、由可知,该反应低温能自发进行 D、恒温恒容条件下通入氦气,可使单位体积内O2的活化分子数增大10. 下列事实中一定能证明CH3COOH是弱电解质的是( )
A、该反应达平衡时,升高温度,v(正)增大,v(逆)减小,平衡逆向移动 B、过程b使用了催化剂,使反应的减小 C、由可知,该反应低温能自发进行 D、恒温恒容条件下通入氦气,可使单位体积内O2的活化分子数增大10. 下列事实中一定能证明CH3COOH是弱电解质的是( )①用CH3COOH溶液做导电实验,灯泡很暗
②溶液中
③往NaHCO3溶液中滴加CH3COOH溶液,产生大量气泡
④溶液恰好与溶液完全反应
⑤1 mL 的CH3COOH溶液稀释至1L,
A、②⑤ B、②③ C、①② D、③④二、选择题:本题共6小题,每小题4分,共24分。在每小题给出的四个选项中,只有一项是符合题目要求的。
-
11. 根据以下热化学方程式,和的大小比较不正确的是( )A、; , 则 B、; , 则 C、; , 则 D、; , 则12. 标准状况下,气态反应物和生成物的相对能量与反应历程示意图如下[已知和的相对能量为0],下列说法错误的是( )
 A、 B、相同条件下,O3的平衡转化率:历程Ⅱ>历程Ⅰ C、可计算Cl—Cl键能为 D、历程Ⅰ、历程Ⅱ中速率最快的一步反应的热化学方程式为:13. 温度为T时,向2.0L恒容密闭容器中充入1.0 mol PCl5 , 反应经过一段时间后达到平衡。反应过程中测定的部分数据见下表:
A、 B、相同条件下,O3的平衡转化率:历程Ⅱ>历程Ⅰ C、可计算Cl—Cl键能为 D、历程Ⅰ、历程Ⅱ中速率最快的一步反应的热化学方程式为:13. 温度为T时,向2.0L恒容密闭容器中充入1.0 mol PCl5 , 反应经过一段时间后达到平衡。反应过程中测定的部分数据见下表:t/s
0
50
150
250
350
0
0.16
0.19
0.20
0.20
下列说法正确的是( )
A、反应在前50s的平均速率 B、保持其他条件不变,升高温度,平衡时 , 则反应的 C、相同温度下,起始时向容器中充入1.0 mol PCl5、0.20 mol PCl3和0.20 mol Cl2 , 反应达到平衡前v(正)>v(逆) D、相同温度下,起始时向容器中充入2.0 mol PCl3和2.0 mol Cl2 , 达到平衡时,PCl3的转化率小于80%14. 某温度下,HNO2和CH3COOH的电离常数分别为:和。将pH和体积均相同的两种酸溶液分别稀释,其pH随加水体积的变化如图所示。下列叙述正确的是( ) A、曲线Ⅰ代表HNO2溶液 B、两种溶液中加入足量镁条充分反应后,产生氢气体积相同 C、溶液中溶质的电离程度:c点>d点 D、溶液的导电能力:b点>c点>d点15. “千畦细浪舞晴空”,氮肥保障了现代农业的丰收。为探究的离子键强弱,设计如图所示的循环过程,可得为( )
A、曲线Ⅰ代表HNO2溶液 B、两种溶液中加入足量镁条充分反应后,产生氢气体积相同 C、溶液中溶质的电离程度:c点>d点 D、溶液的导电能力:b点>c点>d点15. “千畦细浪舞晴空”,氮肥保障了现代农业的丰收。为探究的离子键强弱,设计如图所示的循环过程,可得为( ) A、+533 B、+686 C、+838 D、+114316. 部分弱电解质的电离常数如下表:
A、+533 B、+686 C、+838 D、+114316. 部分弱电解质的电离常数如下表:弱电解质
HCOOH
HCN
H2CO3
电离常数(25℃)
下列说法错误的是( )
A、根据电离常数,可判断酸性HCOOH>H2CO3>HCN B、可能发生反应 C、0.1 mol/L HCN溶液中存在平衡: , 加水可使溶液中变大 D、25℃时,反应的化学平衡常数约为三、非选择题:本题共4小题,共56分。
-
17. 食醋是烹饪美食的调味品,有效成分主要为醋酸(CH3COOH也可用HAc表示)。CH3COOH的应用与其电离平衡密切相关。(1)、某小组研究25℃下CH3COOH电离平衡的影响因素。
提出假设:稀释CH3COOH溶液或改变浓度,HAc电离平衡会发生移动。
设计方案并完成实验:
用浓度均为的CH3COOH和CH3COONa溶液,按下表配制总体积相同的系列溶液;测定 , 记录数据(表格中CH3COOH和CH3COONa分别用HAc和NaAc表示)。
序号
Ⅰ
40.00
/
/
0
Ⅱ
4.00
/
36.00
0
…
Ⅶ
4.00
a
33.00
3:4
Ⅷ
4.00
4.00
b
1:1
①根据表中信息,补充数据:a= , b=。
②由实验Ⅰ和Ⅱ可知,稀释CH3COOH溶液,电离平衡(填“正”或“逆”)向移动。
③由实验Ⅱ-Ⅷ可知,增大浓度,CH3COOH电离平衡逆向移动。
实验结论假设成立。
(2)、下列方法中可以使的CH3COOH电离程度增大的是____(填字母)。A、加入少量的稀盐酸 B、加热该CH3COOH溶液 C、加入少量冰醋酸 D、加水稀释至 E、加入少量氯化钠晶体 F、加入少量的NaOH溶液(3)、某化学实验小组欲测定反应的热效应,设计如下实验。实验装置:

室温/℃
20.0
20.0
20.0
ΔT/℃
0.70
0.69
0.71
实验步骤:
在装有温度计和仪器X的烧杯中先加入已恒定为室温的0.1 mol⋅L-1 NaOH溶液100mL,使用仪器X搅拌,待温度计数字稳定读数后,迅速加入0.1 mol⋅L-1 CH3COOH溶液100mL。密切关注温度变化,将最高温度记为反应后体系的温度,计算出溶液上升的温度ΔT。重复上述操作3次,记录实验数据如上表所示:
已知:反应Ⅰ.
反应Ⅱ.
本实验条件下,混合溶液的密度和比热容分别按照1 g/mL和进行计算。
回答下列问题:
①本实验重复进行三次的目的为。
②由题给数据计算可知反应Ⅰ的。
③反应的热效应(用符号ΔH1和ΔH2表示)。
18. 重铬酸钾(K2Cr2O7)又名红矾钾,是化学实验室中的一种重要分析试剂,在工业上用途广泛。已知K2Cr2O7溶液中存在平衡:请回答下列问题:
(1)、K2Cr2O7溶液中反应平衡常数的表达式为。(2)、复分解法制备重铬酸钾以Na2CrO4溶液为原料,步骤如下:
①先向Na2CrO4溶液中加入酸调节溶液pH,其目的是。
②再向①的溶液中加入适量KCl,搅拌溶解、蒸发浓缩、冷却结晶,抽滤得到K2Cr2O7粗产品。则相同温度时的溶解度:Na2Cr2O7K2Cr2O7(填“>”“<”或“=”)。
(3)、K2Cr2O7溶液中存在的平衡又可分解为以下两步:(ⅰ)
(ⅱ)

①下列有关K2Cr2O7溶液的说法正确的有。
A.加入少量硫酸,溶液颜色由橙色向黄色转变
B.加入少量水稀释,溶液中离子总数增加
C.加入少量NaOH溶液,反应(ⅰ)的平衡逆向移动
D.加入少量K2Cr2O7固体,平衡时与的比值保持不变
②在0.10 mol⋅L-1 K2Cr2O7溶液中设、、的平衡浓度分别为x、y、z mol·L-1 , 则x、y、z之间的关系式为=0.10。
③已知在稀溶液中,一种物质对光的吸收程度(A)与其所吸收光的波长(λ)有关;在一定波长范围内,最大A对应的波长()取决于物质的结构特征;浓度越高,A越大。混合溶液在某一波长的A是各组分吸收程度之和。为研究对反应(ⅰ)和(ⅱ)平衡的影响,配制浓度相同、pH不同的K2Cr2O7稀溶液,测得其A随λ的变化曲线如右上图所示,波长λ1、λ2和λ3中,与的最接近的是;溶液pH从a变到b的过程中,的值(填“增大”“减小”或“不变”)。
19. 已知 , 常温下N2O4为无色气体。(1)、某课外活动小组为了探究压强对化学平衡的影响,设计了相关实验,请根据所学知识预测实验结果:在容积为30cm3针筒中抽入10cm3的NO2气体,将针筒前端封闭,静置一段时间至气体颜色不变。将针筒活塞拉至20cm3处,此时气体的颜色(填“变深”、“变浅”或“不变”),一段时间后气体颜色(填“变深”、“变浅”或“不变”),但仍比拉动活塞之前针筒内气体的颜色(填“深”或“浅”)。在此过程中,该反应的化学平衡常数(填“增大”、“减小”或“不变”),混合气体中NO2的百分含量(填“增大”、“减小”或“不变”)。
(2)、利用现代手持技术传感器可以探究压强对该平衡的影响。在恒定温度和标准压强条件下,往针筒中充入一定体积的NO2气体后密封并保持活塞位置不变。分别在t1、t2时迅速移动活塞后并保持活塞位置不变,测定针筒内气体压强变化如图所示。

①有关该过程说法正确的是。
a.E、H两点对应的NO2的体积分数较大的为E点
b.B向里快速推注射器活塞,E向外快速拉注射器活塞
c.B、C、D三点正反应速率最大的是B点
d.C点时体系的颜色比D点深
②反应至B点时NO2的转化率为。
③图像中C、E两点气体平均摩尔质量较大的点为(填代号)。
(3)、某温度下,在体积恒为1 L的密闭容器内,起始时只加入1 mol NO2 , 达到平衡时其转化率为75%,则该温度下反应的平衡常数L⋅mol-1。20. 自从1909年化学家哈伯研究出合成氨的方法以来,氮的化合物在生产生活中有着广泛应用,与此有关的研究已经获得三次诺贝尔化学奖。目前气态含氮化合物及相关转化仍然是科学家研究的热门问题。请回答下列问题:(1)、①合成氨的原料气H2可以通过天然气和二氧化碳转化制备,已知CH4、H2和CO的燃烧热(ΔH)分别为 , , 则通过天然气和二氧化碳转化制备H2的热化学反应方程式为。②673K时,合成氨反应机理中各步反应的能量变化如图所示,其中吸附在催化剂表面上的粒子用“*”标注。
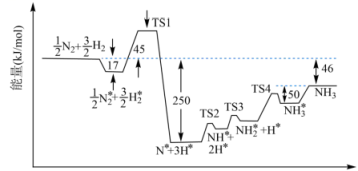
图中决速步骤的反应方程式为。
(2)、用NH3催化还原NO,可以消除氮氧化物的污染。已知:①
②
写出NH3还原NO至N2和水蒸气的热化学方程式。
(3)、活性炭还原法是消除氮氧化物污染的有效方法,其原理为:。已知该反应的正、逆反应速率方程分别为、 , 其中、分别为正、逆反应速率常数,变化曲线如左下图所示,则该反应的反应热O(填“>”、“<”或“=”),写出推理过程
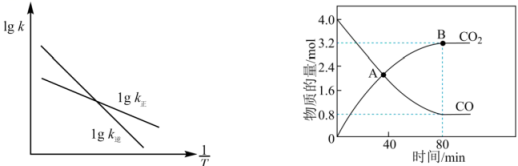 (4)、一定温度下,在体积为2L的恒容密闭容器中加入和发生反应 , 测得和的物质的量随时间的变化如右上图所示:
(4)、一定温度下,在体积为2L的恒容密闭容器中加入和发生反应 , 测得和的物质的量随时间的变化如右上图所示:①在A点时,N2O的生成速率N2的生成速率(填“>”、“<”或“=”)。
②若平衡时总压强为p kPa,用平衡分压代替其平衡浓度表示的化学平衡常数(平衡分压=总压×物质的量分数)。