广东省汕头市潮阳区2023-2024学年高三上学期期中考试化学试卷
试卷更新日期:2023-12-05 类型:期中考试
一、单选题:本题共16小题,共44分。第1~10小题,每小题2分;第11~16小题,每小题4分。
-
1. 下列广东工艺品主要由有机高分子材料制成的是( )
选项
A
B
C
D
工艺品




名称
光彩烧瓷
广州玉雕
佛山丝绸“香云纱”
潮汕铜镜
A、A B、B C、C D、D2. 化学之美无处不在。下列说法正确的是( )A、H2在Cl2中安静燃烧发出苍白色火焰,瓶口产生白雾 B、春节绚丽多彩的烟花,是电子由基态跃迁到激发态时,能量以光的形式释放出来 C、呈现规则多面体外形的天然金刚石为分子晶体 D、葡萄糖分子中含有的羟基能与银氨溶液反应产生光亮的银镜3. 劳动光荣,创造伟大。下列劳动项目与化学知识没有对应关系的是( )选项
劳动项目
化学知识
A
研究性学习活动:焊接两根铁棒
铝粉与氧化铁发生的铝热反应
B
学农活动:用 NH4HCO3肥料施肥
NH4HCO3受热易分解
C
军训实践课:用镁条制造信号弹和焰火
镁条燃烧时发出耀眼白光
D
艺术品制作:制作各种形状的石膏模型
熟石膏与水混合成糊状后能很快凝固
A、A B、B C、C D、D4. 工业合成尿素的原理:。有关化学用语表示正确的是( )A、中子数为8的碳原子: B、的VSEPR模型名称:三角锥形 C、的结构简式: D、基态氧原子的核外电子轨道表示式:
D、基态氧原子的核外电子轨道表示式: 5. 芬顿法常用于废水的处理,反应为:NH4OCN+3H2O2=N2↑+CO2↑+5H2O,设NA为阿伏加德罗常数,下列有关说法不正确的是( )A、H2O2存在极性共价键和非极性共价键 B、标准状况下,22.4LCO2中含有σ键数目为2NA C、18gH2O中含有中子数目为8NA D、1molNH4OCN参与反应时转移电子数为3NA6. “宏观辨识与微观探析”是化学学科核心素养之一,能正确表示下列反应的离子方程式是( )A、用过量氨水吸收工业尾气中的SO2: B、氢氧化亚铁溶液中加入足量的稀硝酸: C、泡沫灭火器原理的离子方程式: D、FeCl3溶液蚀刻铜电路板:7. 奥司他韦是目前治疗甲型流感的常用药物。其结构如图所示,下列有关奥司他韦的说法错误的是( )
5. 芬顿法常用于废水的处理,反应为:NH4OCN+3H2O2=N2↑+CO2↑+5H2O,设NA为阿伏加德罗常数,下列有关说法不正确的是( )A、H2O2存在极性共价键和非极性共价键 B、标准状况下,22.4LCO2中含有σ键数目为2NA C、18gH2O中含有中子数目为8NA D、1molNH4OCN参与反应时转移电子数为3NA6. “宏观辨识与微观探析”是化学学科核心素养之一,能正确表示下列反应的离子方程式是( )A、用过量氨水吸收工业尾气中的SO2: B、氢氧化亚铁溶液中加入足量的稀硝酸: C、泡沫灭火器原理的离子方程式: D、FeCl3溶液蚀刻铜电路板:7. 奥司他韦是目前治疗甲型流感的常用药物。其结构如图所示,下列有关奥司他韦的说法错误的是( )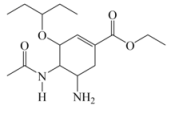 A、难溶于水 B、分子式为C16H27N2O4 C、可发生加成反应、水解反应、氧化反应 D、分子中满足sp3杂化轨道类型的原子对应的元素有3种8. 就被应用于葡萄酒的保鲜、灭菌和抗氧化。下列关于的实验室制备、干燥、收集及尾气处理实验操作,能达到实验目的的是( )
A、难溶于水 B、分子式为C16H27N2O4 C、可发生加成反应、水解反应、氧化反应 D、分子中满足sp3杂化轨道类型的原子对应的元素有3种8. 就被应用于葡萄酒的保鲜、灭菌和抗氧化。下列关于的实验室制备、干燥、收集及尾气处理实验操作,能达到实验目的的是( ) A、制备 B、干燥 C、收集 D、尾气处理9. 物质的类别和核心元素的化合价是研究物质性质的两个重要维度。如图为某元素及其部分化合物的价态-类别图。其中正盐g与NaOH反应可生成f,d的相对分子质量比c大16.下列说法正确的是( )
A、制备 B、干燥 C、收集 D、尾气处理9. 物质的类别和核心元素的化合价是研究物质性质的两个重要维度。如图为某元素及其部分化合物的价态-类别图。其中正盐g与NaOH反应可生成f,d的相对分子质量比c大16.下列说法正确的是( ) A、f可经催化氧化生成d B、c为红棕色,可转化为d C、b的溶液与Cu反应可生成d或c D、实验室制备f时,是将e与H2在一定条件下反应进行制取的10. 我国科学家在寻找“点击反应”的砌块过程中,发现一种新的化合物,结构如下图所示,其中X、Y、Z和W是原子序数依次增大的短周期主族元素,Y与Z是同一主族元素。下列说法正确的是( )
A、f可经催化氧化生成d B、c为红棕色,可转化为d C、b的溶液与Cu反应可生成d或c D、实验室制备f时,是将e与H2在一定条件下反应进行制取的10. 我国科学家在寻找“点击反应”的砌块过程中,发现一种新的化合物,结构如下图所示,其中X、Y、Z和W是原子序数依次增大的短周期主族元素,Y与Z是同一主族元素。下列说法正确的是( ) A、简单离子半径:W>Z>Y>X B、X+采用的是sp杂化方式成键 C、X、Z、W氧化物的水化物均为强酸 D、X、Y、Z和W形成的简单氢化物中,X沸点最高11. 下列实验方案中,能达到实验目的的是( )
A、简单离子半径:W>Z>Y>X B、X+采用的是sp杂化方式成键 C、X、Z、W氧化物的水化物均为强酸 D、X、Y、Z和W形成的简单氢化物中,X沸点最高11. 下列实验方案中,能达到实验目的的是( )选项
实验方案
实验目的
A
将SO2和CO2分别通入水中达到饱和,用pH计立即测定溶液的pH,比较pH大小
确定亚硫酸和碳酸的酸性强弱
B
向反应后试管中加入水观察溶液变蓝色
验证Cu和浓硫酸反应生成CuSO4
C
将SO2通入NaHCO3溶液后,将混合气体依次通入酸性KMnO4溶液、品红溶液、澄清石灰水
验证非金属性:S>C
D
向盛有1mL0.1mol•L-1NaCl溶液的试管中滴加5滴0.1mol•L-1AgNO3溶液,有白色沉淀生成,向其中继续滴加5滴0.1mol•L-1KI溶液,有黄色沉淀产生
验证:Ksp(AgI)<Ksp(AgCl)
A、A B、B C、C D、D12. 根据下列图示得出的结论正确的是( ) A、由图1可判断该反应的反应物中化学键的总键能大于生成物中化学键的总键能 B、图2装置能制备并能较长时间观察其颜色 C、图3装置中电流表指针发生明显偏转 D、由图4可证明图示条件下13. 在Fe2O3的催化作用下,向200℃的恒温恒容密闭容器中充入1molCH4和2molNO2 , 发生反应CH4(g)+2NO2(g) ⇌CO2(g)+N2(g)+2H2O(g),反应过程及能量变化示意图如图所示。下列说法正确的是( )
A、由图1可判断该反应的反应物中化学键的总键能大于生成物中化学键的总键能 B、图2装置能制备并能较长时间观察其颜色 C、图3装置中电流表指针发生明显偏转 D、由图4可证明图示条件下13. 在Fe2O3的催化作用下,向200℃的恒温恒容密闭容器中充入1molCH4和2molNO2 , 发生反应CH4(g)+2NO2(g) ⇌CO2(g)+N2(g)+2H2O(g),反应过程及能量变化示意图如图所示。下列说法正确的是( ) A、容器内气体的平均相对分子质量不再发生变化时,该反应达到平衡状态 B、反应一段时间后(未达平衡),Fe3O4会远远多于Fe2O3 C、起始条件相同,其他条件不变,仅改为绝热密闭容器,CH4和NO2的转化率增大 D、使用更高效的催化剂能提高该反应平衡时的转化率14. 实验I浑浊不消失,实验Ⅱ和Ⅲ中浊液变澄清。
A、容器内气体的平均相对分子质量不再发生变化时,该反应达到平衡状态 B、反应一段时间后(未达平衡),Fe3O4会远远多于Fe2O3 C、起始条件相同,其他条件不变,仅改为绝热密闭容器,CH4和NO2的转化率增大 D、使用更高效的催化剂能提高该反应平衡时的转化率14. 实验I浑浊不消失,实验Ⅱ和Ⅲ中浊液变澄清。
下列分析不正确的是( )
A、NaHCO3浊液中: B、实验Ⅱ中NH4Cl溶液抑制了HCO3-的水解 C、实验Ⅲ中发生了反应: D、以上实验说明NaHCO3溶液中HCO3-既存在电离平衡又存在水解平衡15. 为维护国家安全和利益,经国务院批准,决定对镓、锗相关物项实施出口管制。镓的某种化合物的晶胞结构如下图所示(晶胞参数为a pm,1 pm=10-10cm,NA表示阿伏加德罗常数)。下列说法正确的是( ) A、Ga元素位于元素周期表的ds区 B、晶体结构中N的配位数为6 C、该物质的化学式为Ga4N4 D、该晶体的密度为16.
A、Ga元素位于元素周期表的ds区 B、晶体结构中N的配位数为6 C、该物质的化学式为Ga4N4 D、该晶体的密度为16. 从玉米穗轴、燕麦与小麦的麦麸和锯木屑等各种农副产品中萃取。清华大学某科研团队创造了一种新型可充放电的生物质电池,其工作原理如图所示:
从玉米穗轴、燕麦与小麦的麦麸和锯木屑等各种农副产品中萃取。清华大学某科研团队创造了一种新型可充放电的生物质电池,其工作原理如图所示:
下列说法正确的是( )
A、放电时,电极发生还原反应 B、充电时,OH-由右侧通过阴离子交换膜移向左侧 C、放电时,若外电路转移1mol电子,理论上正极增重1g D、充电时,阴极电极反应为

二、非选择题:本题共4小题,共56分。
-
17. 氯酸钾为无色或白色晶体,是一种强氧化剂。某化学小组制取氯酸钾并进行有关探究实验。(1)、
I.制取氯酸钾
利用如下左图所示的实验装置进行实验。回答下列问题:
装置A中盛装浓盐酸的仪器名称是。
 (2)、装置A中发生反应的离子方程式为。(3)、氯气和氢氧化钾溶液在加热的条件下可制得氯酸钾,若装置B中加热温度过低,所得主要氧化产物为(填化学式)。已知氯酸钾和氯化钾的溶解度曲线如图所示,反应结束后,从装置B所得溶液中提取氯酸钾晶体的实验操作是蒸发浓缩、、洗涤、干燥。(4)、在不同条件下KClO3可将KI氧化为I2或KIO3。室温下,该小组设计了系列实验研究硫酸浓度对反应产物的影响,实验记录如下表:
(2)、装置A中发生反应的离子方程式为。(3)、氯气和氢氧化钾溶液在加热的条件下可制得氯酸钾,若装置B中加热温度过低,所得主要氧化产物为(填化学式)。已知氯酸钾和氯化钾的溶解度曲线如图所示,反应结束后,从装置B所得溶液中提取氯酸钾晶体的实验操作是蒸发浓缩、、洗涤、干燥。(4)、在不同条件下KClO3可将KI氧化为I2或KIO3。室温下,该小组设计了系列实验研究硫酸浓度对反应产物的影响,实验记录如下表:试管编号
1
2
3
4
0.20mol·L-1KI/mL
1.0
1.0
1.0
1.0
KClO3(s)/g
0.10
0.10
0.10
0.10
6.0mol·L-1H2SO4/mL
0
3.0
x
9.0
蒸馏水/mL
9.0
6.0
5.0
0
取少量反应后溶液滴加淀粉溶液
无现象
变蓝
变蓝
无现象
①3号试管实验中x的值为;1号试管实验的作用是。
②假设氧化产物唯一,还原产物为KCl,2号试管中主要反应的离子方程式为。
③由该系列实验可得出的结论是。
18. 铟是一种稀有贵金属,广泛应用于航空航天、太阳能电池等高科技领域。从高铟烟灰渣(主要含、、、)中提取铟的工艺流程如下:
已知:为强电解质;P2O4为磷酸二异辛酯。
回答下列问题:
(1)、“硫酸化焙烧”后金属元素均以硫酸盐的形式存在。在其他条件一定时,“水浸”铟、铁的浸取率结果如下图所示,则浸取所采用的最佳实验条件。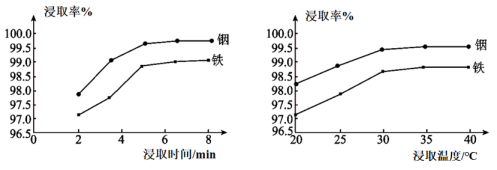 (2)、“水浸”时,浸渣除了外,还含有。(3)、“还原铁”时反应的离子方程式为。(4)、有实验小组“萃取”过程中用酸作萃取剂,用H2A2表示,使In3+进入有机相,萃取过程In3+发生的反应方程式为: , 平衡常数为。“萃取”时萃取率的高低受溶液的影响很大,已知与萃取率(E%)的关系符合如下公式:。当时,萃取率为 , 若将萃取率提升到95%,应调节溶液的pH=(已知 , 忽略萃取剂浓度的变化,结果保留三位有效数字)。(5)、已知In3+易水解,常温下pH为3时即可沉淀完全。“萃取除铁”时,用的P2O4作萃取剂时,发现当溶液后,铟萃取率随值的升高而下降,原因是。(6)、“置换铟”时,发现溶液中残留溶解的也与Zn反应,会有少量的气体生成,该过程的离子方程式为。(7)、整个工艺流程中,可循环利用的溶液是。19. R是一种亲氯有机物,属于非电解质,易溶于水,在含Cl-的溶液中能发生如下反应。
(2)、“水浸”时,浸渣除了外,还含有。(3)、“还原铁”时反应的离子方程式为。(4)、有实验小组“萃取”过程中用酸作萃取剂,用H2A2表示,使In3+进入有机相,萃取过程In3+发生的反应方程式为: , 平衡常数为。“萃取”时萃取率的高低受溶液的影响很大,已知与萃取率(E%)的关系符合如下公式:。当时,萃取率为 , 若将萃取率提升到95%,应调节溶液的pH=(已知 , 忽略萃取剂浓度的变化,结果保留三位有效数字)。(5)、已知In3+易水解,常温下pH为3时即可沉淀完全。“萃取除铁”时,用的P2O4作萃取剂时,发现当溶液后,铟萃取率随值的升高而下降,原因是。(6)、“置换铟”时,发现溶液中残留溶解的也与Zn反应,会有少量的气体生成,该过程的离子方程式为。(7)、整个工艺流程中,可循环利用的溶液是。19. R是一种亲氯有机物,属于非电解质,易溶于水,在含Cl-的溶液中能发生如下反应。反应I: R(aq)+Cl-(aq) ⇌RCl-(aq)
反应II:RCl-(aq)+Cl-(aq) ⇌RCl(aq)
回答下列问题:
(1)、R的分子结构可表示为M-COOH,M为有机分子部分结构。补充完整方程式R+CH3CH2OHH2O +。
(2)、常温下,向NaCl溶液中加入R,15s末测得c(RCl-)=0.07mol/L,c(RCl)=0.04mol/L。①0~15s内,Cl-的平均消耗速率v(Cl-)=。
②待反应充分进行,达到平衡状态时溶液的体积为V0 , 加蒸馏水稀释至溶液体积为V,达到新平衡时,Cl-的物质的量浓度为c平(Cl-),RCl的物质的量浓度为c平(RCl)。写出反应I平衡常数的表达式KI= , 稀释过程中平衡常数KI的值(填“变大”、“变小”或“不变”),请在答题卡坐标内画出
 随1g的变化趋势曲线。(3)、室温下,向Cl-初始浓度c0(Cl-)=amol/L的NaCl溶液中加入不同量的R,用数据传感器测得平衡时(X表示Cl-、RCl- , RCl随变化的数据,记录如表所示(b和d代表数字,忽略溶液体积变化):
随1g的变化趋势曲线。(3)、室温下,向Cl-初始浓度c0(Cl-)=amol/L的NaCl溶液中加入不同量的R,用数据传感器测得平衡时(X表示Cl-、RCl- , RCl随变化的数据,记录如表所示(b和d代表数字,忽略溶液体积变化):0
0.25
0.50
0.75
1.00
Cl-
1.00
0.79
0.64
0.54
0.46
RCl-
0
0.09
0.16
0.22
0.28
RCl22-
0
0.06
b
d
0.13
①从表格中数据可看出关系式:++2×=1,则d=;此关系式也可从理论上推导,下列理论依据中,可推导该关系式的有(填选项序号)。
A.能量守恒定律 B.电荷守恒定律 C.质量守恒定律
D.氧化还原反应遵循还原剂失去的电子总数和氧化剂得到的电子总数相等的规律
②=0.50时,R的转化率为。
20. 奈必洛尔是一种用于血管扩张的降血压药物,一种合成奈必洛尔中间体G的部分流程如下:
已知:乙酸酐的结构简式为
 。
。请回答下列问题:
(1)、A的名称是;B中所含官能团的名称是。(2)、A转化为B的化学方程式为 , 反应⑤的反应类型是。(3)、碳原子上连有4个不同的原子或基团时,该碳称为手性碳。则G分子中的手性碳个数为个(4)、写出满足下列条件的E的同分异构体的两个结构简式:、。Ⅰ.苯环上只有三个取代基
Ⅱ.核磁共振氢谱图中只有4组吸收峰
Ⅲ.1mol该物质与足量NaHCO3溶液反应生成2mol CO2
(5)、根据已有知识并结合相关信息 , 将以 为原料制备
为原料制备 的合成路线流程补充完整(填写括号内的试剂与产物,无机试剂任选)。
的合成路线流程补充完整(填写括号内的试剂与产物,无机试剂任选)。