广东省湛江市霞山区2023-2024学年高二上学期期中考试化学试题
试卷更新日期:2023-12-05 类型:期中考试
一、单选题(1-10题每题2分,11-16题每题4分,共44分)
-
1. 化学反应速率在工农业生产和日常生活中都有重要作用,下列说法正确的是( )A、将肉类食品进行低温冷藏,能使其永远不会腐败变质 B、在化学工业中,选用催化剂一定能提高经济效益 C、夏天面粉的发酵速率与冬天面粉的发酵速率相差不大 D、茶叶等包装中加入还原性铁粉,能显著延长茶叶的储存时间2. 下列事实能用勒夏特列原理来解释的是( )A、SO2被氧化为SO3 , 往往需要使用催化剂:2SO2(g)+O2(g) ⇌2SO3(g) B、500 ℃温度比室温更有利于合成氨反应:N2(g)+3H2(g) ⇌2NH3(g)△H<0 C、H2、I2、HI平衡混合气体加压后颜色加深:H2(g)+I2(g) ⇌2HI(g) D、实验室采用排饱和食盐水的方法收集氯气:Cl2+H2O ⇌H++Cl-+HClO3. 已知:X(g)+2Y(g)
 3Z(g) △H=-akJ·mol-1(a>0),下列说法不正确的是( ) A、0.1molX和0.2molY充分反应生成Z的物质的量一定小于0.3mol B、达到化学平衡状态时,X、Y、Z的浓度不再发生变化 C、达到化学平衡状态时,反应放出的总热量可达a kJ D、升高反应温度,逆反应速率增大,正反应速率减小4. 利用低温技术可处理废气中的氮氧化物。在恒容密闭容器中发生下列化学反应:
3Z(g) △H=-akJ·mol-1(a>0),下列说法不正确的是( ) A、0.1molX和0.2molY充分反应生成Z的物质的量一定小于0.3mol B、达到化学平衡状态时,X、Y、Z的浓度不再发生变化 C、达到化学平衡状态时,反应放出的总热量可达a kJ D、升高反应温度,逆反应速率增大,正反应速率减小4. 利用低温技术可处理废气中的氮氧化物。在恒容密闭容器中发生下列化学反应:4NH3(g)+6NO(g) ⇌5N2(g)+6H2O(l) ΔH=-a kJ/mol(a>0)。下列有关说法正确的是( )
A、其他条件不变,使用高效催化剂,废气中氮氧化物的转化率增大 B、平衡时,其他条件不变,增加NH3的浓度,废气中NO的转化率减小 C、单位时间内生成NH3和H2O的物质的量之比为2∶3时,反应达到平衡 D、平衡时,其他条件不变,升高温度可使该反应的平衡常数增大5. 25℃时,若溶液中由水电离产生的c(OH-) =1×10-12 mol·L-1 , 则下列说法正确的是( )A、该溶液中水的电离被促进 B、该溶液pH一定为2 C、该溶液中K+、Na+、Cl-、NO3-可以大量共存 D、该溶液一定是碱溶液6. 用标准盐酸滴定未知浓度的NaOH溶液,下列操作不会引起实验误差的是( )A、用蒸馏水洗净酸式滴定管后,装入标准盐酸进行滴定 B、用蒸馏水洗净锥形瓶后,再用NaOH溶液润洗,后装入NaOH溶液进行滴定 C、用蒸馏水洗净锥形瓶后,装入20.00mLNaOH溶液,加入少量的蒸馏水再进行滴定 D、用酚酞作指示剂滴至红色刚变无色时,立即停止加盐酸并读数7. 下列各实验装置、目的或结论全都正确的是( )实验装置




(冷水) (热水)甲
乙
丙
丁
A、甲用于测定中和反应的反应热 B、乙可验证FeCl3对H2O2的分解反应有催化作用 C、丙可验证镁片与稀盐酸反应放热 D、由丁可推断出:反应2NO2(g)N2O4(g)为吸热反应8. 和反应生成和HCl的部分反应进程如图所示。已知总反应分3步进行:
第1步 ;
第2步 ;
第3步 。
下列有关说法正确的是( )
 A、 B、第2步的反应速率小于第3步的反应速率 C、减小容器体积增大压强,活化分子百分数增加,反应速率加快 D、9. 结合已知条件分析,下列热化学方程式正确的是(所有数据均在常温常压下测定)( )
A、 B、第2步的反应速率小于第3步的反应速率 C、减小容器体积增大压强,活化分子百分数增加,反应速率加快 D、9. 结合已知条件分析,下列热化学方程式正确的是(所有数据均在常温常压下测定)( )选项
已知条件
热化学方程式
A
H2的燃烧热数值为a kJ/mol
B
1 mol SO2与足量O2充分反应后,放出热量49.15 kJ
2SO2(g)+O2(g) ⇌2SO3(g)
C
D
31 g白磷比31 g红磷能量多b kJ
A、A B、B C、C D、D10. 能证明蚁酸(HCOOH)是弱酸的实验事实是( )A、HCOOH溶液与Zn反应放出H2 B、0.1 mol·L-1 HCOOH溶液可使紫色石蕊溶液变红 C、HCOOH溶液与Na2CO3反应生成CO2 D、常温时0.1 mol·L-1 HCOOH溶液的pH=2.311. 在密闭容器中进行反应:X(g)+3Y(g) ⇌2Z(g),有关下列图像的说法错误的是( )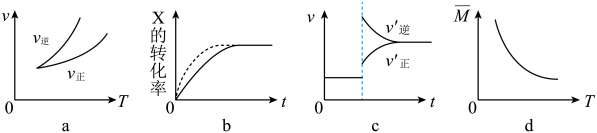 A、依据图a可判断正反应为放热反应 B、在图b中,虚线可表示使用了催化剂 C、若正反应的△H>0,图c可表示升高温度正逆化学反应v-t图 D、由图d中混合气体的平均相对分子质量随温度的变化情况,可知正反应ΔH<012. 常温下,向20 mL 0.1 mol·L-1CH3COOH溶液中逐滴加入0.1 mol·L-1的NaOH溶液,滴入NaOH溶液的体积与溶液pH的变化关系如图所示。下列说法正确的是( )
A、依据图a可判断正反应为放热反应 B、在图b中,虚线可表示使用了催化剂 C、若正反应的△H>0,图c可表示升高温度正逆化学反应v-t图 D、由图d中混合气体的平均相对分子质量随温度的变化情况,可知正反应ΔH<012. 常温下,向20 mL 0.1 mol·L-1CH3COOH溶液中逐滴加入0.1 mol·L-1的NaOH溶液,滴入NaOH溶液的体积与溶液pH的变化关系如图所示。下列说法正确的是( ) A、a点的pH=1 B、反应过程中 的值不断增大 C、c点时,V(NaOH)=20 mL D、b点时,c(CH3COO-)=0.05 mol·L-113. 一定温度下,向2.0 L的恒容密闭容器中充入1.6molCO、1.6molNO,发生反应2NO(g)+2CO(g) ⇌N2(g)+2CO2(g),经过一段时间后达平衡。反应进行到不同时间测得n(CO)如表所示:
A、a点的pH=1 B、反应过程中 的值不断增大 C、c点时,V(NaOH)=20 mL D、b点时,c(CH3COO-)=0.05 mol·L-113. 一定温度下,向2.0 L的恒容密闭容器中充入1.6molCO、1.6molNO,发生反应2NO(g)+2CO(g) ⇌N2(g)+2CO2(g),经过一段时间后达平衡。反应进行到不同时间测得n(CO)如表所示:t/s
0
5
10
15
20
n(CO)/mol
1.6
1.4
0.6
0.4
0.4
下列说法正确的是( )
A、反应在前5s的平均速率为v(N2)=0.02mol•L-1 B、保持其他条件不变,降低温度,平衡时c(CO)=0.15mol•L⁻1 , 则反应的△H>0 C、相同温度下,起始时向容器中充入1.6molN2和3.2molCO2 , 达到平衡时,则此反应的化学平衡常数为67.5 D、保持其他条件不变,向容器中再充入1.6molCO,达到新平衡时,CO的转化率增大14. 常温时,将10 mL pH=3的CH3COOH溶液中加水稀释,下列说法正确的是( )A、溶液中减小B、溶液中导电粒子数目减少 C、CH3COOH电离度增大,c(H+)也增大 D、向溶液中加入pH=11的NaOH溶液后,pH>715. 25 ℃时,有关水的电离,下列叙述正确的是( )A、向水中加入稀氨水,水的电离平衡逆向移动,c(OH-)降低 B、向水中加入少量固体NaHSO4 , c(H+)增大,Kw不变 C、向水中通入HCl气体,平衡逆向移动,c(H+)降低 D、将水加热,Kw增大,c(H+)不变16. 一元酸HX和HY都是20 mL,分别用0.1 mol·L-1 NaOH溶液滴定,滴定曲线如图,下列说法正确的是( ) A、用0.1 mol·L-1 NaOH溶液滴定HX时,选用甲基橙作指示剂测定结果偏低 B、HX可能是HCl,HY可能是CH3COOH C、HX和HY的物质的量浓度可能都为1 mol·L-1 D、a点和b点对应溶液的导电性相同
A、用0.1 mol·L-1 NaOH溶液滴定HX时,选用甲基橙作指示剂测定结果偏低 B、HX可能是HCl,HY可能是CH3COOH C、HX和HY的物质的量浓度可能都为1 mol·L-1 D、a点和b点对应溶液的导电性相同二、非选择题。(共4题,共56分)
-
17.(1)、如图中, , , 根据要求回答问题:

如图是1mol NO2和1molCO反应生成CO2和NO过程中的能量变化示意图,若在反应体系中加入催化剂,反应速率增大,的变化是(填“增大”“减小”或“不变”),请写出NO2和CO反应的热化学方程式:。(2)、 在某温度下,将H2和I2各1mol的气态混合物充入10L的密闭容器中发生反应H2(g)+I2(g) ⇌2HI(g)ΔH<0,达到平衡后,测得c(H2)=0.08mol/L。保持容器容积不变,向其中再加入1molH2 , 反应速率(填“增大”、“减小”或“不变”),平衡移动(填“向正反应方向”、“向逆反应方向”或“不”)。
②保持容器内气体压强不变,向其中加入1molN2(N2不参加反应),反应速率(填“增大”、“减小”或“不变”),平衡移动(填“向正反应方向”、“向逆反应方向”或“不”)。
③该反应的化学平衡常数K=。
18.(1)、I.为比较Fe3+、Cu2+对H2O2分解的催化效果,某实验小组同学设计了如图的实验。通过观察(填实验现象),即可得出Fe3+、Cu2+的催化效果的差异。有同学提出将CuSO4溶液改为CuCl2溶液更合理,其理由是。 (2)、某实验小组欲探究某一外界条件对酸性KMnO4和H2C2O4(草酸)反应速率的影响,
(2)、某实验小组欲探究某一外界条件对酸性KMnO4和H2C2O4(草酸)反应速率的影响,设计实验方案如表:
序号
草酸溶液
酸性高锰酸钾溶液
①
0.1mol•L-1、20mL
0.01mol•L-1、30mL
②
0.2mol•L-1、20mL
0.01mol•L-1、30mL
上述反应的离子方程式为 , 该实验是探究对反应速率的影响。
(3)、II.水的电离平衡曲线如图所示,回答下列问题。
图中A、B、C、D、E五点Kw间的关系:。
(4)、在水中加少量酸,可实现A点向点移动。(5)、若在B点温度下,pH=2的硫酸溶液中,(H+)= mol·L-1。19. 在一定温度下,向一容积为5 L的恒容密闭容器中充入0.4 mol SO2和0.2 mol O2 , 发生反应:2SO2(g)+O2(g) ⇌2SO3(g) ∆H = -196 kJ/mol。经2 min后达到平衡,当反应达到平衡时,容器内压强变为起始时的0.8倍。请回答下列问题:(1)、判断该反应达到平衡状态的标志是(填字母);a.SO2、O2、SO3三者的浓度之比为2:1:2 b.容器内气体的压强不变
c.容器内混合气体的密度保持不变 d.SO3的物质的量不再变化
e.SO2的生成速率和SO3的生成速率相等
(2)、从反应开始到平衡的这段时间O2的转化率为 , 用SO2的浓度变化表示的平均反应速率v(SO2)= 。(3)、若反应温度降低,SO2的转化率(填“增大”“减小”或“不变”);如图表示平衡时SO2的体积分数随压强和温度变化的曲线。则温度关系:T1T2(填“>”“<”或“=”)。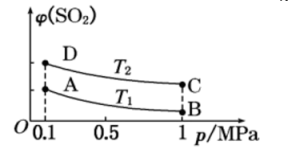 (4)、已知反应:CO2(g)+4H2(g) ⇌CH4(g)+2H2O(g) ΔH<0。在一定条件下,反应体系中CO2的平衡转化率α(CO2)与L和X的关系如右图所示,L和X表示温度或压强。
(4)、已知反应:CO2(g)+4H2(g) ⇌CH4(g)+2H2O(g) ΔH<0。在一定条件下,反应体系中CO2的平衡转化率α(CO2)与L和X的关系如右图所示,L和X表示温度或压强。①X表示的物理量是。
②L1L2(填“<”或“>”),判断理由是
 20. 现使用酸碱中和滴定法测定某市售白醋(化学式为:CH3COOH,是一元弱酸)的总酸量。(1)、Ⅰ.实验步骤:
20. 现使用酸碱中和滴定法测定某市售白醋(化学式为:CH3COOH,是一元弱酸)的总酸量。(1)、Ⅰ.实验步骤:
用(填仪器名称)量取 10.00 mL 食用白醋,在烧杯中用水稀释后转移到100 mL(填仪器名称)中定容,摇匀即得待测白醋溶液。(2)、取待测白醋溶液 20.00 mL 于锥形瓶中,向其中滴加 2 滴作指示剂。(3)、读取盛装 0.1000 mol/L NaOH 溶液的碱式滴定管的初始读数。如果液面位置如图所示,则此时的读数为mL。 (4)、滴定。当时,停止滴定,并记录 NaOH 溶液的最终读数。重复滴定 3 次。(5)、利用 pH 传感器绘制的滴定曲线如右下图所示,若在室温下,用0.1000mol/L NaOH 溶液分别滴定 10.00mL同物质的量浓度的盐酸和醋酸,其中表示滴定醋酸的曲线是(填序号)。(6)、Ⅱ.实验记录
(4)、滴定。当时,停止滴定,并记录 NaOH 溶液的最终读数。重复滴定 3 次。(5)、利用 pH 传感器绘制的滴定曲线如右下图所示,若在室温下,用0.1000mol/L NaOH 溶液分别滴定 10.00mL同物质的量浓度的盐酸和醋酸,其中表示滴定醋酸的曲线是(填序号)。(6)、Ⅱ.实验记录滴定次数 1 2 3 V(样品)/mL 20.00 20.00 20.00 V消耗(NaOH)/mL 15.00 15.04 14.96 Ⅲ.数据处理与讨论

按上述数据处理,可得 c(市售白醋)=mol/L。
(7)、在本实验的滴定过程中,下列操作会使实验结果偏低的是(填字母)。A.碱式滴定管在滴定时未用 NaOH 标准溶液润洗
B.碱式滴定管的尖嘴在滴定前有气泡,滴定后气泡消失
C.锥形瓶中加入待测白醋溶液后,再加少量水
D.锥形瓶在滴定时剧烈摇动,有少量液体测出
E.滴定终点读数时采用仰视方法