浙江省宁波市余姚市六校2023-2024学年九年级第一学期科学期中联考试卷
试卷更新日期:2023-12-01 类型:期中考试
一、选择题(本大题共15小题,每小题3分,共45分。请选出每小题中一个符合题意的选项,不选、多选、错选均不给分)
-
1. 质量守恒定律是自然科学的基本定律之一,它的发现使得化学科学由定性研究走向定量研究,促进了化学科学的发展。化学反应前后可能发生改变的是( )A、原子的种类 B、分子的数目 C、原子的数目 D、原子的质量2. 规范的实验操作是实验成功的基本保障,下列实验操作正确的是( )A、滴加液体
 B、取用固体药品
B、取用固体药品 C、量取一定体积溶液
C、量取一定体积溶液 D、稀释浓硫酸
D、稀释浓硫酸 3. 下列物质中能与稀硫酸发生中和反应,且能产生白色沉淀的是( )A、Ba(OH)2 B、K2CO3 C、Mg(OH)2 D、BaCl24. 芋艿(俗称毛芋)是一种常见的食品,新鲜芋艿在去皮时会出现一种白色的汁液,汁液内含有一种碱性物质,沾上它会奇痒难忍,下列厨房中的物质止痒效果最好的是( )A、食醋 B、白酒 C、纯碱 D、食盐水5. 下列关于盐酸的用途中,不能用稀硫酸代替的是( )A、与锌反应制取氢气 B、除去金属制品表面的锈斑 C、与大理石块反应制取二氧化碳 D、中和碱性溶液6. 苯甲酸(C6H5COOH)是常见的食品防腐剂,它是一种有机酸,化学兴趣小组的同学准备验证苯甲酸的酸性,他们选择了下列物质,其中不能达到目的的是( )A、铜片 B、铁钉 C、大理石 D、石蕊溶液7. 如图所示是甲、乙、丙、丁四种常见金属与盐酸反应的示意图。下列说法错误的是( )
3. 下列物质中能与稀硫酸发生中和反应,且能产生白色沉淀的是( )A、Ba(OH)2 B、K2CO3 C、Mg(OH)2 D、BaCl24. 芋艿(俗称毛芋)是一种常见的食品,新鲜芋艿在去皮时会出现一种白色的汁液,汁液内含有一种碱性物质,沾上它会奇痒难忍,下列厨房中的物质止痒效果最好的是( )A、食醋 B、白酒 C、纯碱 D、食盐水5. 下列关于盐酸的用途中,不能用稀硫酸代替的是( )A、与锌反应制取氢气 B、除去金属制品表面的锈斑 C、与大理石块反应制取二氧化碳 D、中和碱性溶液6. 苯甲酸(C6H5COOH)是常见的食品防腐剂,它是一种有机酸,化学兴趣小组的同学准备验证苯甲酸的酸性,他们选择了下列物质,其中不能达到目的的是( )A、铜片 B、铁钉 C、大理石 D、石蕊溶液7. 如图所示是甲、乙、丙、丁四种常见金属与盐酸反应的示意图。下列说法错误的是( ) A、上述四种金属可以分为两类:一类能与酸反应,一类不能与酸反应 B、金属甲、乙、丙与盐酸发生的反应均属于置换反应 C、若乙是金属Zn,则丙可能是Fe或Cu D、四种金属的活动性顺序由强到弱可排列为甲、乙、丙、丁8. 如图所示的四个图像,能正确反映对应变化关系的是( )A、一定量的水,通过电解水的装置电解
A、上述四种金属可以分为两类:一类能与酸反应,一类不能与酸反应 B、金属甲、乙、丙与盐酸发生的反应均属于置换反应 C、若乙是金属Zn,则丙可能是Fe或Cu D、四种金属的活动性顺序由强到弱可排列为甲、乙、丙、丁8. 如图所示的四个图像,能正确反映对应变化关系的是( )A、一定量的水,通过电解水的装置电解 B、一定量的氢氧化钠溶液中,通入二氧化碳,至恰好完全反应
B、一定量的氢氧化钠溶液中,通入二氧化碳,至恰好完全反应  C、一定量的稀盐酸中,滴加硝酸银溶液至过量
C、一定量的稀盐酸中,滴加硝酸银溶液至过量  D、一瓶浓盐酸和一瓶浓硫酸,在实验室中敞口放置一定时间
D、一瓶浓盐酸和一瓶浓硫酸,在实验室中敞口放置一定时间 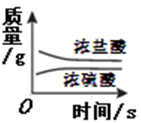 9. 如图是某反应的部分模拟微观示意图,“
9. 如图是某反应的部分模拟微观示意图,“ ”与“
”与“ ”分别表示两种不同的原子。反应后方框内生成的微粒示意图是( )
”分别表示两种不同的原子。反应后方框内生成的微粒示意图是( )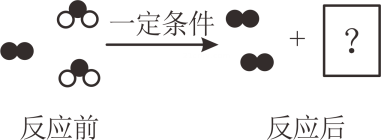 A、
A、 B、
B、 C、
C、 D、
D、 10. 向稀盐酸中加入某物质,其pH变化情况如图所示,则该物质可能是( )
10. 向稀盐酸中加入某物质,其pH变化情况如图所示,则该物质可能是( ) A、H2O B、AgNO3固体 C、浓盐酸 D、KOH固体11. 小科同学用图表对所学知识进行归纳,其中甲包含乙和丙,不包含丁,下列关系错误的是( )
A、H2O B、AgNO3固体 C、浓盐酸 D、KOH固体11. 小科同学用图表对所学知识进行归纳,其中甲包含乙和丙,不包含丁,下列关系错误的是( )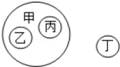
甲
乙
丙
丁
A
碱
烧碱
纯碱
二氧化锰
B
酸
硝酸
硫酸
碳酸钠
C
盐
食盐
碳酸钙
盐酸
D
氧化物
生石灰
水
氧气
A、A B、B C、C D、D12. 下图装置可用于气体的收集、检验、除杂和体积的测量等,下列实验无法完成的是( ) A、气体从a端通入,收集二氧化碳 B、瓶内装有适量澄清石灰水,检验氧气中是否混有二氧化碳 C、瓶内装有适量氢氧化钠溶液,吸收一氧化碳中混有的二氧化碳 D、在b端接量筒,瓶内装满水,测量气体的体积13. 两个烧杯中装有等质量的金属锌和镁,然后分别逐渐加入同浓度的稀硫酸,产生氢气的质量与加入硫酸的质量关系如图所示。下列说法正确的是( )
A、气体从a端通入,收集二氧化碳 B、瓶内装有适量澄清石灰水,检验氧气中是否混有二氧化碳 C、瓶内装有适量氢氧化钠溶液,吸收一氧化碳中混有的二氧化碳 D、在b端接量筒,瓶内装满水,测量气体的体积13. 两个烧杯中装有等质量的金属锌和镁,然后分别逐渐加入同浓度的稀硫酸,产生氢气的质量与加入硫酸的质量关系如图所示。下列说法正确的是( ) A、该图反映出镁比锌的金属活动性强 B、a点时,两个烧杯中的酸都恰好完全反应 C、b点时,两个烧杯中产生氢气的质量相同 D、c点时,两个烧杯中都有金属剩余14. 某金属单质X与非金属单质Y可发生反应:2X+Y=X2Y。某实验探究小组进行了两次实验,测得数据如下表:
A、该图反映出镁比锌的金属活动性强 B、a点时,两个烧杯中的酸都恰好完全反应 C、b点时,两个烧杯中产生氢气的质量相同 D、c点时,两个烧杯中都有金属剩余14. 某金属单质X与非金属单质Y可发生反应:2X+Y=X2Y。某实验探究小组进行了两次实验,测得数据如下表:实验序号
X的用量/g
Y的用量/g
生成X2Y的质量/g
1
7.4
1.6
8.0
2
9.6
3.2
12.0
参加反应的X与Y的质量比为( )
A、4:1 B、3:1 C、2:1 D、37:815. 向一定质量FeCl2和CuCl2的混合溶液中加入锌粉,反应过程中,混合物中溶液的质量与加入锌的质量关系如图所示,该反应过程中混合物中的溶液和固体的有关说法正确的是( ) A、a点时,溶液中只含有两种溶质 B、c点时,向固体中滴加稀盐酸,无气泡产生 C、d点时,溶液中的溶质为ZnCl2 D、e点时,固体中只含两种物质
A、a点时,溶液中只含有两种溶质 B、c点时,向固体中滴加稀盐酸,无气泡产生 C、d点时,溶液中的溶质为ZnCl2 D、e点时,固体中只含两种物质二、填空题(本题共7小题,每空2分,共40分)
-
16. 用化学用语完成下列填空(1)、3个铵根离子;
(2)、银元素;
(3)、醋酸分子;
17. 下表是几种家用清洁剂的功能、有效成分。清洁剂名称
洁厕灵
活氧彩漂
漂白精
功能
有效清除污垢,除异味
漂洗衣物,使色彩更鲜艳
快速漂除衣物污渍
有效成分
HCl
H2O2
NaClO
据表回答下列问题:
(1)、“洁厕灵”不能用于大理石表面清洁的理由是;(2)、在盛有少量“活氧彩漂”液体的试管中,加少量二氧化锰,观察到的现象为:;(3)、“洁厕灵”与“漂白精’不能混用。二者若混合易产生一种有毒气体,反应的化学方程式为:NaClO+2HCl=NaCl+X↑+H2O,则X的化学式为。18. 如图所示的U形管中是滴有酚酞试液的蒸馏水,向左、右两管中同时逐滴滴加一定量的氢氧化钠稀溶液和稀盐酸。 (1)、开始时管溶液呈红色;(填“左”或“右”)(2)、充分反应后U形管中溶液全部呈红色,此时溶液中含有的溶质除酚酞外还有。19. 下列物质①熟石灰②浓硫酸③氢氧化铝④稀盐酸⑤大理石五种物质,请用它们的化学式(或主要成分的化学式)填空。(1)、可用于除锈的是。(2)、经常作为某些气体干燥剂的是。20. 金属在生活生产中有着非常广泛的应用。请回答下列问题:
(1)、开始时管溶液呈红色;(填“左”或“右”)(2)、充分反应后U形管中溶液全部呈红色,此时溶液中含有的溶质除酚酞外还有。19. 下列物质①熟石灰②浓硫酸③氢氧化铝④稀盐酸⑤大理石五种物质,请用它们的化学式(或主要成分的化学式)填空。(1)、可用于除锈的是。(2)、经常作为某些气体干燥剂的是。20. 金属在生活生产中有着非常广泛的应用。请回答下列问题: (1)、根据如图金属应用实例推断,金属具有的物理性质有(至少答两点);(2)、生铁和钢都是属于合金,它们的主要成分是;(3)、厨房中的下列物品所使用的主要材料属于金属材料的是____;A、陶瓷碗 B、不锈钢炊具 C、橡胶手套 D、铜质水龙头(4)、微型化录音录像的高性能磁带中磁粉主要材料之一是化学组成相当于CoFe2O4的化合物,又知钴(Co)和铁都有+2、+3价,且在上述化合物中每种元素只具有一种化合价,则铁元素的化合价为。21. 如图所示为A、B、C三种物质的溶液两两混合时的实验现象。已知:A是一种含氯元素的盐,B是一种酸,C是一种碱。请回答:
(1)、根据如图金属应用实例推断,金属具有的物理性质有(至少答两点);(2)、生铁和钢都是属于合金,它们的主要成分是;(3)、厨房中的下列物品所使用的主要材料属于金属材料的是____;A、陶瓷碗 B、不锈钢炊具 C、橡胶手套 D、铜质水龙头(4)、微型化录音录像的高性能磁带中磁粉主要材料之一是化学组成相当于CoFe2O4的化合物,又知钴(Co)和铁都有+2、+3价,且在上述化合物中每种元素只具有一种化合价,则铁元素的化合价为。21. 如图所示为A、B、C三种物质的溶液两两混合时的实验现象。已知:A是一种含氯元素的盐,B是一种酸,C是一种碱。请回答: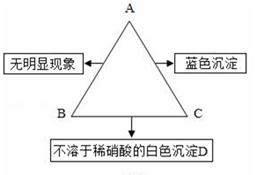 (1)、D的化学式为;(2)、A、B不能发生复分解反应的原因是;(3)、A、C反应的化学方程式为;22. 已知某固体混合物A中含有CuSO4、FeCl3、NaNO3、BaCl2、CaCO3五种物质中的两种或多种,按下述步骤把固体A分成两份进行实验探究(设过程中所有发生的反应都恰好完全反应)
(1)、D的化学式为;(2)、A、B不能发生复分解反应的原因是;(3)、A、C反应的化学方程式为;22. 已知某固体混合物A中含有CuSO4、FeCl3、NaNO3、BaCl2、CaCO3五种物质中的两种或多种,按下述步骤把固体A分成两份进行实验探究(设过程中所有发生的反应都恰好完全反应)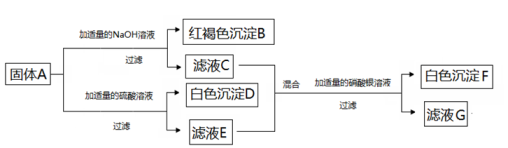
根据上述实验过程和观察到的实验现象做出相应的推理,填写以下空白:
(1)、在固体混合物A里,上述五种物质中肯定存在的物质是;可能存在的物质是。(2)、在滤液G中存在的溶质有。三、实验探究题(本大题共3小题,每空3分,共39分)
-
23. 为探究铁生锈的原因,化学兴趣小组的同学进行了如图所示的4个实验,实验结果显示:B、D实验中铁生了锈,而A、C实验中没有明显的现象,仔细分析这4个实验,回答下列问题:
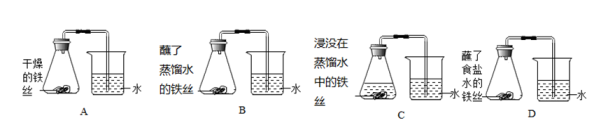
【评价方案】
该探究中采用了控制变量法,整个实验过程可以形成三组对照A和B;B和D;。
【解释数据】
实验时,每隔一段时间测量导管内水面上升的高度,结果如下表所示(表中所列数据为导管中水面上升的高度/cm)
编号
0min
30min
60min
90min
120min
150min
180min
A
0
0
0
0
0
0
0
B
0
0
0
0.3
0.8
2.0
3.5
C
0
0
0
0
0
0
0
D
0
0.4
1.2
3.4
7.6
9.5
9.8
导致B、D实验装置中导管内水面上升的原因是。
【获得结论】
根据本实验,你认为导致铁生锈的物质有;能加快铁生锈的物质是。
24. 某科学实验小组的同学进行酸碱中和反应的实验,他们取适量氢氧化钠溶液于烧杯中,滴加一定量稀盐酸后,没有现象。为了确定盐酸与氢氧化钠的反应程度,他们从烧杯中取了少量溶液于试管中,并向试管中滴加几滴无色酚酞试液,振荡,观察到试管中溶液颜色没有变化。于是他们对烧杯中的溶液进行了以下探究:(1)、甲同学认为此时烧杯中的溶液可能有以下三种情况:①盐酸与氢氧化钠恰好完全反应;②氢氧化钠有剩余;③盐酸有剩余。
乙同学却认为第②种情况不成立,他的理由是:;
(2)、他们共同设计了一个实验方案,欲对上述其他两种可能情况进行验证。请根据相关内容填写如表:实验方法
可能观察到的现象
结论
将少量锌粒放入试管中,然后从烧杯中取适量溶液至试管中
则盐酸过量
没有现象
则盐酸与氢氧化钠恰好完全反应
(3)、经过讨论,他们认为利用下列几种物质代替锌粒,也可以达到验证目的。你认为其中不正确的是____(填序号)。A、生锈的铁钉 B、碳酸钠粉末 C、硫酸钠粉末 D、氢氧化铜25. 请你根据下图回答有关问题: (1)、实验室欲制备并收集二氧化碳,需在图一中选用A、B与组合(填序号);(2)、图二是两套干燥气体装置,可用于干燥二氧化碳的是(填“甲”或“乙”)。(3)、碱石灰久置在空气中会变质。某实验小组为确定一瓶久置的碱石灰的成分,设计了如图实验流程,请你参与探究过程:
(1)、实验室欲制备并收集二氧化碳,需在图一中选用A、B与组合(填序号);(2)、图二是两套干燥气体装置,可用于干燥二氧化碳的是(填“甲”或“乙”)。(3)、碱石灰久置在空气中会变质。某实验小组为确定一瓶久置的碱石灰的成分,设计了如图实验流程,请你参与探究过程:
①固体A中一定含有。
②为了确定滤液B的成分,甲、乙同学做了如下探究:
甲同学:取少量溶液B于试管中,滴加足量的稀盐酸,产生大量气泡,则溶液B中的溶质是Na2CO3;
乙同学:取少量溶液B于试管中,滴加几滴酚酞试液,溶液变成红色,则溶液B中的溶质一定含有NaOH。
两位同学交流后觉得他们的结论均有不足。于是又做了如下实验。

上述实验中,加入足量CaCl2溶液的目的是。滤液B中的溶质是。
③实验过程中,同学们发现向原样品中加水时还放出大量的热。综合以上探究,下列有关原样品成分的分析正确的是(填序号)。
(提示Ca(OH)2、Na2CO3溶于水无明显的温度变化;CaCl2溶液呈中性。)
A.一定有NaOH B.一定有Na2CO3 C.一定有CaO D.至少有CaO、NaOH中的一种
四、解答题(本题共有5小题,共36分)
-
26. 硝酸铵(NH4NO3)是初中化学常见物质,请回答:(1)、硝酸铵属于(选填“酸”或“碱”或“盐”)。
(2)、硝酸铵中氮元素和氧元素的质量比为。
(3)、硝酸铵中氢元素的质量分数为。
27. 用已知溶质质量分数的溶液可以测定未知溶液的质量分数,实验室有一瓶标签模糊的稀盐酸,某同学为了测定其溶质质量分数,进行了如下实验。①取一洁净的锥形瓶称量,然后往其中加入一定量的稀盐酸,并滴入几滴紫色石蕊试液(质量忽略不计),重新称量;
②往上述锥形瓶中逐滴加入溶质质量分数为16%的氢氧化钠溶液,边滴加边振荡,当观察到溶液由红色恰好变为紫色时,停止滴加,再次称量,数据如下表:
锥形瓶 锥形瓶+稀盐酸 锥形瓶+反应后溶液 质量(克) 35.5 55.5 80.5 (1)、若要配制500克16%的氢氧化钠溶液,需要氢氧化钠固体克;(2)、该瓶稀盐酸的溶质质量分数为;(3)、另有同学做了同样实验,却得到了不同的结果,于是用精密pH试纸测得反应后锥形瓶内溶液的pH为8.2,则他测出的盐酸溶质质量分数(选填“偏大”或“偏小”),造成这一偏差的原因是。28. 黄铜(铜锌合金)的外观与黄金极为相似、容易以假乱真。小红同学想测定黄铜中锌的含量。她称取20g黄铜样品放入烧杯中,加入足量稀硫酸充分反应后,测得生成氢气的质量为0.2g。(1)、该反应属于(填基本反应类型)。(2)、求黄铜样品中锌的质量分数。29. 欲测定盐酸与氯化钙的混合溶液中氯化钙的质量分数,进行了如下实验:取混合溶液100g于锥形瓶中,向其中逐渐加入一定溶质质量分数的碳酸钠溶液(如图一),并不断测定锥形瓶中溶液的pH。反应过程中所得溶液的pH与锥形瓶中物质的总质量的关系如图二所示。其中,当锥形瓶中溶液的质量增加至147.8g时,共消耗碳酸钠溶液的质量为50g。(忽略二氧化碳在水中溶解的量;氯化钙溶液显中性。) (1)、m点的数值是。(2)、a→b段表示碳酸钠与混合溶液中的反应。(3)、请计算参加反应的碳酸钠溶液的溶质的质量分数.(4)、原混合溶液中CaCl2的质量分数?30. 小科在实验室里发现有一瓶碳酸钠和氯化钠组成的混合溶液。他想测定该溶液中碳酸钠和氯化钠的质量分数,为此设计并进行了如下实验。
(1)、m点的数值是。(2)、a→b段表示碳酸钠与混合溶液中的反应。(3)、请计算参加反应的碳酸钠溶液的溶质的质量分数.(4)、原混合溶液中CaCl2的质量分数?30. 小科在实验室里发现有一瓶碳酸钠和氯化钠组成的混合溶液。他想测定该溶液中碳酸钠和氯化钠的质量分数,为此设计并进行了如下实验。实验1:取该混合溶液50g,向其中逐滴加入稀盐酸,当加入稀盐酸的质量为20g、40g、60g时,生成气体的质量见下表(气体的溶解忽略不计)。
实验2:另取该溶液50g,加入一定量稀盐酸充分反应后,测得溶液的pH=7,然后再加入硝酸银溶液,测得实验数据如图。

第一组
第二组
第三组
稀盐酸的质量/g
20
40
60
生成气体的质量/g
2.2
m
5.5
试分析计算:
(1)、实验1中,第二组数据m为。(2)、实验所用盐酸的质量分数是多少?(3)、 50克原混合溶液中氯化钠的质量分数?