2023-2024学年 浙教版科学 九年级上册 期末复习重难点提升练 专题09 离子的共存与鉴别
试卷更新日期:2023-12-01 类型:复习试卷
一、选择题
-
1. 向Zn(NO3)2和Cu(NO3)2混合溶液中加入一定量的铁粉,充分反应后,过滤。向滤渣中再加入稀盐酸,有气体放出。下列说法正确的是( )A、滤渣中一定有锌 B、滤渣中一定有铜 C、所得溶液中一定有Zn2+、Cu2+ D、所得溶液中一定有Cu2+、Fe2+2. 甲、乙、丙、丁四种溶液中,分别含有Ba2+、Mg2+、Na+、H+、CI-、OH-、、中的一种阳离子和一种阴离子。为确定四种溶液中分别含有哪种阳离子或阴离子,进行了如下实验:
①将甲溶液分别与其他三种溶液混合,都观察到有白色沉淀生成;
②将乙、丁溶液混合,有气泡产生;
③向丙溶液中滴入AgNO3溶液,可明显观察到白色沉淀,加稀硝酸后,沉淀不消失;
分析实验得到的以下结论中错误的是( )
A、甲溶液中一定含有Ba2+ B、乙溶液中可能含有 C、丙溶液中一定含有Cl- D、丁溶液中一定含有Na+3. 今有一混合物的水溶液,只可能含有以下离子中的若干种:K+、、Cl-、Ba2+、、。现取二份100mL溶液进行如下实验:(1)第一份加足量NaOH溶液加热后,收集到0.68g气体(2)第二份加足量BaCl2溶液后,得到干燥沉淀6.27g,经足量盐酸洗涤、干燥后,沉淀质量为2.33g。根据上述实验,以不推测正确的是( )A、一定不存在Ba2+ , 可能存在 B、、定存在,K+、Cl-可能存在 C、Ba2+可能存在,一定不存在 D、K+、、、一定存在,Cl-可能存在4. “五水共治”大大美化了河道环境某学校实验室排出的废水中含有Ag+、Ba2+”和NO3-三种离子。该校实验小组设计实验从该废水中回收银,并得到副产品碳酸钡固体,操作步骤和实验结果如下
已知滤液B中只含有一种溶质,则下列说法不正确的是( )
A、蓝色沉淀是Cu(OH)2 B、乙一定是氢氧化钡 C、若丙是K2CO3 , 滤液C结晶后可以作为化学肥料 D、若得到19.7g碳酸钡,则证明原废水中含有13.7g钡5. 经氯化法消毒杀菌后的自来水中含有氯离子,鉴别此类自来水与蒸馏水可选用的试剂是( )A、酚酞试液 B、AgNO3溶液 C、NaOH溶液 D、Ba(NO3)2溶液6. 一定质量的Zn加入到含有Fe(NO3)2和AgNO3两种物质的混合溶液中,充分反应后过滤液仍为浅绿色,下列叙述正确的是( )①滤液中一定有Zn2+、Fe2+ ②滤液中可能有Ag+ ③滤渣中一定有Ag,可能有Fe
A、①② B、①③ C、②③ D、①②③7. 某固体由 Ba2+、Cu2+、Na+、Cl-、CO32-、SO42-中的几种离子构成,取一定质量的该固体样品,进行如下实验:①将固体溶于水得无色透明溶液,加入足量BaCl2溶液,过滤后得到5克白色沉淀;②在沉淀中加入过量稀硝酸,仍有3克白色沉淀;③在滤液中滴加AgNO3溶液,产生白色沉淀。则该固体中一定含有( )A、Na+、CO32-、SO42- B、Cu2+、CO32-、SO42- C、Cl-、CO32-、SO42- D、Na+、Ba2+、Cl-8. 往硝酸铜、硝酸银和硝酸亚铁的混合溶液中缓慢连续加入质量为m的锌粉,溶质中析出固体的质量与参加反应的锌粉质量关系如图所示,下列说法中正确的是( ) A、c点对应溶液中含有的金属离子为Zn2+和Cu2+ B、bc段(不含两端点)析出的金属是Fe C、ab段(不含两端点)对应溶液中含有的金属离子为Zn2+、Ag+、Cu2+和Fe2+ D、若bc段和cd段中析出固体质量相等,参加反应的锌粉质量分别为m1和m2 , 则m1>m29. 一瓶含有Na+、Cl-、OH-、CO32-的溶液,现仅用一份样品溶液,选用下列提供的试剂与操作,逐一检验出其中的三种阴离子,正确的顺序是( )
A、c点对应溶液中含有的金属离子为Zn2+和Cu2+ B、bc段(不含两端点)析出的金属是Fe C、ab段(不含两端点)对应溶液中含有的金属离子为Zn2+、Ag+、Cu2+和Fe2+ D、若bc段和cd段中析出固体质量相等,参加反应的锌粉质量分别为m1和m2 , 则m1>m29. 一瓶含有Na+、Cl-、OH-、CO32-的溶液,现仅用一份样品溶液,选用下列提供的试剂与操作,逐一检验出其中的三种阴离子,正确的顺序是( )①过滤;②滴加足量AgNO3溶液;③滴加足量Ba(NO3)2溶液;④滴加足量Mg(NO3)2溶液;
A、②①③①④ B、②①④①③ C、③①④①② D、④①③①②10. 某固体混合物成分是由 Na+、Ba2+、Cu2+、Cl-、 、 、 中的几种离子构成,取一定质量的该固体混合物样品,进行如下实验:①将固体样品溶于水得无色透明溶液,加入足量 BaCl2 溶液过滤,得到白色沉淀和无色滤液。
②在①所得的白色沉淀中加入过量稀硝酸,白色沉淀部分溶解并产生气泡。
③在①所得的无色滤液中滴加 AgNO3溶液产生白色沉淀。
由此推断该固体中一定含有的离子是( )
A、Na+、 、 B、Na+、 、 、Cl- C、Ba2+、 、 、 Cl- D、Ba2+、Cu2+、 、二、填空题
-
11. 电子工业常用30%的FeCl3溶液腐蚀覆盖有一层薄铜的绝缘板,制成印刷电路板。为了从废腐蚀液(含有CuCl2、FeCl2和FeCl3)中回收金属铜,并重新得到FeCl3溶液,设计如下实验流程:
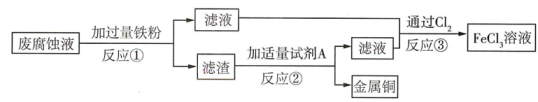
(已知:①2FeCl3+Fe=3FeCl2 , ②Cl2能将Fe2+氧化成Fe3+)
(1)、反应①②后都要进行的分离操作名称是。(2)、试剂A的名称是。(3)、反应③的基本反应类型是。12. 某无色溶液中可能含有Na+、H+、Cl-和SO42- , 现在想要检测两种阴离子是否存在,请你帮助完成实验:(1)、取适量溶液,先向其中滴加足量的溶液,若有白色沉淀生成,则证明有SO42-存在;(2)、再取上层清液加溶液,又出现白色沉淀,则可证明有Cl-存在。(3)、若要检测是否含有H+ , 可选用的一种试剂是。13. 某无色溶液中可能含有Na+ , H+ , Cl-和 ,现在想要检测两种阴离子是否存在,请你帮助完成实验:
(1)、取适量溶液,先向其中滴加足量的溶液,若有白色沉淀生成,则证明有
,现在想要检测两种阴离子是否存在,请你帮助完成实验:
(1)、取适量溶液,先向其中滴加足量的溶液,若有白色沉淀生成,则证明有 存在; (2)、再取上层清液加溶液,又出现白色沉淀,则可证明有Cl-存在。14. 某固体由 Ba2+、Cu2+、Na+、Cl-、 、 中的几种离子构成,取一定质量的该固体样品,进行如下实验:
存在; (2)、再取上层清液加溶液,又出现白色沉淀,则可证明有Cl-存在。14. 某固体由 Ba2+、Cu2+、Na+、Cl-、 、 中的几种离子构成,取一定质量的该固体样品,进行如下实验:①将固体溶于水得无色透明溶液,加入足量BaCl2溶液,过滤后得到5克白色沉淀。
②在沉淀中加入过量稀硝酸,仍有3克白色沉淀。
③在滤液中滴加AgNO3溶液,产生白色沉淀。
则
(1)、该固体中一定含有的离子 ,(2)、请设计简单实验证明可能存在的离子。15. 在Cu(NO3)2、Al(NO3)3和AgNO3的混合溶液中加入一定质量的铁粉,充分反应后过滤,向滤出的固体上滴加稀硫酸时有气泡产生。则反应后所得溶液中含有的金属离子有;反应后溶液的质量比原混合溶液的质量(填“大”或“小”);有关的化学方程式为(写出一个即可)。16. 将一定量的铜锌混合粉末放入盛有硝酸银溶液的烧杯中,不断搅拌,充分反应后过滤。向得到的滤渣和滤液中分别加入足量的稀盐酸,均无现象。则滤渣中一定有 , 一定没有。三、实验探究题
-
17. 菠菜中富含可溶性草酸盐和碳酸盐,与豆腐同食会引起结石。小科对这种说法产生了兴趣,并进行了“菠菜里是否含有可溶性草酸盐和碳酸盐?”的探究。已知:①可溶的草酸盐、碳酸盐能与CaCl2溶液反应生成难溶于水的草酸钙(CaC2O4)、碳酸钙。②醋酸(一种有机酸)不与草酸钙反应,但能与碳酸钙反应生成可溶性盐。探究流程如下:

根据流程回答问题:
(1)、操作①的名称是。(2)、加入足量CaCl2溶液的目的是。(3)、小科通过实验得出了“菠菜里含有可溶性草酸盐和碳酸盐”的结论,支持该结论的证据有:。18. 兴趣小组在课外实验中意外发现:将镁条放入碳酸钠溶液中,快速产生较多气泡,并有白色沉淀生成。小组同学通过查阅资料得知:镁能与水缓慢反应生成氢气;Na2CO3溶液中除含有 Na+ 、外,还含有请你与小组同学一起完成下列探究: (1)、产生气体真的是氢气吗?小敏选用图甲中的(选填“A”或“B”)作为反应装置,将适量镁条、Na2CO3溶液置于其中,按图乙所示方案进行检验。他根据“C中不变浑浊;D处气体燃烧,烧杯内壁有水珠”的现象,确认产生气体为氢气。小组同学讨论认为,要确认烧杯内壁的水珠是由氢气燃烧产生,需要对图乙装置进行的改进是;(2)、快速产生气体的原因是什么?按图丙所示方案进行实验,发现E、G中缓慢产生气泡,F中快速产生较多气泡。同学们由此得出:是(促进了镁与水的反应。则试剂X是.19. 某科学兴趣小组的同学为了鉴定某一溶液中是否含有SO4 , 他们设计了如下方案,并进行了实验。
(1)、产生气体真的是氢气吗?小敏选用图甲中的(选填“A”或“B”)作为反应装置,将适量镁条、Na2CO3溶液置于其中,按图乙所示方案进行检验。他根据“C中不变浑浊;D处气体燃烧,烧杯内壁有水珠”的现象,确认产生气体为氢气。小组同学讨论认为,要确认烧杯内壁的水珠是由氢气燃烧产生,需要对图乙装置进行的改进是;(2)、快速产生气体的原因是什么?按图丙所示方案进行实验,发现E、G中缓慢产生气泡,F中快速产生较多气泡。同学们由此得出:是(促进了镁与水的反应。则试剂X是.19. 某科学兴趣小组的同学为了鉴定某一溶液中是否含有SO4 , 他们设计了如下方案,并进行了实验。小英:取样品,滴加过量的稀硝酸,.如果没有明显现象,在溶液中滴加BaCl2溶液,如果有白色沉淀,说明溶液中有 。
小红:取样品,滴加过量的稀盐酸,.如果没有明显现象,在溶液中滴加BaCl2溶液,如果有白色沉淀,说明溶液中有
小王:取样品,滴加Ba(NO3)2溶液,如果有白色沉淀产生,对反应后的混合物进行过滤,向滤渣中滴加稀硝酸,如果滤渣不溶解。说明溶液中含有
(1)、请写出稀硫酸和Ba(NO3)2溶液反应的化学方程式 。(2)、对比小英和小红的实验方案,你认为谁的方法合理并说明理由:。(3)、小王的方案,向滤渣中滴加稀硝酸是为了排除 的干扰。20. 某溶液可能含CuSO4、HCl、MgCl2、Na2CO3中的几种,向其中加入一定溶质质量分数的Ba(OH)2溶液,反应中加入的Ba(OH)2溶液质量与产生沉淀的质量关系如图,回答下列问题。 (1)、ab段生成的沉淀是:(填写物质的化学式)。(2)、某同学说该溶液中一定没有CuSO4 , 他的理由是。(3)、a中溶液含有种溶质。(4)、原溶液中含有的溶质是。(填写物质的化学式)
(1)、ab段生成的沉淀是:(填写物质的化学式)。(2)、某同学说该溶液中一定没有CuSO4 , 他的理由是。(3)、a中溶液含有种溶质。(4)、原溶液中含有的溶质是。(填写物质的化学式)四、解答题
-
21. 某KCl固体样品中含有少量CaCl2杂质,现按如下流程提纯氯化钾。(氯化钾溶解度受温度影响较小)
 (1)、操作1的名称是。(2)、用150千克溶质质量分数为36%的浓盐酸配制7.2%的稀盐酸,需要加水千克。(3)、若KCl固体样品中还含有少量杂质K2SO4 , 请写出检验含有K2SO4的方法(请写出具体繰作、现象和结论)22. 将40g稀盐酸逐滴加入到20g溶质质量分数为4%的氢氧化钠溶液中,边滴加边搅拌。随着稀盐酸的滴加,溶液的pH变化如图一所示,溶液的温度变化如图二所示(不考虑反应过程中热量损失)。试回答:
(1)、操作1的名称是。(2)、用150千克溶质质量分数为36%的浓盐酸配制7.2%的稀盐酸,需要加水千克。(3)、若KCl固体样品中还含有少量杂质K2SO4 , 请写出检验含有K2SO4的方法(请写出具体繰作、现象和结论)22. 将40g稀盐酸逐滴加入到20g溶质质量分数为4%的氢氧化钠溶液中,边滴加边搅拌。随着稀盐酸的滴加,溶液的pH变化如图一所示,溶液的温度变化如图二所示(不考虑反应过程中热量损失)。试回答: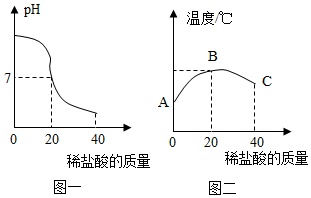 (1)、图二从A到B过程中,溶液的pH逐渐。(填“增大”或“减小”)。(2)、图二表示C点时的溶质是。(3)、计算稀盐酸中溶质的质量分数。23. 硝酸溶解废旧CPU所得溶液中含有Cu2+和Ag+ , 用适当浓度的盐酸、氯化钠溶液、氨水和铁粉,按照如图方法回收Cu和Ag(图中标注的试剂均不同)。
(1)、图二从A到B过程中,溶液的pH逐渐。(填“增大”或“减小”)。(2)、图二表示C点时的溶质是。(3)、计算稀盐酸中溶质的质量分数。23. 硝酸溶解废旧CPU所得溶液中含有Cu2+和Ag+ , 用适当浓度的盐酸、氯化钠溶液、氨水和铁粉,按照如图方法回收Cu和Ag(图中标注的试剂均不同)。 (1)、加入过量Fe粉发生的主要反应为 (写化学方程式)。(2)、试剂1和试剂3的名称依次是 。(3)、若向66g物质1中加入100g试剂2后,恰好完全反应,剩余固体质量为60.4g。求所得溶液中溶质的质量分数(写出计算过程,计算结果精确到0.1%)。
(1)、加入过量Fe粉发生的主要反应为 (写化学方程式)。(2)、试剂1和试剂3的名称依次是 。(3)、若向66g物质1中加入100g试剂2后,恰好完全反应,剩余固体质量为60.4g。求所得溶液中溶质的质量分数(写出计算过程,计算结果精确到0.1%)。