2023-2024学年 浙教版科学 九年级上册 期末复习重难点提升练 专题08 物质的转化规律(2)
试卷更新日期:2023-12-01 类型:复习试卷
一、选择题
-
1. 常温下,下列转化不能通过一步反应实现的是( )A、MgO→MgSO4 B、Fe2O3→Fc(OH)3 C、CO2→Na2CO3 D、HNO3→KNO32. 在给定条件下,下列选项所示的物质间转化能实现的是( )A、CuCuOCuSO4溶液 B、Fe2O3FeFeCl2溶液 C、FeFeCl3AgCl D、KOHK2CO3KCl溶液3. 总结归纳是学习科学的一种重要方法。如图,小宁归纳了初中物质之间的部分转化关系。下列说法中正确的是()
 A、符合转化规律②的一个化学反应可以表示为:CuO+ H2O=Cu(OH)2 B、根据转化规律⑦和⑧,部分金属能够转化成盐,但盐都能转化成金属 C、根据转化规律④,实验室可用熟石灰和纯碱反应制取苛性钠 D、在湿法炼铜中,将铁放入硫酸铜溶液中把铜置换出来是应用转化规律⑥4. 某化学小组进行金属与酸的反应后,想从含有Al2(SO4)3、CuSO4的废液中回收金属铜,设计了如图所示方案。针对该方案过程,分析正确的是( )
A、符合转化规律②的一个化学反应可以表示为:CuO+ H2O=Cu(OH)2 B、根据转化规律⑦和⑧,部分金属能够转化成盐,但盐都能转化成金属 C、根据转化规律④,实验室可用熟石灰和纯碱反应制取苛性钠 D、在湿法炼铜中,将铁放入硫酸铜溶液中把铜置换出来是应用转化规律⑥4. 某化学小组进行金属与酸的反应后,想从含有Al2(SO4)3、CuSO4的废液中回收金属铜,设计了如图所示方案。针对该方案过程,分析正确的是( ) A、操作a,操作b均为过滤 B、滤液B中可能含有Al3+ C、过程Ⅱ的现象是溶液由无色变为蓝色 D、最终回收到的铜质量大于固体A中的铜5. 下列物质间的转化关系,不能实现的是( )A、H2O2→H2O→H2CO3 B、Mg→MgO→MgSO4 C、KCl→KNO3→K2SO4 D、Cu(OH)2→CuSO4→CuCl26. “化学棋”游戏规则:①每粒棋子代表一种物质,②吃子:所选棋子能与棋盘(如图)中的某棋子发生反应,则棋盘中的该棋子被吃掉,③连吃:前一次反应的生成物能与另一棋子发生反应时,则该棋子也被吃掉。若一次就可连续吃掉棋盘上的所有棋子,应选择的棋子( )
A、操作a,操作b均为过滤 B、滤液B中可能含有Al3+ C、过程Ⅱ的现象是溶液由无色变为蓝色 D、最终回收到的铜质量大于固体A中的铜5. 下列物质间的转化关系,不能实现的是( )A、H2O2→H2O→H2CO3 B、Mg→MgO→MgSO4 C、KCl→KNO3→K2SO4 D、Cu(OH)2→CuSO4→CuCl26. “化学棋”游戏规则:①每粒棋子代表一种物质,②吃子:所选棋子能与棋盘(如图)中的某棋子发生反应,则棋盘中的该棋子被吃掉,③连吃:前一次反应的生成物能与另一棋子发生反应时,则该棋子也被吃掉。若一次就可连续吃掉棋盘上的所有棋子,应选择的棋子( ) A、
A、 B、
B、 C、
C、 D、
D、 7. 下列物质的转化在给定条件下均能实现的是( )A、AlAl2O3Al(OH)3 B、CuCu(NO3)2CuSO4 C、Na2CO3BaCO3BaSO4 D、CaCO3CO2CO8. 下列物质间的转化,通过一步化学反应不能实现的是( )A、NaNO3→Na2CO3 B、H2SO4→HCl C、Cu(OH)2→CuCl2 D、CaCl2→CaCO39. 从反应原理和产物纯度两个角度考虑,下列制取溶液的方案中最佳的是( )A、过量的稀硫酸与Fe2O3反应 B、过量的Fe粉与稀硫酸反应,过滤 C、过量的Fe2O3与稀硫酸反应,过滤 D、过量的Fe粉与CuSO4溶液反应,过滤10. 如图所示的转化关系中,每个转化在一定条件下均能按箭头方向一步实现的是( )
7. 下列物质的转化在给定条件下均能实现的是( )A、AlAl2O3Al(OH)3 B、CuCu(NO3)2CuSO4 C、Na2CO3BaCO3BaSO4 D、CaCO3CO2CO8. 下列物质间的转化,通过一步化学反应不能实现的是( )A、NaNO3→Na2CO3 B、H2SO4→HCl C、Cu(OH)2→CuCl2 D、CaCl2→CaCO39. 从反应原理和产物纯度两个角度考虑,下列制取溶液的方案中最佳的是( )A、过量的稀硫酸与Fe2O3反应 B、过量的Fe粉与稀硫酸反应,过滤 C、过量的Fe2O3与稀硫酸反应,过滤 D、过量的Fe粉与CuSO4溶液反应,过滤10. 如图所示的转化关系中,每个转化在一定条件下均能按箭头方向一步实现的是( ) A、只有①② B、只有①③ C、只有②③ D、①②③都是
A、只有①② B、只有①③ C、只有②③ D、①②③都是二、填空题
-
11. 小丽以化合价为纵坐标、物质类别为横坐标绘制如图。A、B、C、D、E是初中常见物质,且都含氧元素,各物质中均有某种组成元素的化合价与纵坐标的数值相对应。“→”表示物质间的转化关系,其中B通常为无色无味气体且能使澄清石灰水变浑浊,D的水溶液呈蓝色。请回答:
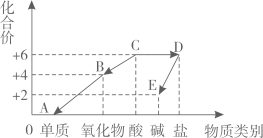 (1)、B→A可以通过植物的某一生理过程加以实现,这一生理过程指的是;(2)、物质C的化学式为;(3)、写出一个D→E的化学方程式。12. 如表中是几种常见的元素,请回答(均填化学式):
(1)、B→A可以通过植物的某一生理过程加以实现,这一生理过程指的是;(2)、物质C的化学式为;(3)、写出一个D→E的化学方程式。12. 如表中是几种常见的元素,请回答(均填化学式):元素名称
钠
铁
铝
氢
氯
氧
硫
(1)、上表元素中,在地壳中含量最多的金属元素和含量最多的非金属元素组成的化合物是;(2)、上表中的氢、氧元素可以组成两种氧化物,其中氧元素的化合价为-1价的氧化物是。13. 现有Ca(OH)2、Cu、CaO、CO、CaCl2、CuO、CO2、CaCO3八种物质,平均分成A、B二组(即每组4种物质不重复),“→”表示一步即能发生物质转化,根据如图所示的转化关系(图中反应条件均已略去),请回答: (1)、若A组的甲为CO2 , 写出将丁加入到稀盐酸中产生的实验现象:。(2)、若B组的丁为CaCl2 , 写出丙加入到FeCl3溶液中,与FeCl3溶液发生反应的化学方程式:。14. 氯化钡是一种可溶性重金属盐。广泛应用于化工领城,其水溶液呈中性。工业上用毒重石(主要成分是碳酸钡)制备氯化钡晶体。某实验小组模拟工业上制备氯化钡晶体的流程,设计了实验室中制备氯化钡晶体的方案。实验流程如图所示(该毒重石样品所含杂质难溶于水且不与酸反应)。
(1)、若A组的甲为CO2 , 写出将丁加入到稀盐酸中产生的实验现象:。(2)、若B组的丁为CaCl2 , 写出丙加入到FeCl3溶液中,与FeCl3溶液发生反应的化学方程式:。14. 氯化钡是一种可溶性重金属盐。广泛应用于化工领城,其水溶液呈中性。工业上用毒重石(主要成分是碳酸钡)制备氯化钡晶体。某实验小组模拟工业上制备氯化钡晶体的流程,设计了实验室中制备氯化钡晶体的方案。实验流程如图所示(该毒重石样品所含杂质难溶于水且不与酸反应)。 (1)、步骤①中发生反应的化学方程式为:。(2)、滤液II是30℃时氯化钡的饱和溶液,请说明原因:。(3)、关于上述实验方案的相关内容,下列说法正确的是 (填字母)。A、氯化钡是一种有毒的物质,使用时应注意安全 B、该实验流程中得到的副产品二氧化碳是重要的化工原料 C、可用重晶石(主要成分是硫酸钡)代替该实验流程中的毒重石制备氯化钡晶体 D、步骤②将滤渣进行水洗,既能提高氯化钡晶体的产率,又能减少Ba2+对环境的污染15. 小政同学在复习Ca(OH)2的化学性质时,归纳出了Ca(OH)2与其他物质间相互反应的关系如图(图中“——”表示相连的两种物质能发生反应)。
(1)、步骤①中发生反应的化学方程式为:。(2)、滤液II是30℃时氯化钡的饱和溶液,请说明原因:。(3)、关于上述实验方案的相关内容,下列说法正确的是 (填字母)。A、氯化钡是一种有毒的物质,使用时应注意安全 B、该实验流程中得到的副产品二氧化碳是重要的化工原料 C、可用重晶石(主要成分是硫酸钡)代替该实验流程中的毒重石制备氯化钡晶体 D、步骤②将滤渣进行水洗,既能提高氯化钡晶体的产率,又能减少Ba2+对环境的污染15. 小政同学在复习Ca(OH)2的化学性质时,归纳出了Ca(OH)2与其他物质间相互反应的关系如图(图中“——”表示相连的两种物质能发生反应)。 (1)、若X是与其他三种不同类别的化合物,则X可以是。(写化学式)(2)、根据圈中所示的物质问的关系,写出其中两个化学方程式:
(1)、若X是与其他三种不同类别的化合物,则X可以是。(写化学式)(2)、根据圈中所示的物质问的关系,写出其中两个化学方程式:①;
②。
三、实验探究题
-
16. 某气体可能由CO、CO2、H2、HCl中的一种或几种组成,为研究其组成,某兴趣小组的同学按下列装置进行如下的实验(有些固定装置已经省去)。

请回答:
(1)、若该气体中含有H2 , 则能观察到的实验现象是。(2)、按上述装置进行实验,观察到A处没有明显现象,据此现象,你能确定气体中CO2的存在吗?若能,请说明理由。若不能,请你在不影响其他气体检验的前提下,对上述装置提一个简单的改进方案,使实验能确定CO2是否存在。填(“能”或者“不能”),理由或改进方案为。17. 碳酸钠是玻璃、造纸、肥皂、洗涤剂、纺织、制革等工业的重要原料。我国化学家侯德榜对制碱工业有重大贡献,他发明的制碱方法,被誉为“侯氏制碱法”,其生产工艺流程示意图如下:整个过程中涉及的主要反应有:
①NH3+H2O+CO2=NH4HCO3
②NH4HCO3+NaCl=NH4Cl +NaHCO3(晶体)
③2NaHCO3Na2CO3+H2O+CO2↑
请问答下列问题:
(1)、碳酸钠属于(填“酸"、“碱”或盐”)。(2)、X遇碱溶液会生成刺激性气味的气体,此气体可使紫色石蕊试液变色。若要通过实验区分X和另一种氮肥硝酸铵,常用的试剂是溶液。(3)、X是滤液中最主要的成分,X与Ca(OH)2反应的产物之一可用于该生产工艺流程的循环使用,该产物的名称为。18. 医用氯化钙可用于补钙、抗过敏和消炎等。生产医用的二水合氯化钙(CaCl2·2H2O)常以工业碳酸钙(含少量杂质铝离子、铁离子)为原料,主要经过溶解、除杂、过滤、酸化、蒸发结晶等过程,其工艺流程如图所示: (1)、在溶解和酸化的操作过程中,加入的酸是。(2)、除杂操作的方法是加入适量的氢氧化钙,然后将所得沉淀过滤,滤渣中一定含有的成分是(填化学式)。
(1)、在溶解和酸化的操作过程中,加入的酸是。(2)、除杂操作的方法是加入适量的氢氧化钙,然后将所得沉淀过滤,滤渣中一定含有的成分是(填化学式)。四、解答题
-
19. 如图是实验室模拟工业上用大理石(含少量Fe2O3和SiO2)为原料提纯碳酸钙的实验流程。已知:①SiO2不溶于水也不溶于酸 ②氨水呈碱性,与盐酸反应的化学方程式为:NH3•H2O+HCl═NH4Cl+H2O,请回答问题:
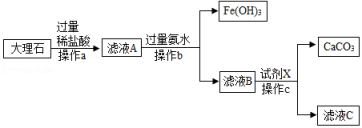 (1)、操作a中需要用到的玻璃仪器有烧杯、玻璃棒和。(2)、写出滤液A中加氨水生成Fe(OH)3的化学方程式:。(3)、滤液B中加入试剂X,恰好完全反应,若滤液C中只含有两种溶质,则试剂X的化学式为。20. 某矿石由MgO、Fe2O3和SiO2组成其制备氢氧化镁的流程示意图如图:
(1)、操作a中需要用到的玻璃仪器有烧杯、玻璃棒和。(2)、写出滤液A中加氨水生成Fe(OH)3的化学方程式:。(3)、滤液B中加入试剂X,恰好完全反应,若滤液C中只含有两种溶质,则试剂X的化学式为。20. 某矿石由MgO、Fe2O3和SiO2组成其制备氢氧化镁的流程示意图如图:
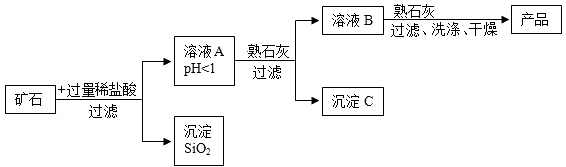 (1)、加入稀盐酸反应后,能采用过滤方法分离A与SiO2的原因是。(2)、在溶液A中加入熟石灰固体调节溶液的.pH,可以使溶液中的阳离子转化为沉淀。该实验条件下,使金属阳离子沉淀的相关pH数据见下表。现调节溶液B的pH值范围是4- 8,目的是 。
(1)、加入稀盐酸反应后,能采用过滤方法分离A与SiO2的原因是。(2)、在溶液A中加入熟石灰固体调节溶液的.pH,可以使溶液中的阳离子转化为沉淀。该实验条件下,使金属阳离子沉淀的相关pH数据见下表。现调节溶液B的pH值范围是4- 8,目的是 。氢氧化物
Fe(OH)3
Mg(OH)2
开始沉淀的 pH
1.5
8.6
完全沉淀的 pH
3.2
11.1
(3)、该实验过程中,熟石灰固体比氢氧化钠固体能更精确地调节溶液的pH,理由是。21. A、B、C、D、E 五种化合物都含有钙元素,他们有如下图所示的转化关系。 (1)、推断X、Y 两种试剂的化学式:X:Y:(2)、写出下列反应的化学方程式:D→C:; E→A:; B→E:。
(1)、推断X、Y 两种试剂的化学式:X:Y:(2)、写出下列反应的化学方程式:D→C:; E→A:; B→E:。