2023-2024学年 浙教版科学 九年级上册 期末复习重难点提升练 专题03 几种重要的盐
试卷更新日期:2023-11-29 类型:复习试卷
一、选择题
-
1. 室温时,在氢氧化钠液与盐酸盐反应中,测得溶液的pH随滴入溶液体积变化情况如图所示。结合坐标图分析,小科分析合理的是( )
 A、这个反应不是复分解反应 B、向某酸溶液加入水稀释,其pH变化也符合本坐标图像 C、当滴入溶液体积为5mL时,所得溶液中只含一种溶质 D、该实验是将氢氧化钠溶液滴入盐酸中2. 已知反应CuCl2+2NaOH=Cu(OH)2↓+2NaCl。向一定量盐酸和氯化铜溶液的混合物中逐滴加入氢氧化钠溶液,产生沉淀的质量与加入氢氧化钠溶液的质量关系如图所示。下列说法正确的是( )
A、这个反应不是复分解反应 B、向某酸溶液加入水稀释,其pH变化也符合本坐标图像 C、当滴入溶液体积为5mL时,所得溶液中只含一种溶质 D、该实验是将氢氧化钠溶液滴入盐酸中2. 已知反应CuCl2+2NaOH=Cu(OH)2↓+2NaCl。向一定量盐酸和氯化铜溶液的混合物中逐滴加入氢氧化钠溶液,产生沉淀的质量与加入氢氧化钠溶液的质量关系如图所示。下列说法正确的是( ) A、Р点表示的溶液pH=7 B、N点表示的溶液中含有一种溶质 C、从M点到N点溶液质量增加20g D、P点表示的溶液比N点表示的溶液中氯化钠的质量分数大3. “庄稼一枝花,全靠肥当家”。化学肥料与传统农家肥配合使用,对促进农作物增产、解决粮食短缺问题起重要作用。下列属于复合肥料的是( )A、NH4NO3 B、NH4H2PO4 C、CO(NH2)2 D、KHCO34. 某K2CO3样品中含有Na2CO3、MgCO3、CuSO4、NaCl中的一种或几种。取该样品13.8g,加入100g稀盐酸中,恰好完全反应,得到无色溶液,同时产生气体的质量为m。下列判断错误的是( )A、反应后得到无色溶液,说明样品中一定没有CuSO4 B、若m>4.4g,则样品的组成最多有3种可能 C、若m=4.4g,则样品中一定含有NaCl D、若m=4.4g,所加稀盐酸中溶质的质量分数为7.3%5. 下列物质名称、俗称、化学式完全正确的是( )A、氢氧化钠 苛性钠NaOH B、碳酸钠 烧碱Na2CO3 C、氧化钙 熟石灰Ca(OH)2 D、硫酸铜 胆矾ZnSO4·5H2O6. 下列化学反应中,属于复分解反应的是( )A、CO2+Ca(OH)2=CaCO3↓+H2O B、NaCl+AgNO3=AgCl↓+NaNO3 C、Mg+2HCl=MgCl2+H2↑ D、CO2+H2O=H2CO37. 甲、乙两化工厂分布如图所示,箭头代表水流方向。在a处取样检测水中阴离子只有少量OH−、SO42- , 在c处取样检测pH=7,且只含有少量NaCl。则b处水中含有的物质应是下列哪一组( )
A、Р点表示的溶液pH=7 B、N点表示的溶液中含有一种溶质 C、从M点到N点溶液质量增加20g D、P点表示的溶液比N点表示的溶液中氯化钠的质量分数大3. “庄稼一枝花,全靠肥当家”。化学肥料与传统农家肥配合使用,对促进农作物增产、解决粮食短缺问题起重要作用。下列属于复合肥料的是( )A、NH4NO3 B、NH4H2PO4 C、CO(NH2)2 D、KHCO34. 某K2CO3样品中含有Na2CO3、MgCO3、CuSO4、NaCl中的一种或几种。取该样品13.8g,加入100g稀盐酸中,恰好完全反应,得到无色溶液,同时产生气体的质量为m。下列判断错误的是( )A、反应后得到无色溶液,说明样品中一定没有CuSO4 B、若m>4.4g,则样品的组成最多有3种可能 C、若m=4.4g,则样品中一定含有NaCl D、若m=4.4g,所加稀盐酸中溶质的质量分数为7.3%5. 下列物质名称、俗称、化学式完全正确的是( )A、氢氧化钠 苛性钠NaOH B、碳酸钠 烧碱Na2CO3 C、氧化钙 熟石灰Ca(OH)2 D、硫酸铜 胆矾ZnSO4·5H2O6. 下列化学反应中,属于复分解反应的是( )A、CO2+Ca(OH)2=CaCO3↓+H2O B、NaCl+AgNO3=AgCl↓+NaNO3 C、Mg+2HCl=MgCl2+H2↑ D、CO2+H2O=H2CO37. 甲、乙两化工厂分布如图所示,箭头代表水流方向。在a处取样检测水中阴离子只有少量OH−、SO42- , 在c处取样检测pH=7,且只含有少量NaCl。则b处水中含有的物质应是下列哪一组( ) A、MgSO4、NaCl B、BaCl2、HCl C、H2SO4、Ba(NO3)2 D、H2SO4、MgCl28. 下列物质的名称、俗称、化学式一致的是( )A、氯化钠、食盐、NaCl B、氢氧化钠、纯碱、NaOH C、氢氧化钙、生石灰、Ca(OH)2 D、碳酸钠、小苏打、Na2CO39. 如果发现农田里的作物叶色发黄,并且茎杆软弱容易倒伏,应该施用下列化肥( )A、Ca3(PO4)2 B、KNO3 C、K2CO3 D、NH4H2PO410. 温州瓯柑享誉全国,为了预防瓯柑出现生长迟缓,叶色发黄的现象,果农常施复合肥。下列属于复合肥的是( )A、K2CO3 B、CO(NH2)2 C、Ca(H2PO4)2 D、KNO3
A、MgSO4、NaCl B、BaCl2、HCl C、H2SO4、Ba(NO3)2 D、H2SO4、MgCl28. 下列物质的名称、俗称、化学式一致的是( )A、氯化钠、食盐、NaCl B、氢氧化钠、纯碱、NaOH C、氢氧化钙、生石灰、Ca(OH)2 D、碳酸钠、小苏打、Na2CO39. 如果发现农田里的作物叶色发黄,并且茎杆软弱容易倒伏,应该施用下列化肥( )A、Ca3(PO4)2 B、KNO3 C、K2CO3 D、NH4H2PO410. 温州瓯柑享誉全国,为了预防瓯柑出现生长迟缓,叶色发黄的现象,果农常施复合肥。下列属于复合肥的是( )A、K2CO3 B、CO(NH2)2 C、Ca(H2PO4)2 D、KNO3二、填空题
-
11. 生活无处不科学,在稀硫酸、熟石灰、氢氧化钠、纯碱、硫酸铜粉末、硝酸钾中选择合适的物质,将其化学式填入下列空格中:(1)、可改良酸性土壤的碱是;(2)、可用做复合肥的是。12. “价类图”是以化合价为纵坐标、物质类别为横坐标绘制的图像,它能将散乱的科学知识联系在一起,有助于对科学问题的理解和整体认知。如图所示为含氯元素的物质的价类图,其中“→”表示物质间的转化关系。请回答:
 (1)、A和氢氧化钾反应生成D和水,则该反应属于基本反应类型中的。(2)、物质C的化学式为。13. “海水稻”是一种可在海边、滩涂等呈弱碱性的盐碱地生长的特殊水稻,目前已在我国开始推广种植。这是“杂交水稻之父”袁隆平院士留给世界的巨大遗产。(1)、盐碱地土壤溶液的pH7。(填“>”或“=”或“<”)(2)、“海水稻”生长过程中需要施加化肥。下列属于复合肥料的是____。A、CO(NH2)2 B、Ca3(PO4)2 C、KNO314. 人类对敬的认识经历了漫长的时间,其主要理论发展如下:
(1)、A和氢氧化钾反应生成D和水,则该反应属于基本反应类型中的。(2)、物质C的化学式为。13. “海水稻”是一种可在海边、滩涂等呈弱碱性的盐碱地生长的特殊水稻,目前已在我国开始推广种植。这是“杂交水稻之父”袁隆平院士留给世界的巨大遗产。(1)、盐碱地土壤溶液的pH7。(填“>”或“=”或“<”)(2)、“海水稻”生长过程中需要施加化肥。下列属于复合肥料的是____。A、CO(NH2)2 B、Ca3(PO4)2 C、KNO314. 人类对敬的认识经历了漫长的时间,其主要理论发展如下:①朴素理论:与酸作用时失去它原来的性质,而且能使商酞试液变红的物质一定是碱
②电离理论:能够在水溶液中产生氢氧根离子的化合物就是碱。
③经验理论:有涩味的物质就是碱。
(1)、朴素理论是错误的,请举出一种物质加以反驳:(2)、根据电离理论,酸和碱反应的本质是(3)、随着研究技术的发展,人类对物质的认识经历游从宏观到微观,从现次到本质的过程,上述对碱的认识发展由先到后的顺序是( 填序号)15. 物质的用途与其性质密切相关。(1)、浓硫酸常用来干燥气体,其原因是浓硫酸有性。(2)、生石灰常用作食品干燥剂,其原因是(用化学方程式表示)。(3)、碳酸氢钠可用于治疗胃酸(主要成分是盐酸)过多,其原因是(用化学方程式表示)。(4)、硅是信息技术的关键材料。高温下氢气与四氯化硅(SiCI4)反应可制得高纯度的硅,同时生成氯化氢。该反应的化学方程式为。三、实验探究题
-
16. 为测定石灰石样品中碳酸钙含量,某小组同学在一定量的样品中加入足量稀盐酸,利用生成CO2的质量来测定(忽略稀盐酸挥发的影响)。
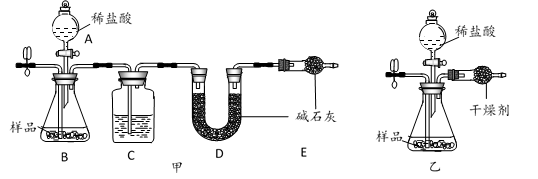 (1)、小科用图甲装置实验,通过测定反应前后D装置质量的变化来得到CO2质量。为了避免水蒸气对实验的影响,使测量结果更准确,装置C中应装入(填试剂名称)。(2)、小明用图乙装置实验,通过测定反应前后装置总质量的变化来得到CO2质量。他用碱石灰做干燥剂,请判断这种做法是否合理并说出理由。(3)、实验时,正确选择干燥剂后,两装置均可通过左侧导管鼓入某种气体一段时间,来进一步减小误差。下列操作可行的是____。
(1)、小科用图甲装置实验,通过测定反应前后D装置质量的变化来得到CO2质量。为了避免水蒸气对实验的影响,使测量结果更准确,装置C中应装入(填试剂名称)。(2)、小明用图乙装置实验,通过测定反应前后装置总质量的变化来得到CO2质量。他用碱石灰做干燥剂,请判断这种做法是否合理并说出理由。(3)、实验时,正确选择干燥剂后,两装置均可通过左侧导管鼓入某种气体一段时间,来进一步减小误差。下列操作可行的是____。选项
实验装置
反应开始前鼓入的气体
反应结束后鼓入的气体
A
甲
氮气
氮气
B
甲
干燥空气
干燥空气
C
乙
氮气
氮气
D
乙
干燥空气
干燥空气
A、A B、B C、C D、D17. 如图甲所示,小乐向盛有一定量CuSO4溶液的烧杯中滴入过量的Na2CO3溶液,发现烧杯底部有蓝色固体生成。小乐对蓝色固体的成分进行了如下探究;[建立猜想]①固体为CuCO3;②固体为Cu(OH)2;③固体为Cu(OH)2和CuCO3的混合物。
[设计实验]已知:Cu(OH)2、CuCO3受热易分解[Cu(OH)2的分解温度为66℃~68℃,CuCO3的分解温度为200℃﹣220℃],各生成对应的两种氧化物。
步骤1:将烧杯中的混合物进行过滤,并对蓝色固体进行洗涤、低温烘干;
步骤2:取一定量的蓝色固体,用如图乙所示装置和药品,定性分析其成分;
步骤3:另取一定量的蓝色固体,用热分析仪对其进行热分解,定量测定其成分。
 (1)、判断蓝色固体已洗净的方法及现象:。(2)、若通过定性实验验证了猜想③正确,则观察到的实验现象是 。(3)、通过热分析仪对固体进行热分解,获得相关数据,绘成固体质量变化与分解温度的关系如图丙所示,可以计算得到Cu(OH)2的质量为 g。18. 某KNO3化肥中可能混进了NH4Cl、(NH4)2SO4、K2CO3三种物质中的一种或几种,同学们对该化肥开展了以下探究活动。(1)、探究一:取少量化肥样品与熟石灰,在研钵中混合研磨,有刺激性气味的气体产生,该气体的化学式为 , 它能使湿润的红色石蕊试纸变蓝色。(2)、探究二:另取少量化肥样品溶于水得到溶液A,按图进行实验,现象如图中所述,请回答下列问题:
(1)、判断蓝色固体已洗净的方法及现象:。(2)、若通过定性实验验证了猜想③正确,则观察到的实验现象是 。(3)、通过热分析仪对固体进行热分解,获得相关数据,绘成固体质量变化与分解温度的关系如图丙所示,可以计算得到Cu(OH)2的质量为 g。18. 某KNO3化肥中可能混进了NH4Cl、(NH4)2SO4、K2CO3三种物质中的一种或几种,同学们对该化肥开展了以下探究活动。(1)、探究一:取少量化肥样品与熟石灰,在研钵中混合研磨,有刺激性气味的气体产生,该气体的化学式为 , 它能使湿润的红色石蕊试纸变蓝色。(2)、探究二:另取少量化肥样品溶于水得到溶液A,按图进行实验,现象如图中所述,请回答下列问题:
①白色沉淀E是 。
②小明认为由探究二可以确定该化肥中一定混进了NH4Cl和(NH4)2SO4、一定没有K2CO3 , 小强认为这个结论不正确,请说明原因并写出你的改进方案 。
(3)、按照改进后的方案来完成探究二,最终的溶液D中一定存在的溶质是(写化学式) , 该废液不能直接排放。19. 豆腐是一种营养丰富又历史悠久的食材,大众对豆腐的喜爱推动了豆腐制作工艺的发展。在豆腐加工时需加入凝固剂,凝固剂的化学成分是什么?通过查阅资料获悉:凝固剂中可能含有Na2SO4、Ca(OH)2、MgCl2、NaCl等,为验证其成分,某同学进行了如下实验:步骤
实验操作
实验现象
实验结论
1
取少量凝固剂溶液于试管中,加入几滴无色酚酞试液
仍为无色溶液
凝固剂中不含①
2
再取少量凝固剂溶液于试管中,加入过量的硝酸钡溶液
有②产生
凝固剂中含有硫酸钠
3
取实验2中的适量滤液于试管中,加入适量的AgNO3溶液和稀HNO3
有白色沉淀
凝固剂中含有氯化钠
(1)、请把表格内容填写完整:① ②(2)、有同学认为步骤3的结论不严密,理由是氯化镁中也含有氯离子,为确认滤液中是否含有氯化镁,可选用的试剂。20. 保险粉(化学式 Na2S2O4)在工农业生产中有广泛的用途,Na2S2O4 在碱性溶液中稳定,在中性和酸性溶液中极不稳定;在 NaCl 存在下,Na2S2O4 在水中溶解度显著下降。Na2S2O4 制备流程如下: (1)、反应Ⅰ的原理为:Zn+2SO2=ZnS2O4 , 该反应类型为。(2)、反应Ⅱ为复分解反应,该反应的化学方程式为 。(3)、操作a的名称为。
(1)、反应Ⅰ的原理为:Zn+2SO2=ZnS2O4 , 该反应类型为。(2)、反应Ⅱ为复分解反应,该反应的化学方程式为 。(3)、操作a的名称为。四、解答题
-
21. 食用碱的主要成分是Na2CO3(含有少量NaCl),研究小组为测定市售食用碱中Na2CO3的含量,设计了如图所示实验装置。

取12克食用碱样品放入锥形瓶进行实验。按定量测定实验的正确步骤,进行规范操作,并用电子天平对某一装置进行连续称重,直至该装置质量不再改变时停止实验,此时该装置质量增加了4.4克。(假设每步吸收都完全,ACDE装置中试剂均过量)
回答下列问题:
(1)、装置A的作用是;(2)、根据某装置质量不再改变时,作为停止实验的依据,则该装置应该是;(3)、计算食用碱中Na2CO3的质量分数?22. 实验室有一变质的氢氧化钠固体样品(样品中只含碳酸钠杂质,且成分均匀),某同学为测量样品中Na2CO3的质量分数,实验过程及结果记录如下图。(相关反应化学方程式:Na2CO3+CaCl2=CaCO2↓+2NaCl;NaOH+HCl=NaCl+H2O;Na2CO3+2HCl=2NaCl+H2O+CO2↑) (1)、过滤时玻璃棒的作用是。(2)、计算样品中NaCO3的质量分数。(3)、实验发现:往样品溶液中加稀盐酸,若氢氧化钠溶液不变质,不会产生二氧化碳;氢氧化钠变质的量越多,产生的二氧化碳越多;氢氧化钠完全变质,产生的二氧化碳最多。于是小明推测:样品中氢氧化钠变质的量越多,完全反应所需的稀盐酸的质量越大。请判断小明的推测是否正确并说明理由。23. 小明在实验室里做:“氧化铜与盐酸反应”的实验,观察到溶液逐渐变成绿色,向这绿色溶液中加水,则溶液为蓝色。为解释这种现象,他查阅以下资料:
(1)、过滤时玻璃棒的作用是。(2)、计算样品中NaCO3的质量分数。(3)、实验发现:往样品溶液中加稀盐酸,若氢氧化钠溶液不变质,不会产生二氧化碳;氢氧化钠变质的量越多,产生的二氧化碳越多;氢氧化钠完全变质,产生的二氧化碳最多。于是小明推测:样品中氢氧化钠变质的量越多,完全反应所需的稀盐酸的质量越大。请判断小明的推测是否正确并说明理由。23. 小明在实验室里做:“氧化铜与盐酸反应”的实验,观察到溶液逐渐变成绿色,向这绿色溶液中加水,则溶液为蓝色。为解释这种现象,他查阅以下资料:资料一:氯化铜溶液中的Cu2+会与H2O、Cl-相结合,分别形成呈蓝色物质1和呈黄色物质2。Cu2+与H2O、Cl-相结合的数量会随着氯化铜溶液浓度的改变而发生变化,从而使呈蓝色物质1和黄色物质2的数量发生变化。
资料二:根据光学原理,颜色可调。例如:蓝色+黄色=绿色。
请解释原因: