2023-2024学年 浙教版科学 九年级上册 期末复习重难点提升练 专题02 常见的碱
试卷更新日期:2023-11-29 类型:复习试卷
一、选择题
-
1. 如图,将盛有熟石灰饱和溶液的试管放到盛有适量水的烧杯中,然后往烧杯里的蒸馏水中加入某物质,其中能使熟石灰的溶质质量分数变小的是( )
 A、蔗糖 B、硝酸铵 C、氢氧化钠 D、氯化钠2. 下列现象描述以及对现象的解释叙述不正确的是( )A、浓盐酸敞口放置质量会变小,因为浓盐酸易挥发 B、浓硫酸敞口放置质量会变大,因为浓硫酸具有吸水性 C、固态氢氧化钠可以做二氧化碳的干燥剂,因为它具有潮解吸水的性质 D、盐酸可用来除铁锈,因为盐酸会与铁锈反应3. 某锥形瓶内盛有盐酸和氯化铜的混合溶液100g,向其中加入溶质质量分数为10%的氢氧化钠溶液,锥形瓶内溶液质量m1与加入的氢氧化钠溶液质量m2的变化关系如图所示。下列说法错误的是( )
A、蔗糖 B、硝酸铵 C、氢氧化钠 D、氯化钠2. 下列现象描述以及对现象的解释叙述不正确的是( )A、浓盐酸敞口放置质量会变小,因为浓盐酸易挥发 B、浓硫酸敞口放置质量会变大,因为浓硫酸具有吸水性 C、固态氢氧化钠可以做二氧化碳的干燥剂,因为它具有潮解吸水的性质 D、盐酸可用来除铁锈,因为盐酸会与铁锈反应3. 某锥形瓶内盛有盐酸和氯化铜的混合溶液100g,向其中加入溶质质量分数为10%的氢氧化钠溶液,锥形瓶内溶液质量m1与加入的氢氧化钠溶液质量m2的变化关系如图所示。下列说法错误的是( )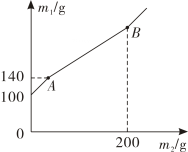 A、反应至A点时,所加NaOH溶液的质量为40g B、反应至A点时,溶液中的溶质有CuCl2和NaCl C、反应至B点时,锥形瓶内溶液的质量为280.4g D、反应至B点时,锥形瓶内溶液中NaCl的质量为23.4g4. 向氯化铁溶液中滴入几滴氢氧化钠溶液,可观察到的现象是( )A、
A、反应至A点时,所加NaOH溶液的质量为40g B、反应至A点时,溶液中的溶质有CuCl2和NaCl C、反应至B点时,锥形瓶内溶液的质量为280.4g D、反应至B点时,锥形瓶内溶液中NaCl的质量为23.4g4. 向氯化铁溶液中滴入几滴氢氧化钠溶液,可观察到的现象是( )A、 B、
B、 C、
C、 D、
D、 5. 下列物质露置在空气中,会发生化学反应且质量增加的是( )A、氢氧化钠固体 B、浓硫酸 C、浓盐酸 D、氢氧化铜6. 物质性质决定它的用途,还决定了它的保存方法。固体NaOH具有以下性质:①白色片状固体②有腐蚀性③易吸收水分而潮解④易溶于水,溶解放热⑤能与空气中的二氧化碳反应。实验室中必须将它密封保存的主要原因是( )A、①② B、①②③ C、②③④ D、③⑤7. 向装有50g稀硫酸的小烧杯中,不断慢慢滴加10%的Ba(OH)2溶液至过量。小烧杯中有关量的变化情况见下图。其中肯定不正确的是( )A、
5. 下列物质露置在空气中,会发生化学反应且质量增加的是( )A、氢氧化钠固体 B、浓硫酸 C、浓盐酸 D、氢氧化铜6. 物质性质决定它的用途,还决定了它的保存方法。固体NaOH具有以下性质:①白色片状固体②有腐蚀性③易吸收水分而潮解④易溶于水,溶解放热⑤能与空气中的二氧化碳反应。实验室中必须将它密封保存的主要原因是( )A、①② B、①②③ C、②③④ D、③⑤7. 向装有50g稀硫酸的小烧杯中,不断慢慢滴加10%的Ba(OH)2溶液至过量。小烧杯中有关量的变化情况见下图。其中肯定不正确的是( )A、 B、
B、 C、
C、 D、
D、 8. 对于碱,下列说法正确的是( )A、碱一定含有H元素 B、可使酚酞变红的都是碱溶液 C、所有非金属氧化物都可与碱溶液反应 D、酸与碱反应一定不产生沉淀9. Fe(OH)2易被空气中的氧气氧化为Fe(OH)3 , 为了能较长时间观察到Fe(OH)2白色絮状沉淀,设计了如图所示实验。下列叙述错误的是( )
8. 对于碱,下列说法正确的是( )A、碱一定含有H元素 B、可使酚酞变红的都是碱溶液 C、所有非金属氧化物都可与碱溶液反应 D、酸与碱反应一定不产生沉淀9. Fe(OH)2易被空气中的氧气氧化为Fe(OH)3 , 为了能较长时间观察到Fe(OH)2白色絮状沉淀,设计了如图所示实验。下列叙述错误的是( ) A、打开止水夹,能将装置中的空气排出 B、关闭止水夹,不能将B中的溶液压入A中 C、装置A,B中的液体接触后不会产生白色絮状沉淀 D、如果实验中观察到红褐色沉淀,可能是止水夹关闭过早10. 下列各组物质相互接触,能发生化学反应却无明显现象的是( )A、氢氧化钠溶液与盐酸 B、氢氧化钡溶液与硫酸铜溶液 C、氧化铁与盐酸 D、石灰石与盐酸
A、打开止水夹,能将装置中的空气排出 B、关闭止水夹,不能将B中的溶液压入A中 C、装置A,B中的液体接触后不会产生白色絮状沉淀 D、如果实验中观察到红褐色沉淀,可能是止水夹关闭过早10. 下列各组物质相互接触,能发生化学反应却无明显现象的是( )A、氢氧化钠溶液与盐酸 B、氢氧化钡溶液与硫酸铜溶液 C、氧化铁与盐酸 D、石灰石与盐酸二、填空题
-
11. “果导片”是一种常用缓泻剂,主要成分是酚酞。(1)、某同学欲将其作为酚酞指示剂的替代品,他将“果导片”研成粉末放入酒精中,搅拌、静置,取上层清液滴入澄清石灰水中发现 , 因此确定“果导片”可作酸碱指示剂使用。(2)、当他用饮料吸管向滴有“果导片”清液的澄清石灰水中吹气时,观察到。12. 实验室里几种物质在向同学们做“自我介绍”,请把内容补充完整。(1)、浓硫酸,因为我有性,在空气中放置一段时间我的质量增加了。(2)、烧碱固体暴露在空气中会吸收变质了。(3)、浓盐酸,因为我有挥发性,在空气中放置一段时间我的质量分数 。13. 实验室里几种物质在向同学们依“自我介绍”,特把内容补充完整。(1)、浓硫酸,因为我有 , 在空气中放置一段时间我的质量增加了.(2)、烧碱固体暴露在空气中会吸收 变质了。(3)、浓盐酸,因为我有挥发性,在空气中放置一段时间我的质量分数14. 氢氧化钠和氢氧化钙是实验室常见的两种碱,它们之间有许多相似之处。(1)、氢氧化钠和氢氧化钙具有相似的化学性质,原因是它们在电离时都产生了 , (填微粒符号)都能使酚酞变色。(2)、氢氧化钠和氢氧化钙溶液都是无色透明的液体。请选用下列任意一种物质鉴别它们 , 并写出相应的化学方程式
A.CO2 B.Na2CO3 C.无色酚酞15. 某小组通过如下四组实验对稀硫酸部分化学性质进行验证:①Mg和稀硫酸;②MgO和稀硫酸;③Ba(NO3)2溶液和稀硫酸;④NaOH溶液和稀硫酸。实验结束后将所有反应后的溶液混合进行了如图操作,请分析并回答下列问题: (1)、操作①的名称为。(2)、实验④无明显现象,再将打磨过的铁丝浸入该实验后的溶液中,仍无明显现象,据此(填“能”或“不能”)验证NaOH溶液和H2SO4发生反应。(3)、滤液b的成分中一定含有。(用化学式表示)
(1)、操作①的名称为。(2)、实验④无明显现象,再将打磨过的铁丝浸入该实验后的溶液中,仍无明显现象,据此(填“能”或“不能”)验证NaOH溶液和H2SO4发生反应。(3)、滤液b的成分中一定含有。(用化学式表示)三、实验探究题
-
16. 电导率和pH传感器可辅助探究复分解反应的实质。某兴趣小组运用电导率和pH传感器探究硫酸和氢氧化钡溶液的反应。实验装置如图甲所示,实验数据如图乙所示。注:电导率是以数字表示的溶液传导电流的能力,单位以微西门子每厘米(μS/cm)表示。
根据以上信息回答下列问题:
 (1)、实验开始时,溶液电导率较高的原因是溶液含有大量自由移动的离子(写离子符号)。(2)、如图乙,C点电导率最低的原因是;(3)、将恒压滴液漏斗中液体换成以下哪种溶液,测得电导率图像与图乙相似____;(可多选)A、HCl B、CuSO4 C、MgSO4 D、NaNO317. 化学兴趣小组的同学在帮助老师整理实验室时,意外地发现实验桌上有一瓶敞口放置的氢氧化钙粉末.于是对该粉末进行了如下探究.
(1)、实验开始时,溶液电导率较高的原因是溶液含有大量自由移动的离子(写离子符号)。(2)、如图乙,C点电导率最低的原因是;(3)、将恒压滴液漏斗中液体换成以下哪种溶液,测得电导率图像与图乙相似____;(可多选)A、HCl B、CuSO4 C、MgSO4 D、NaNO317. 化学兴趣小组的同学在帮助老师整理实验室时,意外地发现实验桌上有一瓶敞口放置的氢氧化钙粉末.于是对该粉末进行了如下探究.【提出问题】该瓶粉末的成分是什么?
(1)、【猜想与假设】猜想一:该瓶粉末的成分可能为氢氧化钙猜想二:该瓶粉末的成分可能为氢氧化钙和碳酸钙
猜想三:该瓶粉末的成分可能为 , 做出猜想三的理由是 .
(2)、【实验验证】请你参与探究,完成下面的实验报告.实验步骤
实验现象
实验结论
猜想二正确
⑴取少量样品于小烧杯中,加入适量水,充分搅拌,过滤,取少量滤渣于试管中,加入 .
有大量气泡产生
说明含有
⑵取步骤⑴中的于试管中,滴加无色酚酞溶液.
说明含有
(3)、【联想与启示】氢氧化钙露置在空气中会发生变质,变质的原因是 (用化学方程式表示),因此,必须保存.18. 某兴趣小组做了如下实验:①在止水夹K1、K2处于关闭状态时,将针筒A中溶液挤入试管B中,接着打开止水夹K1 , 发现D中的部分溶液被吸入试管B中,充分反应后,试管B留下的溶液也显红色;
②打开止水夹K2 , 风哨振动鸣叫,C中的部分溶液被吸入B和D中,反应后B、D中溶液都变为无色。
回答:
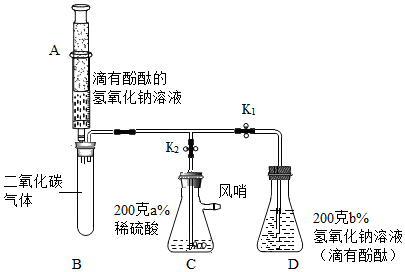 (1)、步骤①中,充分反应后,试管B里的CO2最终转化为(填化学式)和水。(2)、解释步骤②中“风哨振动鸣叫”的原因。(3)、实验开始时C、D中两种溶液中溶质质量分数大小关系为:a%b%(选填“>”“=”“<”)
(1)、步骤①中,充分反应后,试管B里的CO2最终转化为(填化学式)和水。(2)、解释步骤②中“风哨振动鸣叫”的原因。(3)、实验开始时C、D中两种溶液中溶质质量分数大小关系为:a%b%(选填“>”“=”“<”)四、解答题
-
19. 如图,关闭阀门K2 , 缓缓打开K1;氢氧化钠溶液进入烧瓶,轻轻震荡,发现溶液仍显红色;然后,关闭K1 , 缓缓打开K2 , 发现C中液体沿导管慢流入烧瓶瓶中无明显变化,开始时瓶中无明显变化,后有气泡产生,且溶液红色逐渐褪去。请解释产生上述现象的原因。
 20. 古籍中有记载制烧碱的方法,其核心反应可表示为:Na2CO3+Ca(OH)2=2NaOH+CaCO3↓
20. 古籍中有记载制烧碱的方法,其核心反应可表示为:Na2CO3+Ca(OH)2=2NaOH+CaCO3↓小宁模仿古法,以实验室中的Na2CO3、Ca(OH)2固体为原料,制备400g溶质质量分数为10%的NaOH溶液用于制作叶脉书签。
(1)、制作叶脉书签时,用NaOH溶液去除叶肉,是利用了NaOH的性。(2)、400g溶质质量分数为10%的NaOH溶液中,含NaOH的质量为g,水的质量为g。(3)、需称取Na2CO3、Ca(OH)2的质量各为多少?21. 实验室用金属镁与100g盐酸反应探究酸的性质。小宁取反应后的溶液,逐渐加入溶质质量分数为8%的NaOH溶液,产生沉淀质量与滴加溶液的质量关系如图所示。已知当NaOH溶液滴加至150g时不再有沉淀产生。求: (1)、0.58g沉淀的成分为 。(2)、a点时,与NaOH反应的物质化学式 。(3)、若在b点溶液中加AgNO3溶液,出现白色沉淀 (填“能”或“不能”)证明HCl有剩余;(4)、计算100g稀盐酸的溶质质量分数。22. 初三某班利用稀硫酸与氧化铜粉末反应探究稀硫酸的化学性质,实验后废液集中在一个废液缸中。为了探究废液的成分,同学们又进行了如下实验:取上层废液于烧杯中,加入一定溶质质量分数的氢氧化钠溶液。下表为生成沉淀总质量与所加氢氧化钠溶液总质量的关系。
(1)、0.58g沉淀的成分为 。(2)、a点时,与NaOH反应的物质化学式 。(3)、若在b点溶液中加AgNO3溶液,出现白色沉淀 (填“能”或“不能”)证明HCl有剩余;(4)、计算100g稀盐酸的溶质质量分数。22. 初三某班利用稀硫酸与氧化铜粉末反应探究稀硫酸的化学性质,实验后废液集中在一个废液缸中。为了探究废液的成分,同学们又进行了如下实验:取上层废液于烧杯中,加入一定溶质质量分数的氢氧化钠溶液。下表为生成沉淀总质量与所加氢氧化钠溶液总质量的关系。氢氧化钠溶液总质量/g
20
40
60
80
100
120
生成沉淀总质量/g
0.49
2.94
5.39
m
n
9.8
(1)、表中n=。(2)、所取的废液中溶质是。(3)、所加氢氧化钠溶液溶质的质量分数是多少?