2023-2024学年 浙教版科学 九年级上册 期末复习重难点提升练 专题01 常见的酸
试卷更新日期:2023-11-29 类型:复习试卷
一、选择题
-
1. 小科按图示操作进行酸的性质实验,下列有关分析正确的是( )
 A、若X是稀硫酸,则a可能是紫色石蕊试液 B、若X是稀硫酸,侧c一定J CuO固体液 C、若X是稀盐酸,则c一定是单质 D、若b是Fe2O3 , 则黄色溶液一定是氯化铁2. 探究中和反应是否发生的方法有多种。小华同学进行了以下四个实验,并用图像分别描述了实验过程中的现象。其中,依据图示现象不能判断中和反应一定发生的是( )A、
A、若X是稀硫酸,则a可能是紫色石蕊试液 B、若X是稀硫酸,侧c一定J CuO固体液 C、若X是稀盐酸,则c一定是单质 D、若b是Fe2O3 , 则黄色溶液一定是氯化铁2. 探究中和反应是否发生的方法有多种。小华同学进行了以下四个实验,并用图像分别描述了实验过程中的现象。其中,依据图示现象不能判断中和反应一定发生的是( )A、 在稀盐酸中加入氯化铜,然后向其中逐滴加入NaOH溶液
B、
在稀盐酸中加入氯化铜,然后向其中逐滴加入NaOH溶液
B、 在NaOH溶液中加入CaCO3 , 然后向其中逐滴加入稀盐酸
C、
在NaOH溶液中加入CaCO3 , 然后向其中逐滴加入稀盐酸
C、 在NaOH溶液中加入CuO,然后向其中逐滴加入稀硫酸
D、
在NaOH溶液中加入CuO,然后向其中逐滴加入稀硫酸
D、 在NaOH溶液中加入Ba(NO3)2 , 然后向其中逐滴加入稀硫酸
3. 如图所示,将一定量的液体X滴入烧瓶中,若使小气球鼓起(液体X的体积忽略不计),则液体X和固体Y不可能是( )
在NaOH溶液中加入Ba(NO3)2 , 然后向其中逐滴加入稀硫酸
3. 如图所示,将一定量的液体X滴入烧瓶中,若使小气球鼓起(液体X的体积忽略不计),则液体X和固体Y不可能是( ) A、水,生石灰 B、水,硝酸铵 C、过氧化氢溶液,二氧化锰 D、稀盐酸,碳酸钠4. 盐酸是实验室的重要物质,能与许多物质反应。如图有关描述不正确的是( )
A、水,生石灰 B、水,硝酸铵 C、过氧化氢溶液,二氧化锰 D、稀盐酸,碳酸钠4. 盐酸是实验室的重要物质,能与许多物质反应。如图有关描述不正确的是( ) A、X可能是H2O B、Y可能是硝酸钡 C、若W呈无色,指示剂可能是酚酞 D、碱可以是可溶性碱,也可以是难溶性碱5. 归纳和演绎是重要的科学方法,下列归纳或演绎合理的是( )A、纯净物是由一种物质组成的,所以纯净的空气是一种纯净物 B、酸与碱反应生成盐和水,所以生成盐和水的反应一定是酸与碱的反应 C、镁和稀硫酸反应能产生氢气,所以能和稀硫酸反应产生气体的物质一定是金属 D、碱性溶液能使石蕊试液变蓝,所以能使石蕊试液变蓝的溶液呈碱性6. 氯气(Cl2)能与水发生如下反应:Cl2+H2O=HCl+HCIO,其中HCIO是一种酸。将Cl2通入过量氢氧化钠溶液中,反应后的生成物有( )A、NaCl、H2O B、NaClO、H2O C、NaCl、NaCIO D、NaCl、NaCIO、H2O7. 下列关于盐酸的说法正确的是( )A、盐酸就是液态氯化氢 B、纯净的盐酸是浅黄色液体 C、浓盐酸在空气里会冒白烟 D、盐酸有腐蚀性8. 老师布置了以下四个实验,让同学们探究化学反应的发生。当把胶头滴管内的液体全部加入试管中,片刻后,通过观察反应物的变化,最容易判断出反应已经发生的是( )A、
A、X可能是H2O B、Y可能是硝酸钡 C、若W呈无色,指示剂可能是酚酞 D、碱可以是可溶性碱,也可以是难溶性碱5. 归纳和演绎是重要的科学方法,下列归纳或演绎合理的是( )A、纯净物是由一种物质组成的,所以纯净的空气是一种纯净物 B、酸与碱反应生成盐和水,所以生成盐和水的反应一定是酸与碱的反应 C、镁和稀硫酸反应能产生氢气,所以能和稀硫酸反应产生气体的物质一定是金属 D、碱性溶液能使石蕊试液变蓝,所以能使石蕊试液变蓝的溶液呈碱性6. 氯气(Cl2)能与水发生如下反应:Cl2+H2O=HCl+HCIO,其中HCIO是一种酸。将Cl2通入过量氢氧化钠溶液中,反应后的生成物有( )A、NaCl、H2O B、NaClO、H2O C、NaCl、NaCIO D、NaCl、NaCIO、H2O7. 下列关于盐酸的说法正确的是( )A、盐酸就是液态氯化氢 B、纯净的盐酸是浅黄色液体 C、浓盐酸在空气里会冒白烟 D、盐酸有腐蚀性8. 老师布置了以下四个实验,让同学们探究化学反应的发生。当把胶头滴管内的液体全部加入试管中,片刻后,通过观察反应物的变化,最容易判断出反应已经发生的是( )A、 B、
B、 C、
C、 D、
D、 9. 下列物质敞口露置在空气中,质量会增加的是( )A、浓盐酸 B、浓硫酸 C、食盐水 D、硫酸铜溶液10. 厨房蕴含着很多科学知识。下列物质与醋相遇会产生气泡的可能是( )A、食盐 B、木筷子 C、玻璃杯 D、大理石
9. 下列物质敞口露置在空气中,质量会增加的是( )A、浓盐酸 B、浓硫酸 C、食盐水 D、硫酸铜溶液10. 厨房蕴含着很多科学知识。下列物质与醋相遇会产生气泡的可能是( )A、食盐 B、木筷子 C、玻璃杯 D、大理石二、填空题
-
11. 构建知识网络,可以帮助我们理解知识的内在联系。下图是盐酸与不同类型物质之间反应的知识网络:
 (1)、图中M应为类物质。(2)、写出盐酸除铁锈(主要成分Fe2O3)的化学方程式是。12. 敞口放置的氢氧化钾溶液易吸收空气中的二氧化碳而变质,现向一定质量且部分变质的氢氧化钾溶液中逐滴加入稀盐酸,并振荡。如图表示反应过程中溶液质量随加入盐酸质量的变化而变化的情况。请回答:
(1)、图中M应为类物质。(2)、写出盐酸除铁锈(主要成分Fe2O3)的化学方程式是。12. 敞口放置的氢氧化钾溶液易吸收空气中的二氧化碳而变质,现向一定质量且部分变质的氢氧化钾溶液中逐滴加入稀盐酸,并振荡。如图表示反应过程中溶液质量随加入盐酸质量的变化而变化的情况。请回答: (1)、AB段对应的实验现象是 ,(2)、C点溶液中的溶质是。13. 盐酸和硫酸是两种重要的酸。(1)、浓硫酸使木棒或棉花变黑,体现了浓硫酸的 (选填“吸水性”、“脱水性”或“腐蚀性”)。(2)、如图为实验室稀释浓硫酸的操作示意图,其中烧杯中的液体A是。(选填“浓硫酸”或“水”)
(1)、AB段对应的实验现象是 ,(2)、C点溶液中的溶质是。13. 盐酸和硫酸是两种重要的酸。(1)、浓硫酸使木棒或棉花变黑,体现了浓硫酸的 (选填“吸水性”、“脱水性”或“腐蚀性”)。(2)、如图为实验室稀释浓硫酸的操作示意图,其中烧杯中的液体A是。(选填“浓硫酸”或“水”) 14. 生活中处处都要用到科学知识。(1)、吃松花蛋时,为消除蛋中因含碱性物质而引起的涩味,可加入少量(选填“苏打”、“食盐”或“食醋”);(2)、经发酵的面团往往发酸,若加些食品添加剂碳酸钠,做成馒头不仅酸味减弱,而且疏松多孔,原理是。15. 某兴趣小组同学进行如图甲所示的实验。实验结束后,他们把A、B两支试管中的物质倒入乙图烧杯中,充分混合后观察到有红褐色絮状沉淀生成,溶液呈黄色。
14. 生活中处处都要用到科学知识。(1)、吃松花蛋时,为消除蛋中因含碱性物质而引起的涩味,可加入少量(选填“苏打”、“食盐”或“食醋”);(2)、经发酵的面团往往发酸,若加些食品添加剂碳酸钠,做成馒头不仅酸味减弱,而且疏松多孔,原理是。15. 某兴趣小组同学进行如图甲所示的实验。实验结束后,他们把A、B两支试管中的物质倒入乙图烧杯中,充分混合后观察到有红褐色絮状沉淀生成,溶液呈黄色。 (1)、图甲中A试管充分反应后,有剩余的反应物为;(2)、通过以上现象能确定烧杯溶液中含有的溶质是。
(1)、图甲中A试管充分反应后,有剩余的反应物为;(2)、通过以上现象能确定烧杯溶液中含有的溶质是。三、实验探究题
-
16. 《天工开物》中有“煤饼烧石成灰”的记载(文中的“石”指石灰石),小乐对其展开探究,如图甲所示,先利用煤气灯(煤气灯加热能达到石灰石分解的温度,煤气的主要成分是CO)煅烧石灰石,然后完成后续操作;最后又补充做了如图乙所示实验。
观察到的现象:
①烧杯内壁上的澄清石灰水变浑浊;
②试管A中无色酚酞试液变红,试管B中无色酚酞试液不变色。
 (1)、能成为煅烧石灰石是化学反应的证据是现象(选填“①”、“②”或“①和②”)。(2)、继续向试管A上层清液中逐滴滴加稀盐酸,至红色恰好褪去,轻轻晃动试管A,溶液自下而上又变为红色。此时试管A红色溶液中一定存在的溶质有(指示剂除外)。(3)、为检验图甲所示实验中的石灰石是否完全分解,可取冷却研细后的粉末少许于试管中,加入足量稀盐酸,若观察到 , 说明未完全分解。17. 化学兴趣小组在完成实验室制取二氧化碳的实验后,欲对剩余废液的组成进行探究,并制定回收CaCl2的方案。用图1装置进行实验,将80mL一定质量分数的碳酸钠溶液逐滴加入到废液中,测得数据如图2。(1)、该废液中的溶质的组成为。
(1)、能成为煅烧石灰石是化学反应的证据是现象(选填“①”、“②”或“①和②”)。(2)、继续向试管A上层清液中逐滴滴加稀盐酸,至红色恰好褪去,轻轻晃动试管A,溶液自下而上又变为红色。此时试管A红色溶液中一定存在的溶质有(指示剂除外)。(3)、为检验图甲所示实验中的石灰石是否完全分解,可取冷却研细后的粉末少许于试管中,加入足量稀盐酸,若观察到 , 说明未完全分解。17. 化学兴趣小组在完成实验室制取二氧化碳的实验后,欲对剩余废液的组成进行探究,并制定回收CaCl2的方案。用图1装置进行实验,将80mL一定质量分数的碳酸钠溶液逐滴加入到废液中,测得数据如图2。(1)、该废液中的溶质的组成为。 (2)、b点发生反应的化学方程式为:。(3)、c点对应溶液中溶质的化学式为:。(4)、甲组同学提出直接蒸发溶剂可从剩余废液中回收纯净CaCl2 , 乙组同学认为此方法会对空气造成污染。在不借助其它试剂和仪器的情况下,除去废液中对空气造成污染的物质,建议最好先在废液中加入下面(填选项序号)试剂____。A、CaO B、Ca(OH)2 C、CaCO318. 小明取一包某食品包装袋内的“脱氧剂”,查阅资料发现其成分除铁粉外,可能含有碳粉、Na2CO3、NaCl、Fe2O3等。为确定其成分,进行了如下实验:
(2)、b点发生反应的化学方程式为:。(3)、c点对应溶液中溶质的化学式为:。(4)、甲组同学提出直接蒸发溶剂可从剩余废液中回收纯净CaCl2 , 乙组同学认为此方法会对空气造成污染。在不借助其它试剂和仪器的情况下,除去废液中对空气造成污染的物质,建议最好先在废液中加入下面(填选项序号)试剂____。A、CaO B、Ca(OH)2 C、CaCO318. 小明取一包某食品包装袋内的“脱氧剂”,查阅资料发现其成分除铁粉外,可能含有碳粉、Na2CO3、NaCl、Fe2O3等。为确定其成分,进行了如下实验: (1)、过滤操作中除了需带铁圈的铁架台、滤纸、玻璃棒外,还需要用到的仪器有。(2)、写出用 pH试纸测定滤液pH的方法。(3)、试剂X的名称是。(4)、由实验可知,该包“脱氧剂”一定含有的物质是。
(1)、过滤操作中除了需带铁圈的铁架台、滤纸、玻璃棒外,还需要用到的仪器有。(2)、写出用 pH试纸测定滤液pH的方法。(3)、试剂X的名称是。(4)、由实验可知,该包“脱氧剂”一定含有的物质是。四、解答题
-
19. 现有Na2CO3和NaCl的混合物样品22.3g,将其放入干净的烧杯中,加一定量的水使其完全溶解。向所得的溶液中逐滴加入溶质质量分数为7.3%的稀盐酸,烧杯中溶液的质量与滴入稀盐酸的质量关系曲线如图所示。试回答下列问题:
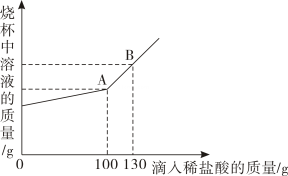 (1)、当滴入上述稀盐酸至图中B点时,烧杯中溶液里的溶质为(填写化学式)。(2)、在Na2CO3和NaCl的混合物样品中,含Na2CO3的质量为g。(3)、实验结束后,生成的气体质量为g。(4)、当滴入上述稀盐酸至图中A点时,试通过计算,求此温度时所得不饱和溶液中溶质质量。20. 图甲中A是一种常见的酸,它能与黑色固体B反应。将NaOH溶液渐渐加入到C中,生成蓝色沉淀E的质量与加入NaOH溶液的质量关系如图乙所示,在D中加入Ba(NO3)2溶液能生成一种不溶于稀硝酸的白色沉淀。
(1)、当滴入上述稀盐酸至图中B点时,烧杯中溶液里的溶质为(填写化学式)。(2)、在Na2CO3和NaCl的混合物样品中,含Na2CO3的质量为g。(3)、实验结束后,生成的气体质量为g。(4)、当滴入上述稀盐酸至图中A点时,试通过计算,求此温度时所得不饱和溶液中溶质质量。20. 图甲中A是一种常见的酸,它能与黑色固体B反应。将NaOH溶液渐渐加入到C中,生成蓝色沉淀E的质量与加入NaOH溶液的质量关系如图乙所示,在D中加入Ba(NO3)2溶液能生成一种不溶于稀硝酸的白色沉淀。 (1)、A溶液中溶质的化学式为。(2)、NaOH溶液中溶质的质量分数是多少?(3)、C溶液中加入NaOH溶液至恰好完全反应时,所得溶液溶质的质量是克。21. 实验室有一份在空气中潮解变质的氢氧化钠样品。某实验小组的的同学将这份样品完全溶解,配成50克溶液。然后缓慢滴入7.3%的稀盐酸,并进行搅拌,使气体全部逸出。滴加过程中,多次测量溶液pH和溶液总质量,部分数据记录见下表。(相关反应化学方程式:NaOH+HCl=NaCl+H2O;Na2CO3+2HCl=2NaCl+H2O+CO2↑)
(1)、A溶液中溶质的化学式为。(2)、NaOH溶液中溶质的质量分数是多少?(3)、C溶液中加入NaOH溶液至恰好完全反应时,所得溶液溶质的质量是克。21. 实验室有一份在空气中潮解变质的氢氧化钠样品。某实验小组的的同学将这份样品完全溶解,配成50克溶液。然后缓慢滴入7.3%的稀盐酸,并进行搅拌,使气体全部逸出。滴加过程中,多次测量溶液pH和溶液总质量,部分数据记录见下表。(相关反应化学方程式:NaOH+HCl=NaCl+H2O;Na2CO3+2HCl=2NaCl+H2O+CO2↑)测量次数
第1次
第6次
第16次
第21次
第26次
滴加的稀盐酸总质量/克
0
5
15
20
25
溶液总质量/克
50
55
m
69.78
74.78
溶液pH
12.4
12.1
7.0
2.2
2.1
(1)、第21次测量时,溶液中的溶质有。(2)、表中m=。(3)、求该样品中氢氧化钠固体的质量。22. 为测定某石灰石中碳酸钙的质量分数,将一定质量的石灰石样品粉碎后分成三等份,由三位同学进行实验(石灰石中杂质不与盐酸反应,不溶于水,加热不分解)①甲同学将样品置于烧杯中,逐渐加入某浓度的盐酸,反应过程测得剩余固体质量和加入盐酸的质量关系如图a所示。
②乙同学进行如图b所示的实验,通过电子天平示数的减少来计算样品中碳酸钙的含量。

根据信息,请回答下列问题:
(1)、根据甲同学的实验可知样品中碳酸钙的含量为多少。(计算结果保留0.1%)(2)、请根据图a计算甲同学所用盐酸的质量分数。(计算结果保留0.1%)(3)、乙同学测得样品中的碳酸钙含量明显比甲同学所得的结果小,你认为可能的原因是 (可多选)A、盐酸具有挥发性 B、反应速度快锥形瓶中部分水蒸气随二氧化碳逸出 C、反应结束后,锥形瓶内有二氧化碳残留 D、甲组实验中固体未洗涤干燥进行称量 E、乙组实验盐酸的量太少,样品没有反应完