福建省福州市八县市一中2023-2024学年高一上学期期中联考化学试题
试卷更新日期:2023-11-23 类型:期中考试
一、选择题(共15小题,每小题3分,共45分。每小题有且仅有一个正确答案)
-
1. 化学与人类生活、生产和社会可持续发展密切相关,下列说法正确的是( )A、为了防止富脂食品氧化变质,延长食品的保质期,在包装袋中常放入生石灰 B、用活性炭为糖浆脱色和用次氯酸盐漂白纸浆的原理相同 C、“铁质菜刀生锈”与氧化还原反应有关 D、明矾可以用于饮用水杀菌消毒2. 下列说法不正确的是( )A、Se是人体必需的微量元素,和互为同位素 B、(核磁共振)可用于含碳化合物的结构分析,的中子数为7 C、H2、HD不是同素异形体 D、Na+ 的结构示意图:
 3. 将盛有氢氧化铁胶体和少量KCl稀溶液的半透膜浸入蒸馏水中,如图所示。一段时间后,取烧杯内半透膜外的液体进行分析,下列描述错误的是( )
3. 将盛有氢氧化铁胶体和少量KCl稀溶液的半透膜浸入蒸馏水中,如图所示。一段时间后,取烧杯内半透膜外的液体进行分析,下列描述错误的是( ) A、液体属于混合物 B、该液体能透过滤纸 C、滴入几滴AgNO3溶液,有白色沉淀产生 D、可见光束通过液体时,产生丁达尔现象4. 在海洋碳循环中,通过下图所示的途径固碳。下列说法正确的是( )
A、液体属于混合物 B、该液体能透过滤纸 C、滴入几滴AgNO3溶液,有白色沉淀产生 D、可见光束通过液体时,产生丁达尔现象4. 在海洋碳循环中,通过下图所示的途径固碳。下列说法正确的是( ) A、该循环减少了碳的排放,有利于实现“碳达峰、碳中和” B、该循环过程中未涉及氧化还原反应 C、碳酸氢钠的电离方程式为NaHCO3=Na+ + H+ + CO D、光合作用将化学能转换成光能5. 下列关于物质分类的组合正确的是( )
A、该循环减少了碳的排放,有利于实现“碳达峰、碳中和” B、该循环过程中未涉及氧化还原反应 C、碳酸氢钠的电离方程式为NaHCO3=Na+ + H+ + CO D、光合作用将化学能转换成光能5. 下列关于物质分类的组合正确的是( )分类组合
混合物
酸
碱
盐
酸性氧化物
A
胆矾
HNO3
C2H5OH
NaHCO3
CO2
B
汽油
CH3COOH
Ca(OH)2
NaBr
SO2
C
盐酸
HClO
Cu(OH)2CO3
BaSO4
CaO
D
漂白粉
HBr
KOH
NH4Cl
CO
A、A B、B C、C D、D6. 下列有关实验操作、实验现象及实验结论都正确的是( )选项
实验操作
实验现象或结论
A
向CaCl2溶液中通入少量CO2
有白色沉淀生成,白色沉淀为CaCO3
B
红热的铜丝放入盛有氯气的集气瓶中
有白烟生成,白烟为固体CuCl2
C
向某溶液中加入硫酸酸化的硝酸银溶液
若有白色沉淀产生且沉淀不变色,则说明溶液中含有氯离子
D
用洁净的铂丝蘸取少量溶液在酒精灯火焰上灼烧,火焰呈黄色
火焰呈黄色,不能证明溶液中无K+
A、A B、B C、C D、D7. 下列物质的分离方法正确的是( ) A、装置A可用于分离汽油和水的混合物 B、装置B可用于四氯化碳提取溴水中的溴 C、装置C可用于灼烧胆矾,制备无水硫酸铜 D、装置D可用于分离丁醇(沸点117.5℃)与甲苯(沸点110.6℃)8. 表示阿伏加德罗常数的值,下列说法中正确的是( )A、常温常压下,32gO2-中所含电子的数目为16NA B、标准状况下,11.2L CCl4中含有的分子数为0.5NA C、物质的量浓度为0.5mol/L的MgCl2溶液中,含有氯离子的物质的量为1mol D、常温常压下,28gN2和CO混合气体中含有2NA个原子9. 室温下,某容积固定的密闭容器由可移动的活塞隔成甲、乙两室,向甲中充入34gH2和O2的混合气体,向乙中充入1mol 空气,此时活塞的位置如图所示。下列有关说法错误的是 ( )
A、装置A可用于分离汽油和水的混合物 B、装置B可用于四氯化碳提取溴水中的溴 C、装置C可用于灼烧胆矾,制备无水硫酸铜 D、装置D可用于分离丁醇(沸点117.5℃)与甲苯(沸点110.6℃)8. 表示阿伏加德罗常数的值,下列说法中正确的是( )A、常温常压下,32gO2-中所含电子的数目为16NA B、标准状况下,11.2L CCl4中含有的分子数为0.5NA C、物质的量浓度为0.5mol/L的MgCl2溶液中,含有氯离子的物质的量为1mol D、常温常压下,28gN2和CO混合气体中含有2NA个原子9. 室温下,某容积固定的密闭容器由可移动的活塞隔成甲、乙两室,向甲中充入34gH2和O2的混合气体,向乙中充入1mol 空气,此时活塞的位置如图所示。下列有关说法错误的是 ( ) A、甲室H2、O2的体积比为1:2 B、甲室混合气体的分子总数约为2NA C、甲室混合气体的密度是同温同压时H2密度的8.5倍 D、若将甲室H2、O2的混合气体点燃引爆,恢复原室温后,最终活塞停留的位置在刻度2处10. 除去下列物质中的杂质(括号内为杂质),选用试剂及操作方法均正确的一组是( )
A、甲室H2、O2的体积比为1:2 B、甲室混合气体的分子总数约为2NA C、甲室混合气体的密度是同温同压时H2密度的8.5倍 D、若将甲室H2、O2的混合气体点燃引爆,恢复原室温后,最终活塞停留的位置在刻度2处10. 除去下列物质中的杂质(括号内为杂质),选用试剂及操作方法均正确的一组是( )选项
待提纯的物质
选用的试剂
操作的方法
A
CO2(HCl)
氢氧化钠溶液
洗气
B
Cu(Fe)
稀盐酸
溶解、过滤、洗涤、干燥
C
FeSO4(H2SO4)
氢氧化钠溶液
过滤
D
N2(CO)
氧气
点燃
A、A B、B C、C D、D11. 下列关于氯及其化合物的说法中正确的是( )A、Cl2的化学性质非常活泼,因此不能用钢瓶贮存液氯 B、新制氯水在密闭无色玻璃瓶中放置数天后酸性减弱 C、向氯水中加入NaHCO3粉末,有气泡产生,说明氯水中含有HClO D、H2在Cl2中燃烧,火焰呈苍白色,工业上利用该原理生产盐酸12. 甲、乙、丙有如图所示的转化关系(“→”表示反应一步实现,部分物质和反应条件已略去)。下列各组物质按照甲、乙、丙的顺序不符合要求的是( ) A、H2O2 、H2O、O2 B、NaOH、Na2CO3、NaNO3 C、CO2、CaCO3、CaO D、Fe2O3、FeCl3、Fe(OH)313. 把aL含硫酸铵和硝酸铵的混合液分成2等份,一份需用bmol烧碱刚好把铵全部反应,另一份与氯化钡溶液完全反应时,消耗2cmol氯化钡。由此可知原溶液中NO离子的物质的量浓度为(注:SO+Ba2+=BaSO4↓、NH+ OH-=NH3·H2O)( )A、 mol/L B、 mol/L C、 mol/L D、 mol/L14. 为除去粗盐中的Ca2+、Mg2+、SO及泥沙等杂质,某同学设计了一种制备精盐的实验方案,流程如图,下列说法正确的是( )
A、H2O2 、H2O、O2 B、NaOH、Na2CO3、NaNO3 C、CO2、CaCO3、CaO D、Fe2O3、FeCl3、Fe(OH)313. 把aL含硫酸铵和硝酸铵的混合液分成2等份,一份需用bmol烧碱刚好把铵全部反应,另一份与氯化钡溶液完全反应时,消耗2cmol氯化钡。由此可知原溶液中NO离子的物质的量浓度为(注:SO+Ba2+=BaSO4↓、NH+ OH-=NH3·H2O)( )A、 mol/L B、 mol/L C、 mol/L D、 mol/L14. 为除去粗盐中的Ca2+、Mg2+、SO及泥沙等杂质,某同学设计了一种制备精盐的实验方案,流程如图,下列说法正确的是( ) A、第①步操作A是溶解,第⑦步操作C是过滤 B、第③步作用是除掉Ca2+ C、第⑥步不可以调至第④步和第⑤步之间 D、第①⑤⑦步操作都用到漏斗15. 现有一混合物的水溶液,可能含有以下离子中的若干种:K+、NH、Ba2+、CO、Cl-、SO。现取两份各200mL溶液进行如下实验:
A、第①步操作A是溶解,第⑦步操作C是过滤 B、第③步作用是除掉Ca2+ C、第⑥步不可以调至第④步和第⑤步之间 D、第①⑤⑦步操作都用到漏斗15. 现有一混合物的水溶液,可能含有以下离子中的若干种:K+、NH、Ba2+、CO、Cl-、SO。现取两份各200mL溶液进行如下实验:①第一份加足量NaOH溶液,加热,收集到气体1.7g;
②第二份加足量BaCl2溶液后,得干燥沉淀12.54g,经足量盐酸洗涤、干燥后,沉淀质量为4.66g。
根据上述实验,以下推测正确的是( )
A、一定存在NH、CO、SO , 一定不存在Ba2+、Cl- B、一定存在NH、CO、Cl-、SO , 可能存在K+ C、若溶液中存在NH、Cl-、CO、SO、K+五种离子,则c(K+)>0.1mol·L-1 D、c(SO)=0.1mol·L-1 , c(NH)<c(SO)二、填空题(共5题,共55分)
-
16. 根据物质的组成、结构、性质等进行分类,可预测物质的性质及变化:(1)、SiO2是普通玻璃的主要成分,与CO2一样是酸性氧化物,写出SiO2溶于NaOH溶液的化学方程式:。(2)、现有:①熔融KOH;②稀硫酸;③氨水;④明矾(KAl(SO4)2·12H2O);⑤蔗糖;⑥铜;⑦H2S;其中能导电的是(填序号,下同);属于电解质的是。写出④在水溶液中的电离方程式:。(3)、酸式盐是盐的一种,可看作是多元酸中的氢离子未被完全中和所得到的盐,常见的有NaHCO3、NaHSO4、KH2PO4、K2HPO4等。已知H3PO2(次磷酸)与足量的NaOH反应只生成一种盐。
①NaH2PO2为。(填序号)
A.正盐 B.酸式盐 C.碱式盐
②写出H3PO2溶液与足量NaOH溶液反应的化学方程式。
17. 回答下列问题(用NA表示阿伏加德罗常数的值)(1)、40.5g某金属氯化物MCl2中含0.6molCl- , 则该氯化物的摩尔质量为。(2)、标准状况下,与34g的H2S气体含相同H原子数的CH4的体积为。(3)、从400mL2.0mol/L的Al2(SO4)3溶液中取出20mL,将这20mL溶液用水稀释到100mL,所得溶液中SO的物质的量浓度为。(4)、在0.3L由NaCl、MgCl2、CaCl2组成的混合液中,部分离子浓度大小如图所示。
该混合液中CaCl2的物质的量为。
18. 过氧化钙(CaO2)微溶于水,可作医用防腐剂、消毒剂,以下是制备CaO2的一种方法。回答下列问题:
回答下列问题:
(1)、CaO2中氧元素化合价。(2)、步骤Ⅱ中反应的化学方程式是(有NH4Cl生成):。(3)、反应在冰水浴中进行,目的是为了防止NH3·H2O分解和。(答1条即可)(4)、待CaO2·8H2O结晶析出后通过(填操作名称)分离。(5)、CaO2久置于空气中会生成CaCO3 , 为测定某CaO2样品的纯度,取10g样品加入足量稀盐酸,测得生成CO2的质量为1.1g,则样品中CaO2的质量分数为。19. 某家用防疫用品“84消毒液”的包装说明如下,请回答下列问题:【产品名称】84消毒液
【有效成分】NaClO
【规格】1000mL
【物质的量浓度】4.0
注:①按一定比例稀释后使用
②不得与酸性产品(如洁厕灵)同时使用。
(1)、“84”消毒液可由Cl2与NaOH溶液反应制得,Cl2与NaOH溶液反应的化学方程式为(2)、欲将“84消毒液”原液稀释配制成450mL c(NaClO)=0.100mol·L-1的溶液。①配制过程中,需要用到的玻璃仪器有烧杯、玻璃棒、胶头滴管、、。
②配制时,需要取用mL“84消毒液”原液。
③下列操作会使溶液中NaClO浓度偏低的是。
A.取用的“84消毒液”原液是久置的
B.定容操作时,俯视刻度线
C.量取“84消毒液”原液时,仰视读数
D.定容摇匀后,液面低于刻度线,再加水至刻度线
(3)、利用如图装置探究84消毒液与洁厕灵(主要成分为盐酸)的反应,当注射器中的洁厕灵注入试管中时,装置内产生黄绿色气体,可观察到pH试纸的现象是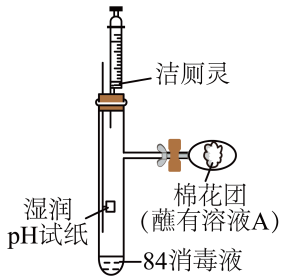 20. 实验室用下图所示装置进行氯气性质的探究并制备无水FeCl3查阅相关资料可知:无水FeCl3在空气中易潮解,加热易升华。
20. 实验室用下图所示装置进行氯气性质的探究并制备无水FeCl3查阅相关资料可知:无水FeCl3在空气中易潮解,加热易升华。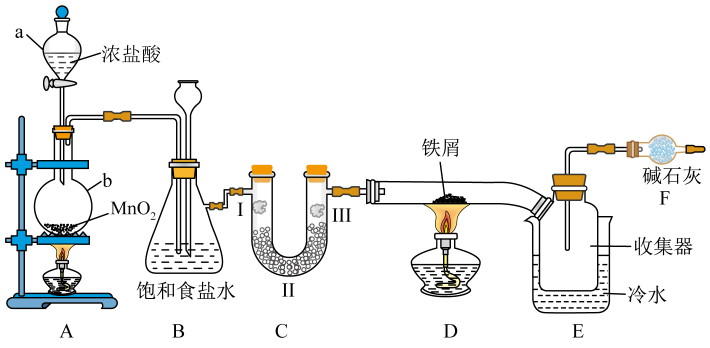 (1)、仪器b的名称为(2)、若实验时使用的17.4gMnO2 完全反应,产生的Cl2在标准状况下的体积为。(3)、装置B的作用是 , 同时用作安全瓶(监测实验时装置C中是否发生堵塞);若装置C发生堵塞,则装置B中将观察到的现象是。(4)、装置C的作用是验证氯气是否具有漂白性,为此,实验时装置C中Ⅰ、Ⅱ、Ⅲ处依次放入的物质是(填字母)。
(1)、仪器b的名称为(2)、若实验时使用的17.4gMnO2 完全反应,产生的Cl2在标准状况下的体积为。(3)、装置B的作用是 , 同时用作安全瓶(监测实验时装置C中是否发生堵塞);若装置C发生堵塞,则装置B中将观察到的现象是。(4)、装置C的作用是验证氯气是否具有漂白性,为此,实验时装置C中Ⅰ、Ⅱ、Ⅲ处依次放入的物质是(填字母)。A
B
C
D
Ⅰ
干燥的有色布条
湿润的有色布条
干燥的有色布条
湿润的有色布条
Ⅱ
碱石灰
无水氯化钙
无水氯化钙
浓硫酸
Ⅲ
湿润的有色布条
干燥的有色布条
湿润的有色布条
干燥的有色布条
(5)、装置D中生成的FeCl3大部分进入收集器,少量沉积在D装置的右端,要使沉积的FeCl3进入收集器,操作是(6)、实验结束时,应先熄灭(填“A”或“D”)处酒精灯;E中冷水的作用是。(7)、装置F的作用。