福建省福州市五校2023-2024学年高二上学期期中联考化学试题
试卷更新日期:2023-11-23 类型:期中考试
一、选择题(本大题共16小题,每小题3分,共48分)
-
1. 化学与生产、生活、科技密切相关。下列有关说法不正确的是( )A、一次性保暖贴利用了铁被腐蚀时放热的原理 B、植树造林有利于实现“碳中和”,其捕获和储存大气中的CO2过程涉及了氧化还原反应 C、将桥墩钢铁与外接电源负极相连的方法,称为牺牲阳极的阴极保护法 D、“绿氢”燃料电池客车投入“冰丝带”:光伏电解水制氢可作为“绿氢”的主要来源2. 下列反应既是氧化还原反应,又是放热反应的是( )A、碳和二氧化碳在高温下的反应 B、碳酸钙高温分解 C、氢氧化钠和盐酸的反应 D、铝片和稀硫酸反应3. 某反应的能量变化如图所示,下列说法正确的是( )
 A、反应物比生成物稳定 B、该反应为吸热反应 C、该反应在低温下可以自发进行 D、温度升高会降低该反应的正反应速率4. 化学用语是学习化学的重要工具,下列用来表示物质变化的化学用语中,正确的是( )A、电解饱和食盐水时,阳极的电极反应式为:2Cl--2e-=Cl2↑ B、电解过程中,化学能转化为电能 C、粗铜精炼时,与电源正极相连的是纯铜,电极反应式为:Cu-2e-=Cu2+ D、“Fe—稀硫酸—Cu原电池”中负极反应为:Fe-3e-=Fe3+5. 反应A(g)+2B(g)⇌C(g)的能量变化与反应进程关系如图所示,下列说法不正确的是( )
A、反应物比生成物稳定 B、该反应为吸热反应 C、该反应在低温下可以自发进行 D、温度升高会降低该反应的正反应速率4. 化学用语是学习化学的重要工具,下列用来表示物质变化的化学用语中,正确的是( )A、电解饱和食盐水时,阳极的电极反应式为:2Cl--2e-=Cl2↑ B、电解过程中,化学能转化为电能 C、粗铜精炼时,与电源正极相连的是纯铜,电极反应式为:Cu-2e-=Cu2+ D、“Fe—稀硫酸—Cu原电池”中负极反应为:Fe-3e-=Fe3+5. 反应A(g)+2B(g)⇌C(g)的能量变化与反应进程关系如图所示,下列说法不正确的是( )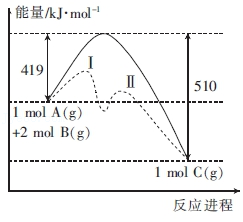 A、图中虚线表示加入了催化剂 B、图中虚线表示的反应Ⅰ、反应Ⅱ均为放热反应 C、加入催化剂,速率加快是因为改变了反应的焓变 D、该反应的焓变△H=﹣91 kJ•mol﹣16. 肼()-空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液。下列说法中,不正确的是( )A、该电池放电时,通入肼的一极为负极 B、电池每释放转移的电子数为 C、通入空气的一极的电极反应式是 D、电池工作一段时间后,电解质溶液的pH将不变7. 控制合适的条件,将反应2Fe3++2I﹣⇌2Fe2++I2设计成如图所示的原电池.下列说法不正确的是( )
A、图中虚线表示加入了催化剂 B、图中虚线表示的反应Ⅰ、反应Ⅱ均为放热反应 C、加入催化剂,速率加快是因为改变了反应的焓变 D、该反应的焓变△H=﹣91 kJ•mol﹣16. 肼()-空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液。下列说法中,不正确的是( )A、该电池放电时,通入肼的一极为负极 B、电池每释放转移的电子数为 C、通入空气的一极的电极反应式是 D、电池工作一段时间后,电解质溶液的pH将不变7. 控制合适的条件,将反应2Fe3++2I﹣⇌2Fe2++I2设计成如图所示的原电池.下列说法不正确的是( )
 A、盐桥中的K+移向FeCl3溶液 B、反应开始时,乙中石墨电极上发生氧化反应 C、电流计读数为零时,反应达到化学平衡状态 D、电流计读数为零后,在甲中溶入FeCl2固体,乙中石墨电极为负极8. 如图为反应2H2(g)+O2(g)═2H2O(g)的能量变化示意图,下列说法错误的是( )
A、盐桥中的K+移向FeCl3溶液 B、反应开始时,乙中石墨电极上发生氧化反应 C、电流计读数为零时,反应达到化学平衡状态 D、电流计读数为零后,在甲中溶入FeCl2固体,乙中石墨电极为负极8. 如图为反应2H2(g)+O2(g)═2H2O(g)的能量变化示意图,下列说法错误的是( ) A、拆开2molH2(g)和1molO2(g)中的化学键共吸收1368kJ能量 B、由H、O原子形成2molH2O(g),共放出1852kJ能量 C、1molH2(g)和molO2(g)反应生成1molH2O(l),放出热量小于242kJ D、2molH2(g)和1molO2(g)反应生成2molH2O(g),共放出484kJ热量9. A(g)+3B(g) 2C(g)+2D(g)在不同情况下测得反应速率,其中反应速率最快的是( )A、v(A)=0.5mol/(L•min) B、v(B)=1.2mol/(L•min) C、v(C)=0.9mol/(L•min) D、v(D)=0.04mol/(L•s)10. 有关热化学方程式书写与对应表述均正确的是( )A、稀硫酸与稀NaOH溶液反应:H+(aq) + OH-(aq) =H2O(l) ΔH= + 57.3 kJ ·mol-1 B、已知2 C(s) + 2 O2(g) =2 CO2(g) ΔH1 ,2 C(s) + O2(g) =2 CO(g) ΔH2 , 则 ΔH1>ΔH2 C、CO(g)的燃烧热 ΔH =-283.0 kJ•mol-1 , 则2 CO2(g) = 2CO(g) +O2(g) ΔH = + 566.0 kJ•mol-1 D、500 ℃、30 MPa 下,将 0.5 mol N2 和 1.5 mol H2 置于密闭的容器中充分反应生成 NH3(g),放出热量 19.3 kJ,其热化学方程式为 N2(g) + 3 H2(g) 2 NH3(g)ΔH= -38.6kJ·mol-111. 在一定温度下的容积不变的密闭容器中发生反应:22SO3(g)。下列不能说明反应达到平衡状态的是( )A、各物质的浓度不再变化 B、混合物的密度不再变化 C、SO2的体积分数不再变化 D、气体的压强不再变化12. 一定条件下,将和混合于恒容的密闭容器中,发生反应:。末该反应达到平衡,生成W的物质的量随时间的变化情况如图所示。下列判断正确的是( )
A、拆开2molH2(g)和1molO2(g)中的化学键共吸收1368kJ能量 B、由H、O原子形成2molH2O(g),共放出1852kJ能量 C、1molH2(g)和molO2(g)反应生成1molH2O(l),放出热量小于242kJ D、2molH2(g)和1molO2(g)反应生成2molH2O(g),共放出484kJ热量9. A(g)+3B(g) 2C(g)+2D(g)在不同情况下测得反应速率,其中反应速率最快的是( )A、v(A)=0.5mol/(L•min) B、v(B)=1.2mol/(L•min) C、v(C)=0.9mol/(L•min) D、v(D)=0.04mol/(L•s)10. 有关热化学方程式书写与对应表述均正确的是( )A、稀硫酸与稀NaOH溶液反应:H+(aq) + OH-(aq) =H2O(l) ΔH= + 57.3 kJ ·mol-1 B、已知2 C(s) + 2 O2(g) =2 CO2(g) ΔH1 ,2 C(s) + O2(g) =2 CO(g) ΔH2 , 则 ΔH1>ΔH2 C、CO(g)的燃烧热 ΔH =-283.0 kJ•mol-1 , 则2 CO2(g) = 2CO(g) +O2(g) ΔH = + 566.0 kJ•mol-1 D、500 ℃、30 MPa 下,将 0.5 mol N2 和 1.5 mol H2 置于密闭的容器中充分反应生成 NH3(g),放出热量 19.3 kJ,其热化学方程式为 N2(g) + 3 H2(g) 2 NH3(g)ΔH= -38.6kJ·mol-111. 在一定温度下的容积不变的密闭容器中发生反应:22SO3(g)。下列不能说明反应达到平衡状态的是( )A、各物质的浓度不再变化 B、混合物的密度不再变化 C、SO2的体积分数不再变化 D、气体的压强不再变化12. 一定条件下,将和混合于恒容的密闭容器中,发生反应:。末该反应达到平衡,生成W的物质的量随时间的变化情况如图所示。下列判断正确的是( ) A、当混合气体的密度不再改变时,该反应达到平衡状态 B、用Z表示的反应速率为 C、从到过程中,气体的压强没有变化 D、反应过程中X和Y的转化率之比为3∶113. 利用如图装置进行实验,开始时,a、b两处液面相平,密封好,放置一段时间。下列说法不正确的是( )
A、当混合气体的密度不再改变时,该反应达到平衡状态 B、用Z表示的反应速率为 C、从到过程中,气体的压强没有变化 D、反应过程中X和Y的转化率之比为3∶113. 利用如图装置进行实验,开始时,a、b两处液面相平,密封好,放置一段时间。下列说法不正确的是( ) A、a管发生吸氧腐蚀,b管发生析氢腐蚀 B、一段时间后,a管液面高于b管液面 C、a处溶液的pH增大,b处溶液的pH减小 D、a、b两处具有相同的电极反应式:Fe-2e-=Fe2+14. 用石墨作电极,电解1 mol.L-1下列物质的溶液,溶液的pH保持不变的是( )A、HCl B、CuSO4 C、Na2SO4 D、NaCl15. 已知某化学反应的平衡常数表达式为K= , 在不同的温度下该反应的平衡常数如表所示:
A、a管发生吸氧腐蚀,b管发生析氢腐蚀 B、一段时间后,a管液面高于b管液面 C、a处溶液的pH增大,b处溶液的pH减小 D、a、b两处具有相同的电极反应式:Fe-2e-=Fe2+14. 用石墨作电极,电解1 mol.L-1下列物质的溶液,溶液的pH保持不变的是( )A、HCl B、CuSO4 C、Na2SO4 D、NaCl15. 已知某化学反应的平衡常数表达式为K= , 在不同的温度下该反应的平衡常数如表所示:t/℃
700
800
830
1 000
1 200
K
1.67
1.11
1.00
0.60
0.38
下列有关叙述正确的是( )
A、该反应的化学方程式是CO2(g)+H2(g)⇌CO(g)+H2O(g) B、上述反应的正反应是吸热反应 C、若在1 L的密闭容器中通入CO和H2O各1 mol,5 min后温度升高到830℃,此时测得CO为0.4 mol,则该反应达到平衡状态 D、若平衡浓度符合5c(CO2)·c(H2)= 3c(CO)·c(H2O),则此时的温度为1000℃16. 以Fe[Fe(CN)6]为代表的新型可充电钠离子电池,其放电工作原理如图所示。下列说法错误的是( ) A、放电时,正极反应式为Fe[Fe(CN)6]+2Na++2e-=Na2Fe[Fe(CN)6] B、充电时,Mo箔接电源的正极 C、充电时,Na+通过离子交换膜从左室移向右室 D、外电路通过0.2 mol电子时,负极质量变化为1.2g
A、放电时,正极反应式为Fe[Fe(CN)6]+2Na++2e-=Na2Fe[Fe(CN)6] B、充电时,Mo箔接电源的正极 C、充电时,Na+通过离子交换膜从左室移向右室 D、外电路通过0.2 mol电子时,负极质量变化为1.2g二、非选择题 共52分
-
17.(1)、I.25℃、101kPa时,使1.0 g乙烯与足量的氧气反应,生成CO2和液态H2O并放出50 KJ的热量,表示乙烯燃烧热的热化学方程式为。(2)、比较下列热化学方程式中ΔH的大小关系。
CH4 (g)+2O2 (g)=CO2 (g)+2H2O (l) ΔH1
CH4 (g)+2O2 (g)=CO2 (g)+2H2O (g) ΔH2
则ΔH1ΔH2
(3)、依据盖斯定律可以对某些难以通过实验直接测定的化学反应的焓变进行推算。已知:C (s,石墨) + O2 (g) = CO2 (g) ΔH1
2H2 (g) + O2 (g ) = 2H2O (l) ΔH2
2C2H2 (g) + 5 O2 (g ) = 4 CO2 (g) + 2 H2O (1) ΔH3
则2C (s,石墨)+ H2 (g)= C2H2 (g) 反应的ΔH的表达式为:ΔH =。
(4)、II.草酸与高锰酸钾在酸性条件下能够发生如下反应:
2MnO4- + 5H2C2O4 + 6H+ = 2 Mn2++ 10CO2↑ + 8H2O。现用4 mL 0.001 mol/L KMnO4溶液与2 mL 0.01 mol/L H2C2O4溶液,研究不同条件对化学反应速率的影响。改变的条件如下:
如果研究催化剂对化学反应速率的影响,使用实验和 (用I~IV表示,下同);如果研究温度对化学反应速率的影响,使用实验和。组别 10%硫酸体积/mL 温度/℃ 其他物质 I 2 mL 20 / II 2 mL 20 MnSO4固体 III 2 mL 30 / IV 1 mL 20 1 mL蒸馏水 (5)、对比实验I和IV,可以研究对化学反应速率的影响,实验IV中加入1 mL蒸馏水的目的是 。18.(1)、工业上利用CO和在催化剂作用下合成甲醇: , 已知反应中有关物质的化学键键能数据如下表所示:化学键
E/(kJ/mol)
436
343
1076
465
413
则
(2)、氮及其化合物在工农业生产、生活中有着重要作用。合成氨工业中: , 其化学平衡常数K与温度t的关系如表:t/℃
200
300
400
K
K1
K2
0.5
完成下列填空:
①试比较K1、K2的大小,K1K2(填写“>”、“=”或“<”)。
②400℃时,反应的化学平衡常数的值为。当测得NH3和N2、H2的物质的量浓度分别为3mol/L和2mol/L、1mol/L时,则该反应v(N2)(正)v(N2)(逆)(填写“>”、“=”或“<”)。
(3)、化学兴趣小组进行测定中和热的实验,装置如图,步骤如下。
a.用量筒量取盐酸倒入如图装置的小烧杯中,测出盐酸温度。
b.用另一量筒量取溶液,并用另一温度计测出其温度。
c.将NaOH溶液倒入小烧杯中,使之混合均匀,测得混合液最高温度。
①实验中,倒入NaOH溶液的正确操作是。
A.一次性快速倒入 B.分3次倒入 C.边搅拌边慢慢倒入
②若将各含1mol溶质的NaOH稀溶液、稀溶液、稀氨水,分别与足量的稀盐酸反应,放出的热量分别为、、 , 则、、的关系为。
③若通过测定计算出产生的热量为1.39kJ,请写出该反应的热化学方程式:。
19. 甲烷是重要的气体燃料和化工原料,由制取合成气(CO、)的反应原理为 。
回答下列问题:(1)、①当体系温度等于T K时 , 温度大于T时(填“>”“<”或“=”)0。②在一定温度下,恒容密闭容器中发生上述反应,下列状态表示反应一定达到平衡状态的有(填标号)。
A.
B.气体压强不再变化
C.单位时间每消耗1 mol , 同时产生3 mol
D.与的物质的量之比为1∶3
(2)、在体积为1L的恒容密闭容器中通入1 mol 和1 mol , 在不同条件下发生反应 , 测得平衡时的体积分数与温度的关系如图所示。
①该反应的平衡常数表达式。
②若q点对应的纵坐标为30,此时甲烷的转化率为 , 该条件下平衡常数(保留两位有效数字)。
20. 如图所示,某同学设计了一个燃料电池并探究氯碱工业原理的相关问题,其中乙装置中X为离子交换膜。请按要求回答相关问题:
 (1)、 甲装置中通入一极是负极。(2)、乙中X是(阴、阳)离子交换膜,向乙中加入几滴酚酞溶液,工作一段时间后电极(填Fe或C)附近溶液变红,请用化学用语解释相关原因(3)、若在标准状况下,有氧气参加反应,则乙装置中C电极上生成的气体的物质的量为(4)、若丙装置中a、b电极均为 , 则丙池电解的总反应离子方程式是(5)、化学在环境保护中起十分重要的作用,电化学降解法可用于治理水中硝酸盐污染,电化学降解的原理如上图所示:
(1)、 甲装置中通入一极是负极。(2)、乙中X是(阴、阳)离子交换膜,向乙中加入几滴酚酞溶液,工作一段时间后电极(填Fe或C)附近溶液变红,请用化学用语解释相关原因(3)、若在标准状况下,有氧气参加反应,则乙装置中C电极上生成的气体的物质的量为(4)、若丙装置中a、b电极均为 , 则丙池电解的总反应离子方程式是(5)、化学在环境保护中起十分重要的作用,电化学降解法可用于治理水中硝酸盐污染,电化学降解的原理如上图所示:电极上的电极反应式为